乙型肝炎病毒S蛋白的序列特征分析
李 滾,張 濤,楊鑫榮,盧香香
(西安工業大學 電子信息工程學院生物醫學工程系,西安 710021)
乙肝病毒屬于DNA病毒,具有嗜肝性,該病毒感染會演變成肝炎甚至發展成肝硬化,相關疾病給患者及其家庭帶來了沉重的負擔。乙肝病毒是一個相當小的病毒,成環狀、部分為雙鏈DNA。乙肝病毒編碼的幾種蛋白中S蛋白是病毒的包膜蛋白,與病毒進入細胞有關,吸引了眾多學者關注[1-2]。乙肝病毒S蛋白由226個氨基酸組成,屬于疏水蛋白質[3]。乙肝病毒S蛋白是乙肝病毒亞病毒顆粒的主要組成部分,它的數量遠比乙肝病毒顆粒多。以往研究者曾用生物信息學方法逐一對乙肝病毒基因區段的結構和功能的關系進行分析,不僅證明了乙肝病毒中部分功能區域的性質,而且發現了包膜蛋白上潛在的新功能域[4]。乙肝病毒大蛋白由S、PreS2和PreS1基因編碼的HBsAg、PreS2和PreS1共同構成,已有部分研究證實乙肝病毒S大蛋白能夠激活基因轉錄過程,促進肝癌發生,然而乙肝病毒S大蛋白在肝癌形成過程中所發揮的作用依然有很多問題有待研究。現有的乙肝免疫球蛋白都是針對乙肝病毒S蛋白的免疫球蛋白。和通過血液提純的免疫球蛋白途徑相比,單克隆抗體靶點清晰,靈敏度更高,特異性更強,同時,抗體的特異性結合能力和中和病毒的能力是評價中和抗體的關鍵指標。對乙肝病毒S蛋白進行深入研究有利于乙肝病毒的預防、診斷以及表位疫苗的研制[5]。本論文利用生物信息學方法分析乙肝病毒S蛋白的序列特征和抗原表位,預測該蛋白的抗原性,為進一步研究S蛋白結構與生物學功能提供參考依據。
1 材料及方法
1.1 材料
登陸NCBI網站,從GenBank(NIH遺傳序列數據庫)數據庫中獲取乙肝病毒S蛋白氨基酸序列(檢索號:ATY75544.1)。
1.2 方法
利用https://web.expasy.org/protparam/ 網站統計與計算乙肝病毒S蛋白序列組成;利用https://web.expasy.org/protparam/網站分析乙肝病毒S蛋白的親水性(疏水性);利用https://npsa-prabi. ibcp.fr/cgi-bin/npsa_automat.pl? page= npsa_ sopma. html網站分析乙肝病毒S蛋白的二級結構;利用http://www.cbs.dtu.dk/services/SignalP/網站分析乙肝病毒S蛋白的信號肽特征;利用http://www.cbs.dtu.dk/services/TMHMM/網站分析乙肝病毒S蛋白的跨膜區;利用http://tools.immuneepitope.org/bcell 網站預測乙肝病毒S蛋白最佳抗原表位形成位置;利用http://www.cbs.dtu.dk/services/NetPhos-2.0/網站分析乙肝病毒S蛋白的磷酸化位點[6]。并將上述各預測的數值化結果進行重新繪圖并分析。
2 結果與分析
2.1 乙肝病毒S蛋白序列的基本組成成分
乙肝病毒S蛋白由226個氨基酸組成,分子質量單位(Mr)為25 387.14。如圖1所示,圖中縱坐標表示不同的氨基酸,226個氨基酸中亮氨酸(Leu)、絲氨酸(Ser)、脯氨酸(Pro)、蘇氨酸(Thr)含量較高,分別占氨基酸總數的35%、25%、22%、19%。脂肪系數是99.60。理論等電點是8.21,原子總數是3 569。帶負電荷殘基的Asp(天冬氨酸)和Glu(谷氨酸)的數目是27,帶正電荷殘基的Arg(精氨酸)和Lys(賴氨酸)的總數目是18。N端的蛋白的為Met,S蛋白的不穩定系數是59.66,預測S蛋白屬于不穩定蛋白。乙肝病毒S蛋白的半衰期在體外的哺乳動物網狀細胞內是30 h,在酵母體內大于20 h,在大腸桿菌內大于10 h。
2.2 乙肝病毒S蛋白的親水性(疏水性)
乙肝病毒S蛋白的總平均親水性為0.649,可能是疏水蛋白質。該蛋白質的組成成分氨基酸的側鏈大部分或者全部由碳原子和氫原子組成,不太可能與水分子形成氫鍵。圖2疏水性的測試結果集中反映了不同氨基酸位置的親疏水性分布情況,閾值線為0,閾值線以上部分的氨基酸殘基表現為疏水性,閾值線以下部分的氨基酸殘基表現為親水性。可以看出在(130-170)和(190-210)位置為高疏水值區域,附近可能存在潛在跨膜區。
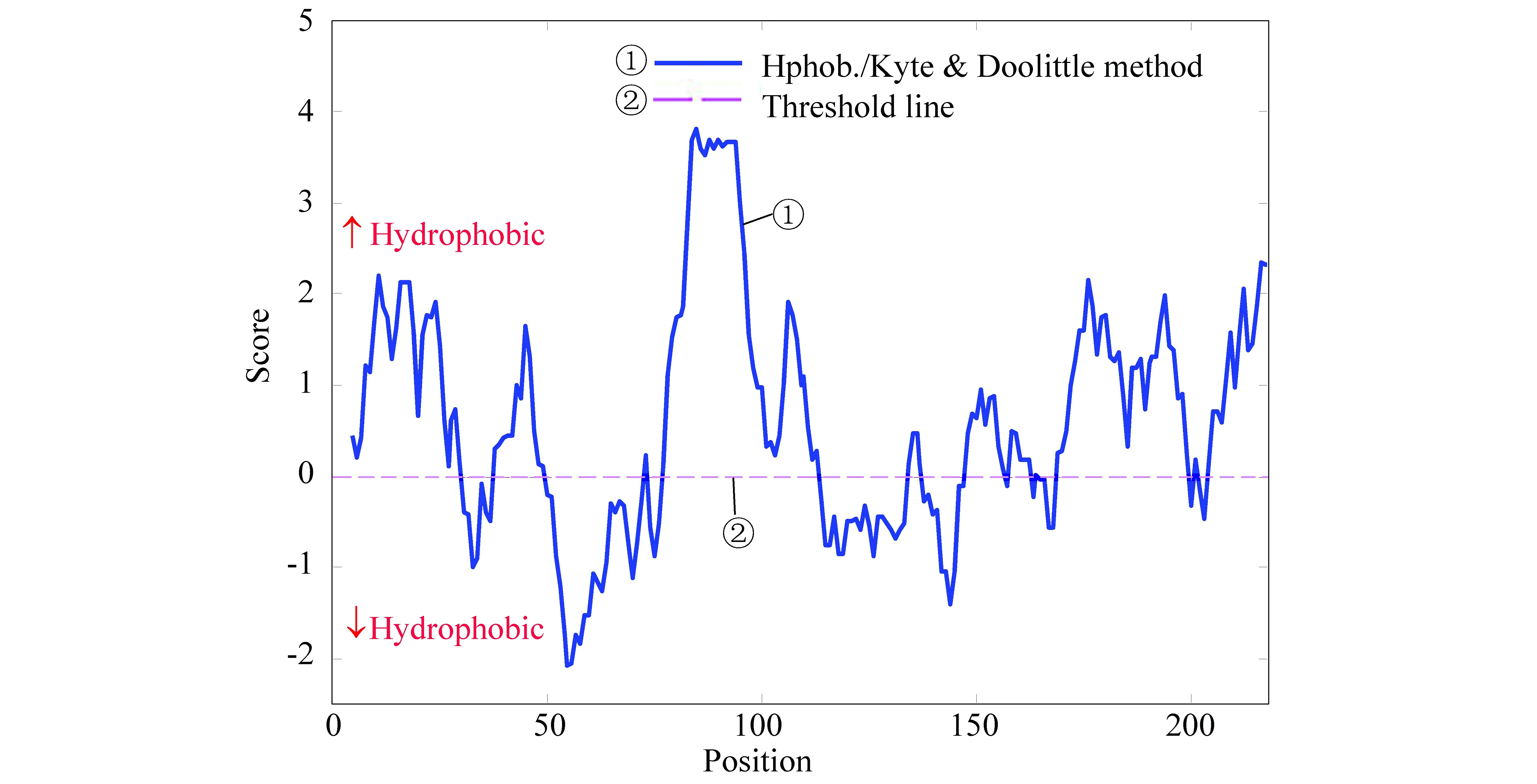
圖2 S蛋白疏水性預測結果Fig.2 Hydrophobicity prediction results for S protein
2.3 乙肝病毒S蛋白的二級結構
蛋白質一級結構中的氨基酸的組成和排列順序決定蛋白質的空間結構,空間結構決定蛋白質的生物學功能。二級結構對其功能的影響較大,蛋白質進行二級結構預測是確定抗原表位,即確定抗原抗體結合部位的一種輔助手段[35]。乙肝病毒的S蛋白序列的二級結構見圖3,其中藍色表示α螺旋,有72處氨基酸為α螺旋約占二級結構總數的31.86%;綠色表示β轉角,有17處氨基酸為β轉角約占二級結構總數的7.52%;紅色表示β折疊,有44處氨基酸為β折疊約占二級結構總數的19.47%;紫色表示無規則卷曲,有93處氨基酸為無規則卷曲約占二級結構總數的41.15%。由β轉角和無規則卷曲組成的區域占48.67%,表明在乙肝病毒 S蛋白的這些區域中,抗原表位容易產生[7]。(彩圖見電子版:http://swxxx.alljournals.cn/ch/index.aspx.2019年第2期)。
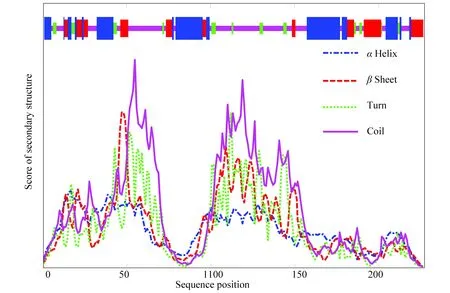
圖3 S蛋白二級結構Fig.3 Secondary structure of S protein
2.4 乙肝病毒S蛋白的信號肽、跨膜區及磷酸化位點分析
信號肽的本質是一段氨基酸序列,一般位于多肽鏈的末端,在蛋白質跨膜轉運過程中起作用。如圖4所示,S經常被用于預測信號肽的剪切位點[8],該預測結果中S分值最大為0.606,大于信號肽閾值0.5,S分值與閾值線的交點處的氨基酸位點為5,說明乙肝病毒S蛋白存在信號肽。且信號肽長度為5個氨基酸殘基,該蛋白的剪切部位在5-6氨基酸處。5氨基酸之后S分值較小這部分蛋白為成熟蛋白。
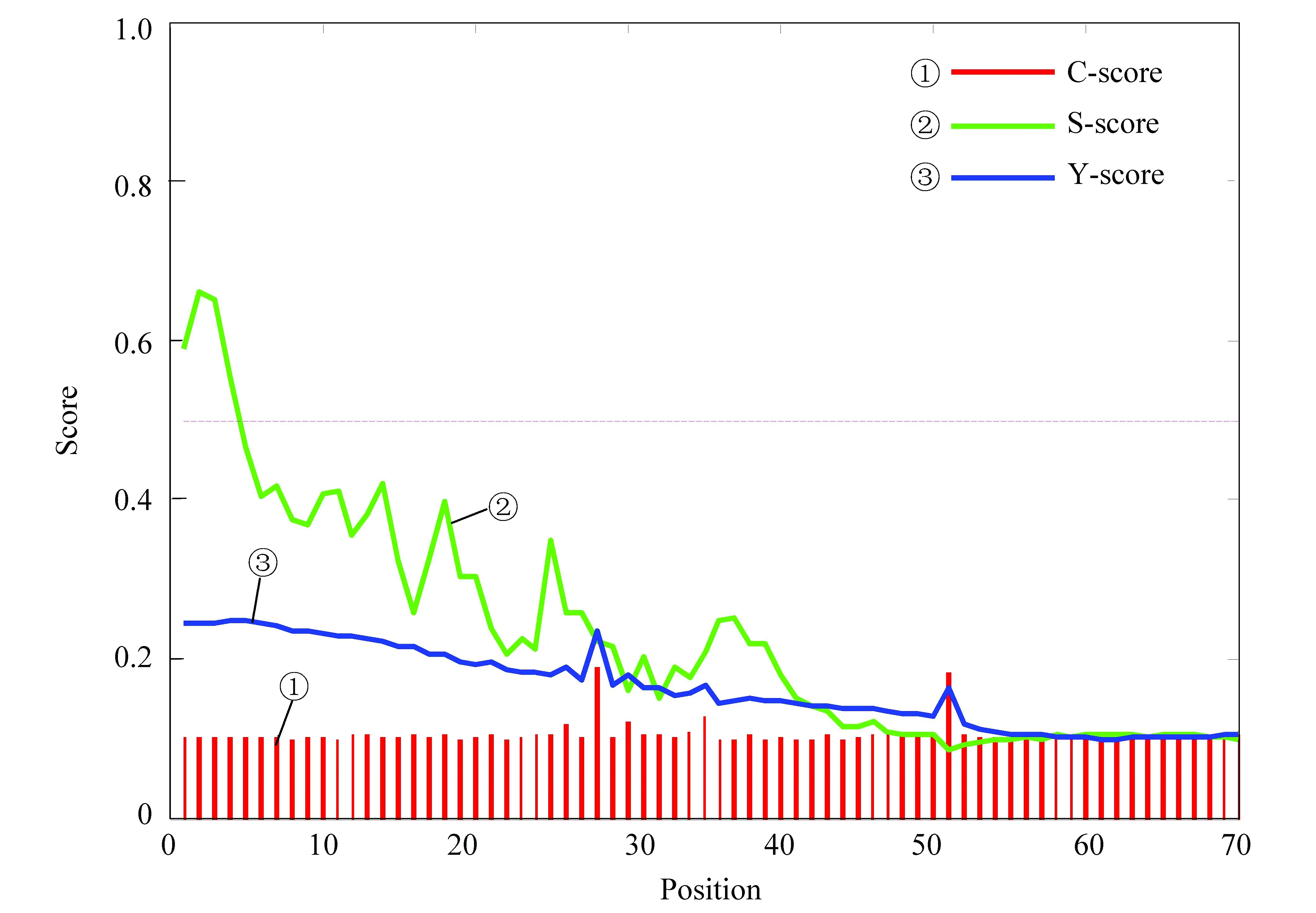
圖4 S蛋白信號肽預測結果Fig.4 Signal peptide prediction results for S protein
跨膜區是指蛋白質氨基酸序列中跨越細胞膜的區域。如圖5所示,藍色表示細胞膜內,綠色表示細胞膜外,紅色部分表示跨膜區。乙肝病毒S蛋白存在4個跨膜區位置分別是7-29,80-98,170-192,202-224。(彩圖見電子版:http://swxxx.alljournals.cn/ch/index.aspx.2019年第2期)。
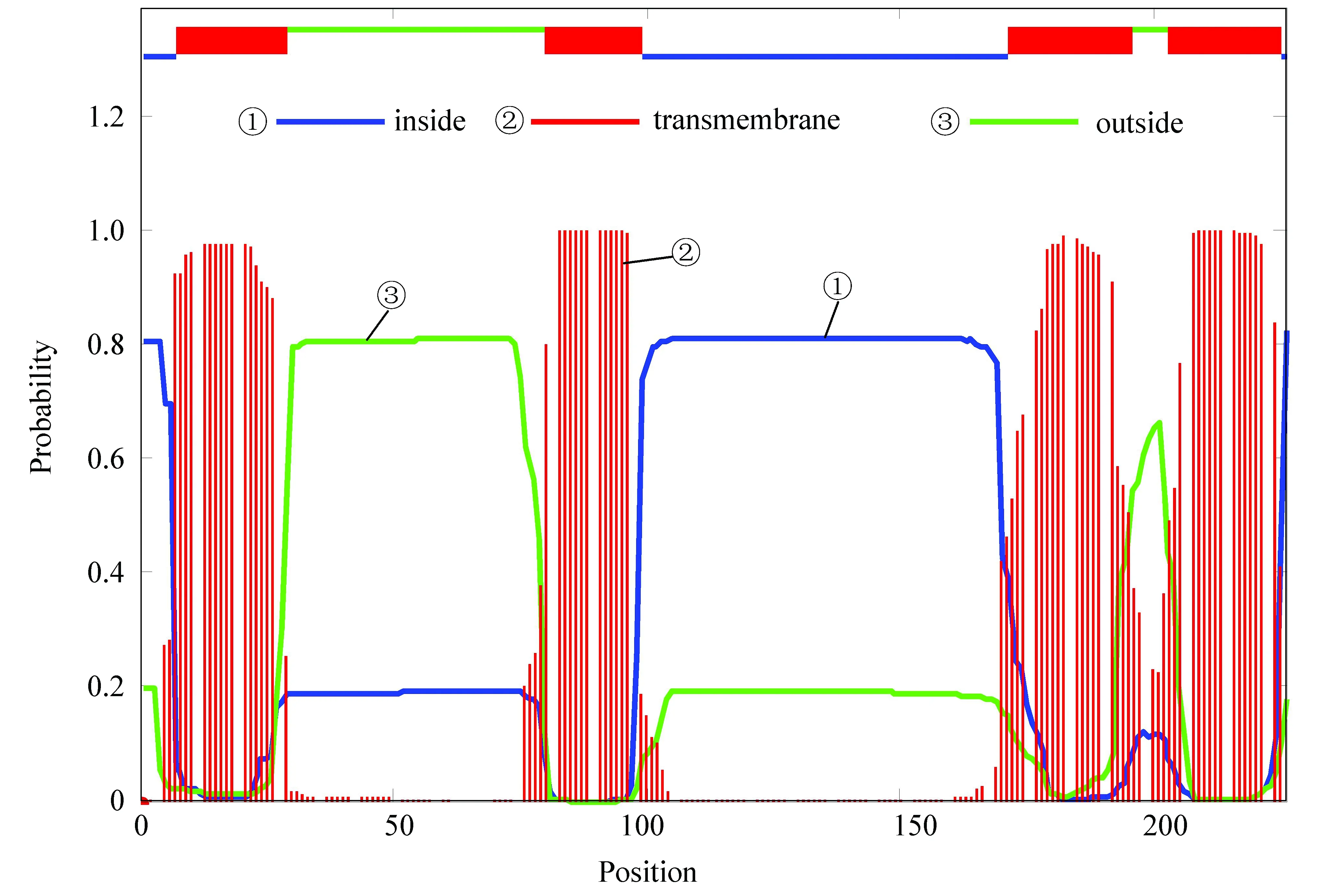
圖5 乙肝病毒S蛋白跨膜區預測結果Fig.5 Transmembrane region prediction results of S protein
如圖6所示,紅色表示絲氨酸,綠色表示蘇氨酸,藍色表示酪氨酸。乙肝病毒S蛋白存在7個蘇氨酸磷酸化位點,22個絲氨酸磷酸化位點,1個酪氨酸磷酸化位點,表明乙肝病毒S蛋白有30個潛在的磷酸化位點。(彩圖見電子版:http://swxxx.alljournals.cn/ch/index.aspx.2019年第2期)。
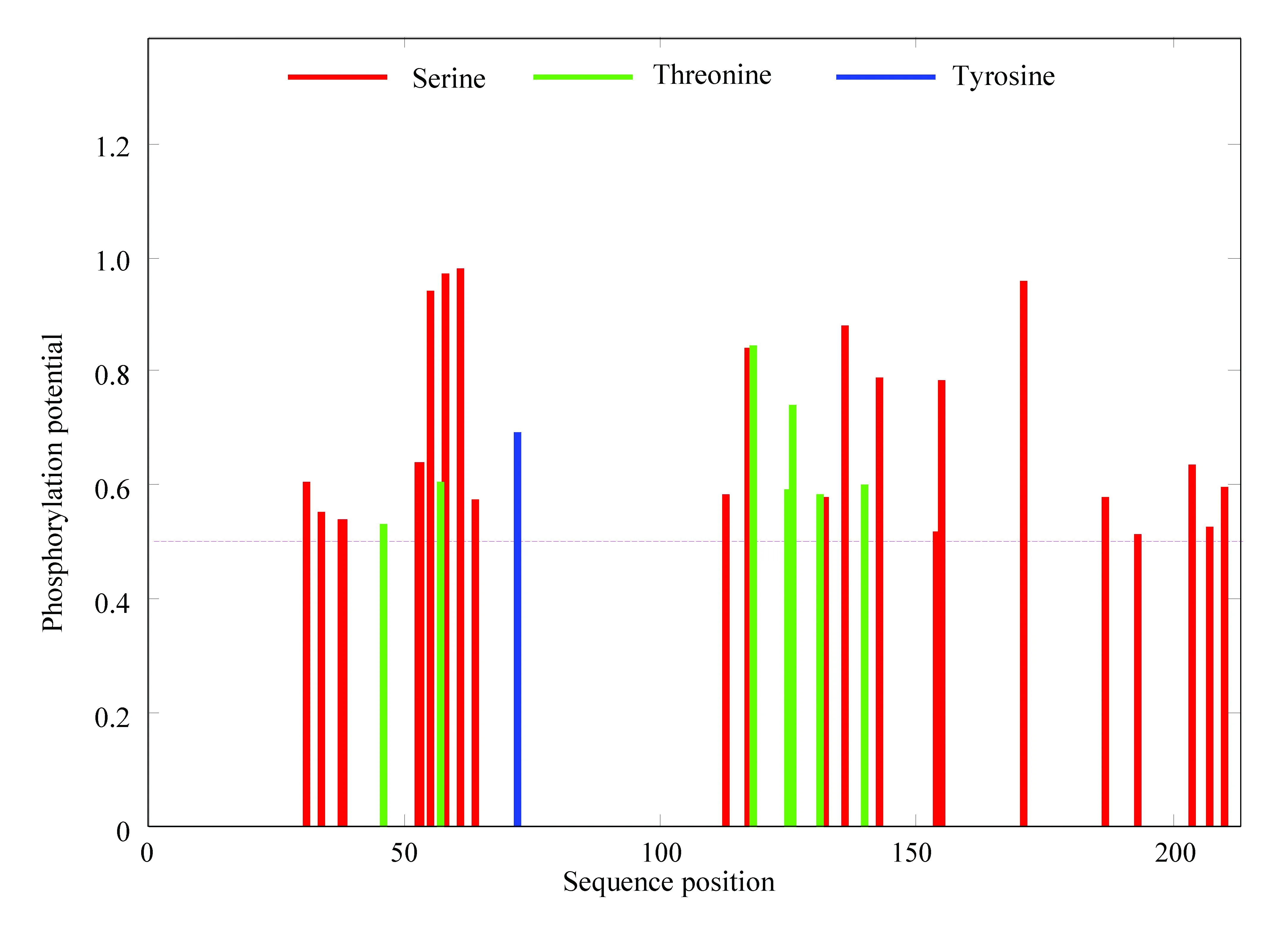
圖6 乙肝病毒S蛋白磷酸化位點Fig.6 Phosphorylation site of S protein in hepatitis B virus
2.5 乙肝病毒S蛋白最佳抗原表位位置預測
對乙肝病毒S蛋白進行可及性分析,可及性分析集中體現了乙肝病毒S蛋白抗原中氨基酸殘基的分布情況。可及性越大說明相應的氨基酸殘基更容易與抗體結合。如圖7所示,閾值線以上均為S蛋白抗原中氨基酸殘基可被溶劑分子接觸的部分,得分較高的氨基酸區域有10個分別為:0-3、24-34、48-62、66-69、96-99、109-118、122-132、139-143、165-168、198-204。
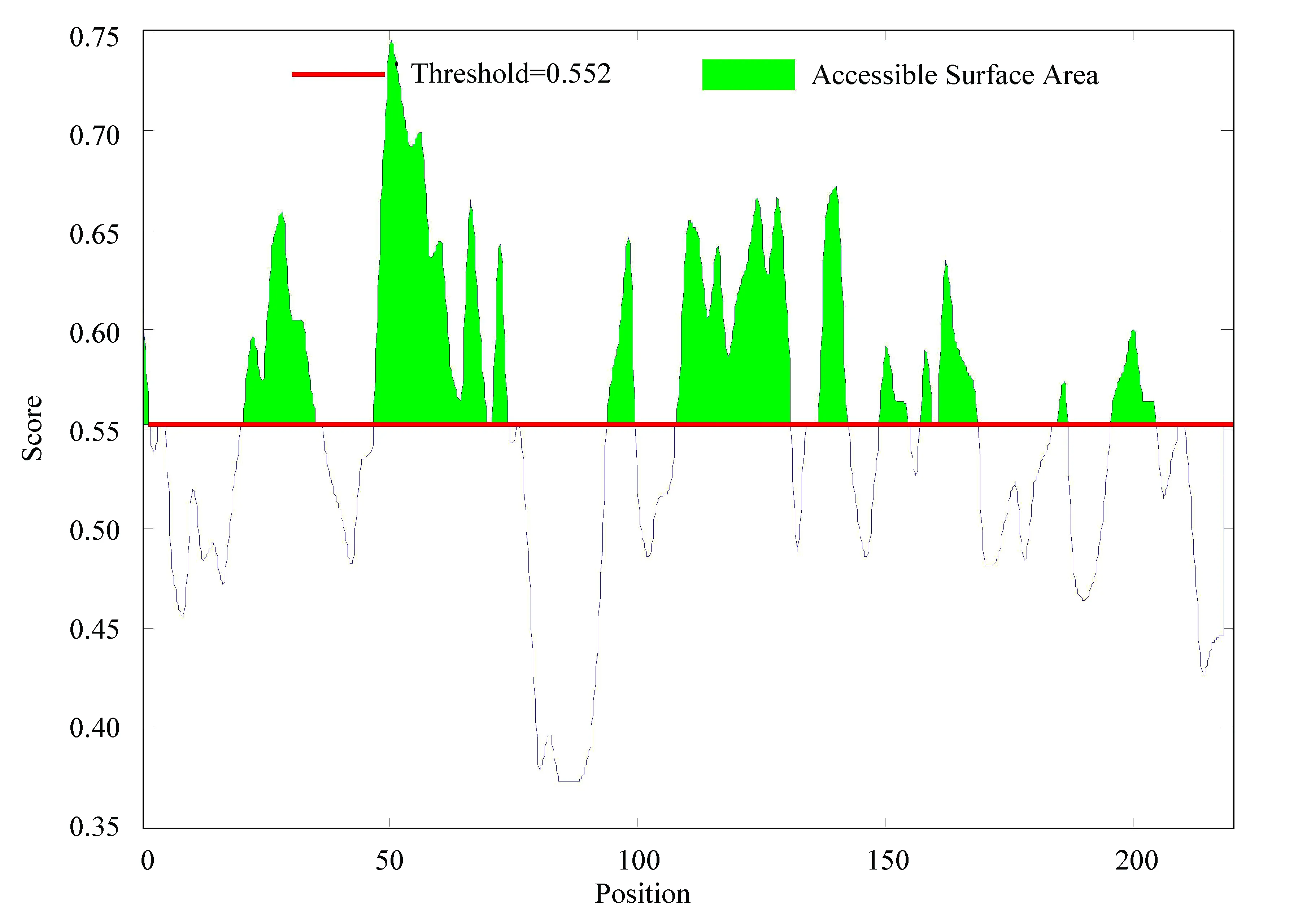
圖7 乙肝病毒S蛋白可及性Fig.7 Accessibility of S protein in hepatitis B virus
對乙肝病毒S蛋白進行線性表位分析,線性表位預測對于多種免疫研究是必不可少的,選擇有效的線性表位有利于順利進行抗體制備。如圖8所示,黃色部分即閾值線以上部分的線性表位對應的氨基酸位點較為適合作為抗原抗體結合部位,得分高的閾值線以上區域有7個分別為:0-8、25-36、46-69、100-155、165-168、182-188、200-206。(彩圖見電子版:http://swxxx.alljournals.cn/ch/index.aspx.2019年第2期)。
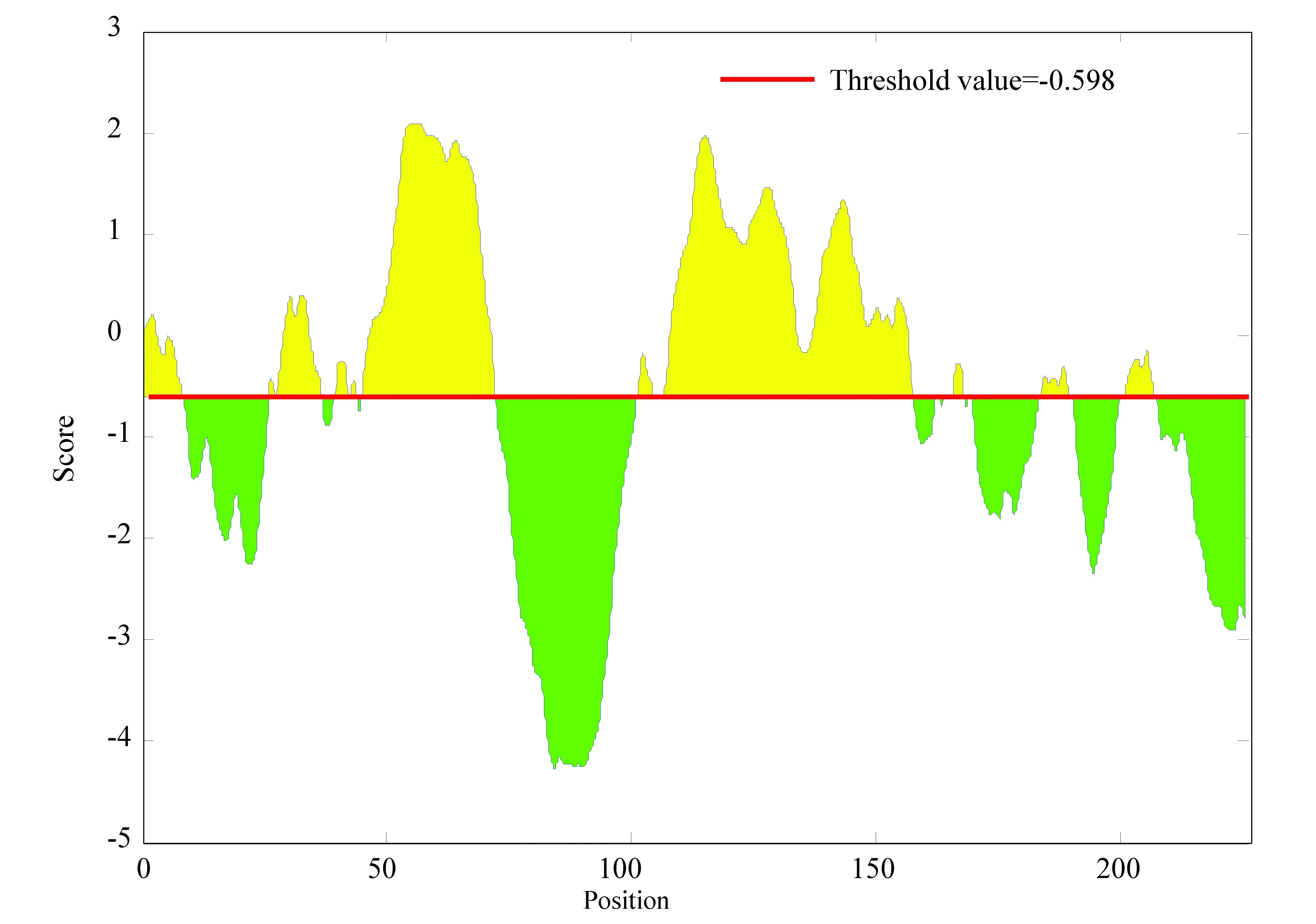
圖8 乙肝病毒S蛋白線性表位Fig.8 Linear epitope of S protein in hepatitis B virus
對乙肝病毒S蛋白進行β轉角結果預測,β轉角一般處于蛋白質表面位置,為凸出結構,經常發生扭曲結構較為松散,更容易與抗體結合,由于β轉角中的氨基酸殘基結構和生物學特性的特殊性,使得β轉角存在區域易形成抗原表位。本論文的抗原表位預測結果中閾值為1。如圖9所示,得分高的區域即閾值線以上的綠色區域有6個分別為:0-6、27-34、37-39、47-70、102-153、195-204。
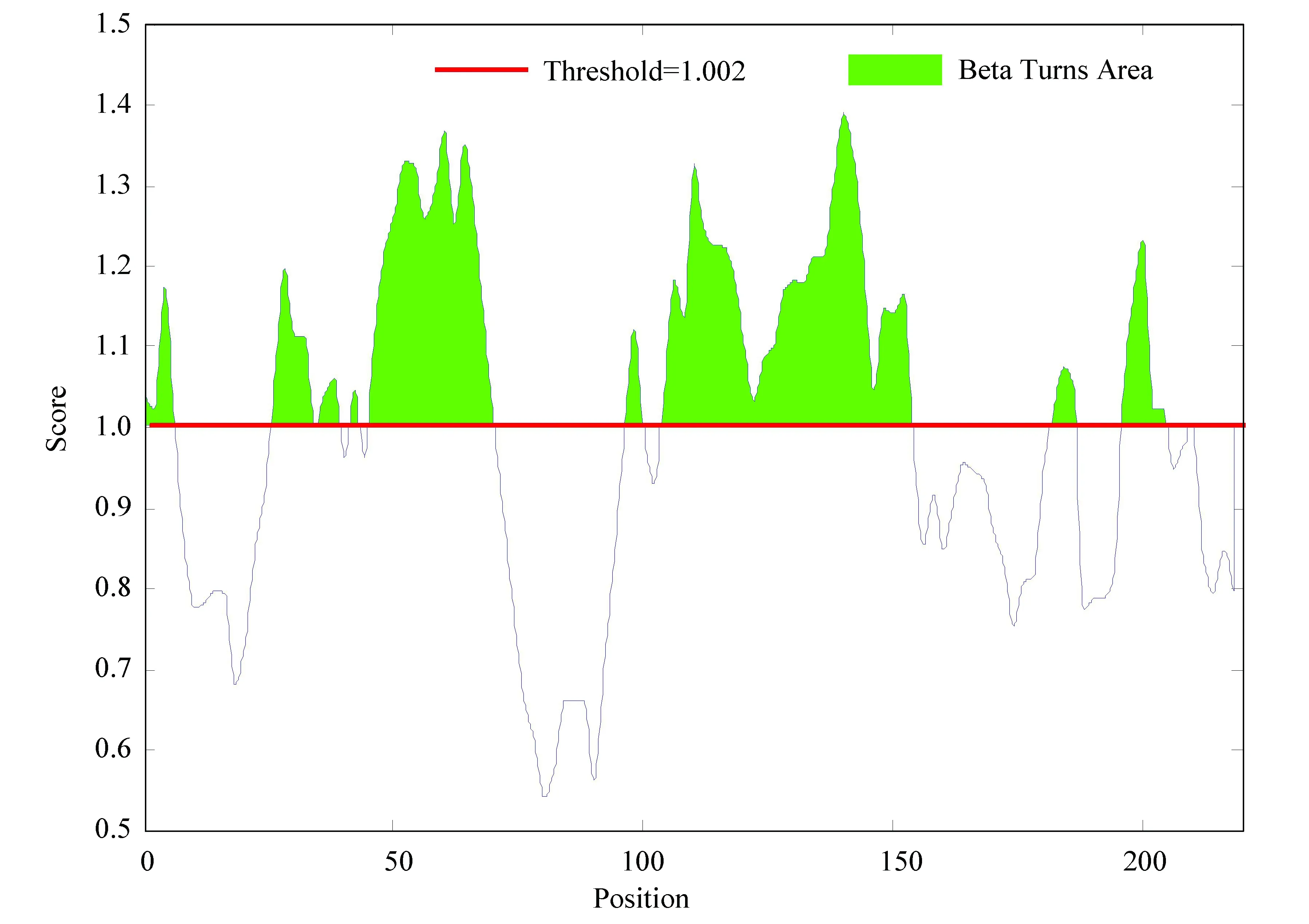
圖9 S蛋白β轉角預測結果Fig.9 β angle prediction results for S protein
對乙肝病毒S蛋白進行抗原性與分子量、化學組成、立體結構有關。抗原性越大,對應的氨基酸越穩定,越容易形成抗原位點。圖10為對乙肝病毒S蛋白進行抗原性結果預測的結果,得分較高的綠色閾值線以上區域有10個分別為:9-19、43-49、63-69、76-99、103-108、132-138、146-151、172-184、187-191、200-224。綜合分析乙肝病毒S蛋白的可及性、線性表位、β轉角、柔性、抗原性得到的潛在抗原表位有2個區域,分別為:48-49、66-69。
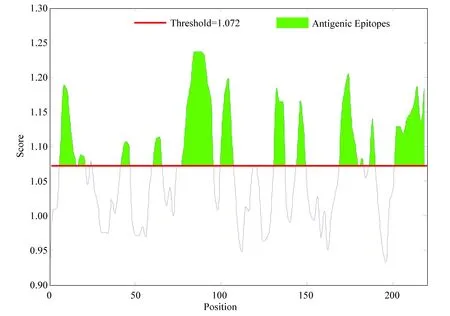
圖10 乙肝病毒S蛋白抗原性Fig.10 Antigenicity of S protein in hepatitis B virus
3 討 論
抗原表位是指位于抗原分子中的一種特殊的化學基團,對抗原特異性起決定性作用,抗原通過抗原表位完成免疫效應。表位疫苗是一種新型疫苗,在艾滋病等病毒上已經取得了初步研究進展。表位疫苗是指通過基因工程的手段,體外培養或人工合成微生物的表位,將得到的表位作為一種疫苗使用[9]。與傳統疫苗相比,表位疫苗更加穩定安全[10]。為了提高抗原表位預測的準確性,基于蛋白質的二級結構預測結果,在此基礎上進一步對乙肝病毒S蛋白的可及性、線性表位、β轉角、抗原性進行預測分析,選出利用不同性質分析結果中相同區域,作為最佳抗原表位位置,綜合分析得到的潛在抗原表位有2個區域,分別為:48-49、66-69。
乙型肝炎由乙型肝炎病毒引發,是一種全球性疾病,全世界乙型肝炎的慢性感染者約有4億人。因為乙型肝炎危害極大,流傳廣,因此各國科學家對乙肝病毒的防治方法給予了高度的重視[11]。乙肝病毒頑強的抵抗力和潛伏性是乙肝病毒難以治愈的主要原因。蛋白的結構預測是生物學研究的熱點之一[12]。自1965年乙肝病毒被發現就一直是一項難以攻克的難題,在現今的醫療水平上乙肝病毒幾乎可以說是一種可以被控制,但不能被徹底殺死的病毒。乙肝病毒S蛋白在人體內的不僅會對肝臟造成傷害,還會通過影響男性患者的精子存活率以及受精能力導致生育能力下降[13]。關于乙肝病毒S蛋白生物信息學分析結果,是基于蛋白質的結構特點、數據庫數據以及計算機分析得到的。這些預測結果對深入研究乙肝病毒、表位疫苗的研制具有指導意義,但還不能完全照搬,必須設計相應的實驗進行驗證,才能真正應用于乙肝病毒的防治過程。
李晉濤等人預測了一種抑制蛋白的表面特性和二級結構,采取多參數分析法進行預測,如對可塑性和親水性、免疫原性和理化性質等方面進行分析,發現該抑制蛋白存在多個潛在的抗原表位[14]。黃繼華采用多種方法檢測乙肝病毒S蛋白對人精子凋亡和受精能力的影響,結果證明乙肝病毒S蛋白在精子的凋亡過程中發揮作用,因此精子的線粒體的部分功能甚至于受精能力都會受到不同程度的影響[15]。丁悅等人的系列 研究表明乙肝病毒的主要構成成分乙肝病毒S蛋白能夠引起精子線粒體膜電位、精子活力、受精能力顯著下降,并導致精子大量死亡。同時,乙肝病毒S蛋白還可引起人精子產生氧化應激影響細胞膜的完整性,并進一步導致細胞凋亡而影響精子的功能[16]。本研究對乙肝病毒S蛋白運用生物信息學知識進行序列特征分析,成功預測到S蛋白的基本理化性質、結構和功能特征以及潛在的抗原表位所在位置,這些數據在一定程度上將作為對乙肝病毒以及乙肝病毒S蛋白深入研究和表位疫苗研制、免疫診斷的理論基礎。
4 結 論
乙肝病毒存在逆轉錄過程并且具有極強的潛伏性。應用生物信息學分析網站進行乙肝病毒S蛋白的序列特征分析,并在分析的基礎上研究乙肝病毒S蛋白的生物學特性。研究結果顯示:(1)乙肝病毒S蛋白是不穩定蛋白,很難與水分子形成氫鍵屬于疏水蛋白質,二級結構中α螺旋與無規則卷曲占大多數,同時乙肝病毒S蛋白存在信號肽、跨膜區以及潛在的磷酸化位點。(2)結合乙肝病毒S蛋白的序列可及性、線性表位、β轉角、柔性、抗原性的預測結果,可以找到最合適的氨基酸位點進行抗原抗體結合,形成抗原表位,綜合分析得到的潛在抗原表位有2個區域,分別為:48-49、66-69。研究結果可以作為表位疫苗的研制依據,有利于進一步研究乙肝病毒S蛋白的抗原性,對乙肝病毒S蛋白的研究進展有促進作用。

