螢光素酶報告基因細胞模型在篩選靶向調控RAC1的大黃酸衍生物中的應用
李釗全,粟正英,梁丹丹,王春苗,藍 富,李俊瑩,田 煒,黎丹戎,侯華新
(廣西醫科大學1. 藥學院,2. 生命科學研究院, 廣西 南寧 530021;3. 廣西國際壯醫醫院藥學部, 廣西 南寧 530201)
Ras相關的C3肉毒桿菌毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)是小分子G蛋白Rho GTPase家族Rac亞家族蛋白中的一員。大量文獻報道,RAC1在細胞增殖、遷移、侵襲、細胞黏附、細胞運動、軸突形成等調控細胞生命活動中發揮重要作用[1]。RAC1在多種類型的惡性腫瘤中異常表達,包括肺癌、肝癌、乳腺癌、結腸癌、子宮頸癌等。RAC1在腫瘤細胞高表達會干擾細胞之間的黏附作用,促進細胞侵襲、遷移及腫瘤新生血管形成等[2]。解娜等[3]利用RNAi技術沉默結腸癌細胞RAC1的表達后,發現細胞增殖速度明顯降低,并且能抑制裸鼠移植瘤的生長。抑制腫瘤細胞內RAC1的表達水平,有助抑制腫瘤的發生與發展。朱琳等[4]發現,RAC2能通過增強NADPH氧化酶活性,明顯提高活性氧水平,增強黑色素瘤細胞的輻射敏感性。鼻咽癌(nasopharyngeal carcinoma,NPC)高發于我國華南、西南地區,是常見惡性腫瘤之一。放療是NPC患者的主要治療手段,但常發生放射抗拒,導致腫瘤的復發與轉移。在課題組前期研究中,采用iTRAQ聯合質譜技術,發現蒽醌化合物GXHSWAQ-1可調控NPC CNE1細胞RAC1蛋白表達,從而增加細胞對射線的敏感性[5]。這些研究結果提示,RAC1可能是腫瘤發生、發展的關鍵蛋白,可作為潛在的治療靶點。
基于靶點設計與合成的候選化合物,其活性篩選的方法多種多樣。螢光素酶報告基因系統是利用化學發光原理創建的一類新型藥物篩選方法,具有高特異性、高靈敏度、不受激發光干擾、高通量篩選等優點,目前在靶點的篩選和驗證應用中越來越廣泛。本研究利用RAC1基因啟動子序列,構建了螢光素酶-慢病毒重組質粒,轉染至NPC CNE1細胞中,獲得能穩定表達RAC1螢光素酶的穩轉細胞株,通過螢光素酶活性和Western blot實驗,檢測課題組設計合成的系列化合物對RAC1靶向調控活性,為靶向RAC1的抗腫瘤化合物的篩選及修飾提供技術平臺和理論依據。
1 材料與方法
1.1 材料
1.1.1質粒及細胞株 pLVX-AcGFP-Puro,由上海伯易生物科技有限公司提供。人高分化鼻咽鱗癌CNE1細胞,由廣西腫瘤防治研究所提供。
1.1.2試劑與儀器 限制性內切酶EcoRI、BamHI、T4連接酶,購自日本TaKaRa公司;LipofectamineTM2000,購自美國Invitrogen公司;嘌呤霉素,購自北京索萊寶科技有限公司;螢光素酶報告基因檢測試劑盒(ONE-GloTMReagent),購自美國Promega公司;GAPDH多克隆抗體,購自廣州晶欣生物科技有限公司;RAC1單克隆抗體,購自美國Millipore公司。凝膠成像系統(美國Bio-Rad公司);EVOS FL Auto全自動細胞成像系統(美國Life Scientific公司);全波長酶標儀Microplate reader(美國Bio-Tek公司);Odessey雙色紅外成像系統(美國Licor公司)。
1.1.3受試化合物 化合物4a、H、B、C為課題組設計合成的系列大黃酸衍生物,其結構經過紅外、質譜以及核磁共振波譜確證,化合物純度經高效液相檢測,達到98%以上,各化合物結構見Fig 1。大黃酸(rhein),購自南京郎澤生物醫藥;RAC1激活劑PMA,購自美國Cayman Chemical公司;RAC1抑制劑NSC23766,購自美國Selleck Chemicals公司。
1.2 含RAC1啟動子螢光素酶報告基因細胞模型的構建與驗證含RAC1啟動子螢光素酶報告基因細胞模型的構建過程見Fig 2。
1.2.1含RAC1啟動子螢光素酶報告基因質粒構建 以人RAC1啟動子序列(GenBank:NM_006908)為靶序列,設計合成RAC1-promoter-Luc2重組序列,并加入EcoRI和BamHI酶切位點,經全基因合成后,獲得質粒為pUC57-RAC1-promoter-Luc2載體。用EcoRI和BamHI對該載體和pLVX-AcGFP-Puro載體分別進行酶切獲得目的片段,經PCR擴增和T4連接酶連接。重組構建pLVX-RAC1-Luc2-GFP-Puro質粒,并經酶切電泳和測序進行鑒定。
1.2.2慢病毒包裝 將1.5×106個293T細胞接種于10 cm培養皿中,培養至細胞約80%融合。用LipofectamineTM2000轉染試劑,將重組質粒和病毒包裝質粒混合。轉染48 h后,500×g離心10 min,收集病毒上清。
1.2.3穩轉細胞系的構建 取對數生長期的CNE1細胞,以5×103個/孔的密度接種到6孔板。加入4 μL濃度為5 g·L-1的聚凝胺和500 μL的病毒液。病毒感染24 h后,撤去病毒液,胰酶消化細胞,將細胞按1 ∶100的稀釋倍數接種至T75 cm2的培養瓶中。細胞貼壁24 h后,加入含2 ng·L-1嘌呤霉素的培養基,連續篩選2周,熒光顯微鏡觀察細胞感染效率。獲得穩定表達螢光素酶的CNE1細胞株,命名為CNE1-RAC1-Luc2。
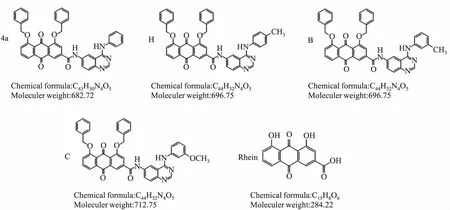
Fig 1 Chemical structure of different tested compounds
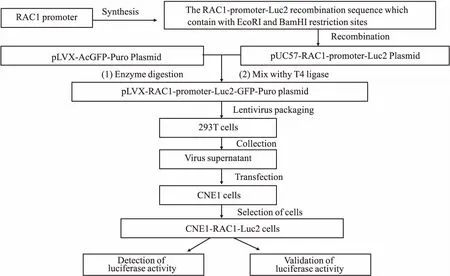
Fig 2 Workflow for construction of a cell model of luciferase reporter gene with RAC1 promoter
1.2.4螢光素酶報告基因活性檢測 取對數生長期的CNE1和CNE1-RAC1-Luc2細胞,以5×103個/孔的濃度接種于螢光素酶檢測專用的白色96孔板中,每孔細胞懸液100 μL,每組設置3個復孔。細胞貼壁24 h后,按照試劑盒(ONE-GloTMReagent)說明書,每孔加入100 μL含底物裂解液,于酶標儀上振蕩裂解3 min后,立即檢測各組細胞螢光素酶發光信號值。
1.2.5含RAC1螢光素酶報告基因檢測系統的驗證 取對數生長期的CNE1-RAC1-Luc2細胞,以5×103個/孔的數量接種于螢光素酶檢測專用的白色96孔板中,每孔細胞懸液體積100 μL,每組設置3個復孔。細胞貼壁24 h后,分別加入濃度為對細胞抑制率小于20%的PMA(1.5 μmol·L-1)、NSC23766(30 μmol·L-1),孵育24 h后,按“1.2.4”的方法檢測各組細胞螢光素酶發光信號值。
1.2.6Western blot檢測RAC1激活劑與抑制劑對RAC1蛋白表達的調控 以無細胞毒濃度的RAC1激活劑與抑制劑處理細胞,以等量的完全培養液為空白對照。作用24 h后,加入RIPA/PMSF細胞裂解液,收集上清即為蛋白提取液。取100 μg蛋白樣品,12% SDS聚丙烯酰胺凝膠電泳,濕法將蛋白轉至NC膜。NC膜置于5%脫脂牛奶的TBST中孵育2 h。加入一抗RAC1(1 ∶500)和GAPDH(1 ∶1 000)孵育。加入遠紅外熒光二抗(1 ∶10 000)室溫孵育,使用Odyssey紅外掃膜儀掃描蛋白條帶,通過灰度值統計軟件測定各組樣品灰度值。
1.3 受試化合物活性檢測選取無細胞毒濃度的大黃酸衍生物4a(20 μmol·L-1)、H(2 μmol·L-1)、B(5 μmol·L-1)、C (5 μmol·L-1)、大黃酸(20 μmol·L-1)為實驗組,同時設置不加藥的空白對照組。各化合物作用CNE1-RAC1-Luc2細胞24 h后,按“1.2.4”的方法檢測各組細胞螢光素酶發光信號值。同時,收集經上述各化合物處理24 h后的各組細胞,裂解后,采用Western blot檢測各化合物對RAC1蛋白表達的影響。

2 結果
2.1 pLVX-RAC1-Luc2-GFP-Puro螢光素酶報告基因重組質粒鑒定含有RAC1基因啟動子片段的重組質粒經EcoRI和BamHI雙酶切后,在Fig 3條帶1中的4 000 bp和9 000 bp附近可見到兩條明亮的條帶,與插入的RAC1-Luc2(3 700 bp左右)目的片段和pLVX-AcGFP-Puro(8 700 bp左右)載體片段長度一致,表明目的序列成功插入且序列大小正確,經過測序發現目的序列與預期設計的寡核苷酸序列完全一致,螢光素酶重組報告質粒成功構建。
2.2 CNE1-RAC1-Luc2穩轉細胞株篩選經濃度為2 ng·L-1的嘌呤霉素連續篩選2周后,獲得穩定表達螢光素酶的CNE1-RAC1-Luc2細胞,細胞感染綠色熒光(GFP)效率達90%以上,見Fig 4。
2.3 CNE1-RAC1-Luc2穩轉細胞螢光素酶活性檢測Fig 5的螢光素酶活性實驗結果顯示,以不感染病毒的CNE1細胞為空白對照,感染了慢病毒的CNE1-RAC1-Luc2細胞螢光素酶活性明顯高于空白對照(P<0.05)。結果表明,RAC1基因啟動子序列已經準確插入到螢光素酶基因上游,并在CNE1細胞內正常啟動螢光素酶基因的表達。
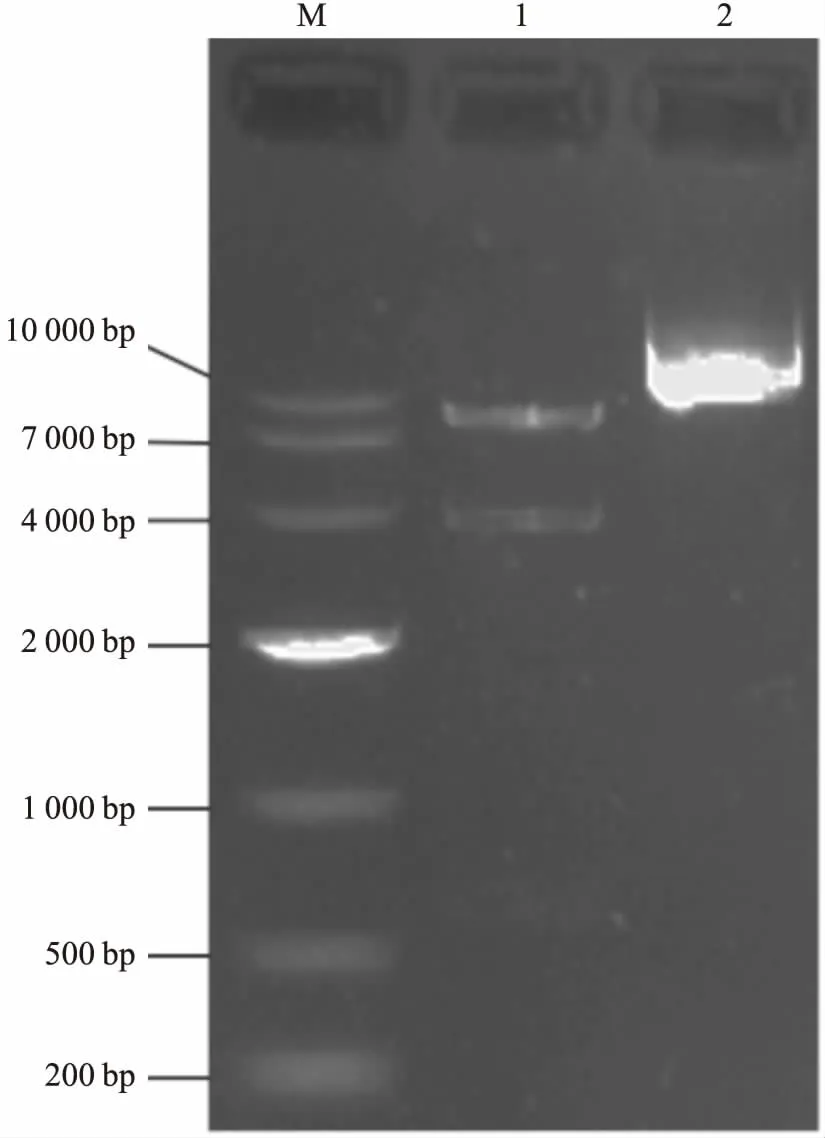
Fig 3 Electrophoresis of recombinant plasmid of pLVX-PRAC1-Luc2-GFP-Puro digested with double restriction endonuclease
M:DNA marker; 1:Digested with EcoRI/BamHI; 2:Plasmid DNA.
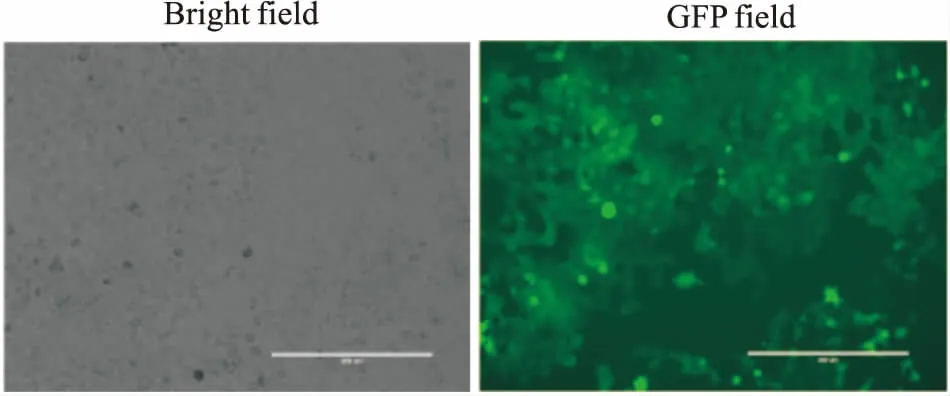
Fig 4 Expression efficiency of green fluorescence protein in CNE1-RAC1-Luc2 cells(×100)
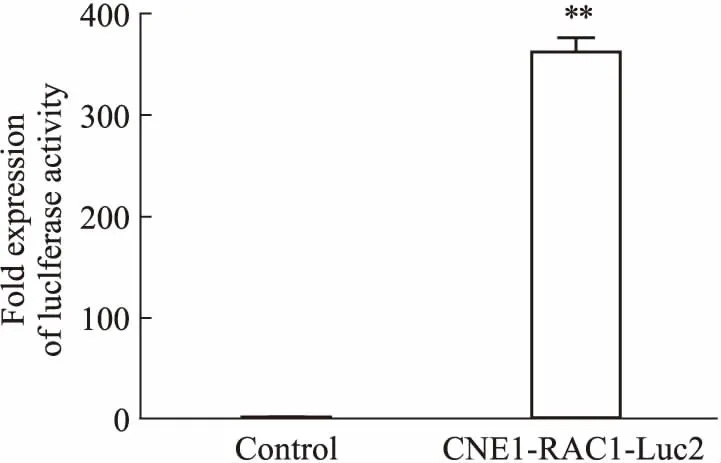
Fig 5 Expression activity of luciferase in CNE1-RAC1-Luc2
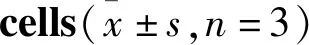
**P<0.01vscontrol
2.4 RAC1螢光素酶報告基因系統篩選活性驗證采用無細胞毒濃度的RAC1激活劑PMA和抑制劑NSC23766作用CNE1-RAC1-Luc2細胞48 h后,檢測對細胞螢光素酶RAC1活性的影響。如Fig 6A所示,與空白對照相比,RAC1激活劑PMA可提高螢光素酶活性(P<0.05),而RAC1抑制劑NSC23766抑制細胞的螢光素酶活性(P<0.05)。同時,采用Western blot檢測NSC23766和PMA對RAC1蛋白表達的影響,如Fig 6B所示,與空白對照相比,NSC23766能有效下調CNE1細胞RAC1蛋白表達水平(P<0.05),而PMA則相反(P<0.05)。
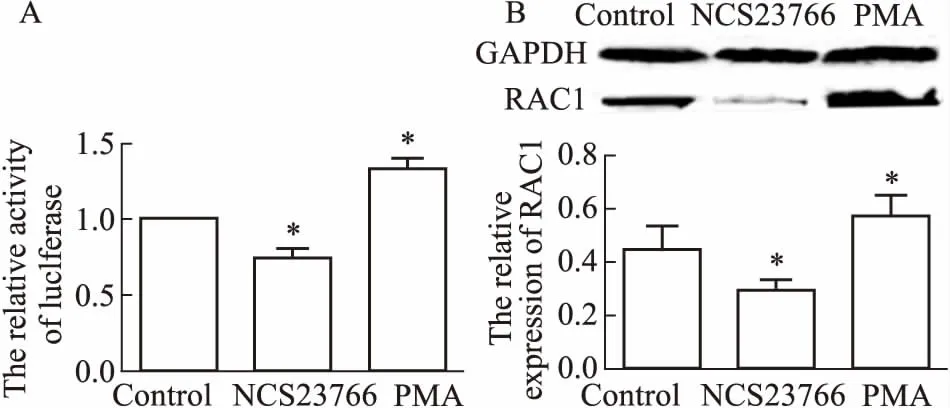
Fig 6 Validation of screening activity of RAC1 by
A:Effects of NSC23766 and PMA on luciferase activity of CNE1-RAC1-Luc2 cells; B:Expression of RAC1 after treatment with NSC23766 and PMA by Western blot.*P<0.05vscontrol.
2.5 系列化合物對RAC1的靶向調控作用大黃酸及其衍生物B、C、4a、H以無細胞毒濃度作用CNE1-RAC1-Luc2細胞48 h后,檢測各組細胞螢光素酶活性的變化。與空白對照相比,大黃酸及衍生物C能夠增加螢光素酶活性(P<0.05);而衍生物4a、H可抑制細胞的螢光素酶活性(P<0.05),衍生物B基本上不影響螢光素酶活性的變化(Fig 7A)。Fig 7B的Western blot結果顯示,相比于空白對照,大黃酸及其衍生物C上調RAC1的表達(P<0.05),衍生物4a、H下調RAC1蛋白的表達(P<0.05)。
3 討論
大多數藥物通過與體內分子“靶標”的相互作用而產生療效,靶點的發現已成為當今創新藥物研究的焦點。目前,基于RAC1為靶點的抗腫瘤藥物篩選、設計合成的研究已有一些報道。Xie等[6]發現,一個新型天然大環內酯類化合物F086能通過下調RAC1,抑制食管鱗狀細胞癌細胞骨架的裝配,促進細胞凋亡。Montalvoortiz等[7]還發現了一種新的Rac抑制劑EHop-016,比已有的Rac抑制劑效果更好,并在白血病治療中顯示出獨特的優勢。因此,以RAC1及其下游信號通路為靶點的抗腫瘤藥物篩選細胞模型的構建,對促進靶向RAC1的抗腫瘤藥物的設計與研發有積極意義。
迄今已報道的螢光素酶報告基因藥物篩選體系主要有:(1)受體激動劑/抑制劑的篩選體系[8];(2)信號通路的篩選體系[9];(3)靶基因3’非編碼區(3′UTR)的篩選體系[10];(4)靶基因啟動子的篩選體系[11]。前3種方法由于存在靶向性低、假陽性或假陰性等結果的弊端,未能在藥物的篩選中有效使用。基因啟動子含有RNA聚合酶特異性結合和轉錄起始所需的保守序列,能對基因的轉錄水平進行調控[12-13]。因此,基于靶基因啟動子的靶向藥物篩選體系與上述3種體系相比具有一定的優越性,可以特異性篩選引起目的基因轉錄活性改變的活性小分子。本研究根據RAC1啟動子序列設計合成pLVX-RAC1-Luc2-GFP-Puro螢光素酶-慢病毒重組質粒,轉染至CNE1細胞中,成功獲得穩定表達螢光素酶的CNE1-RAC1-Luc2細胞,為篩選靶向調控RAC1基因啟動子活性和RAC1蛋白表達活性的候選化合物提供了一個實用的細胞模型。
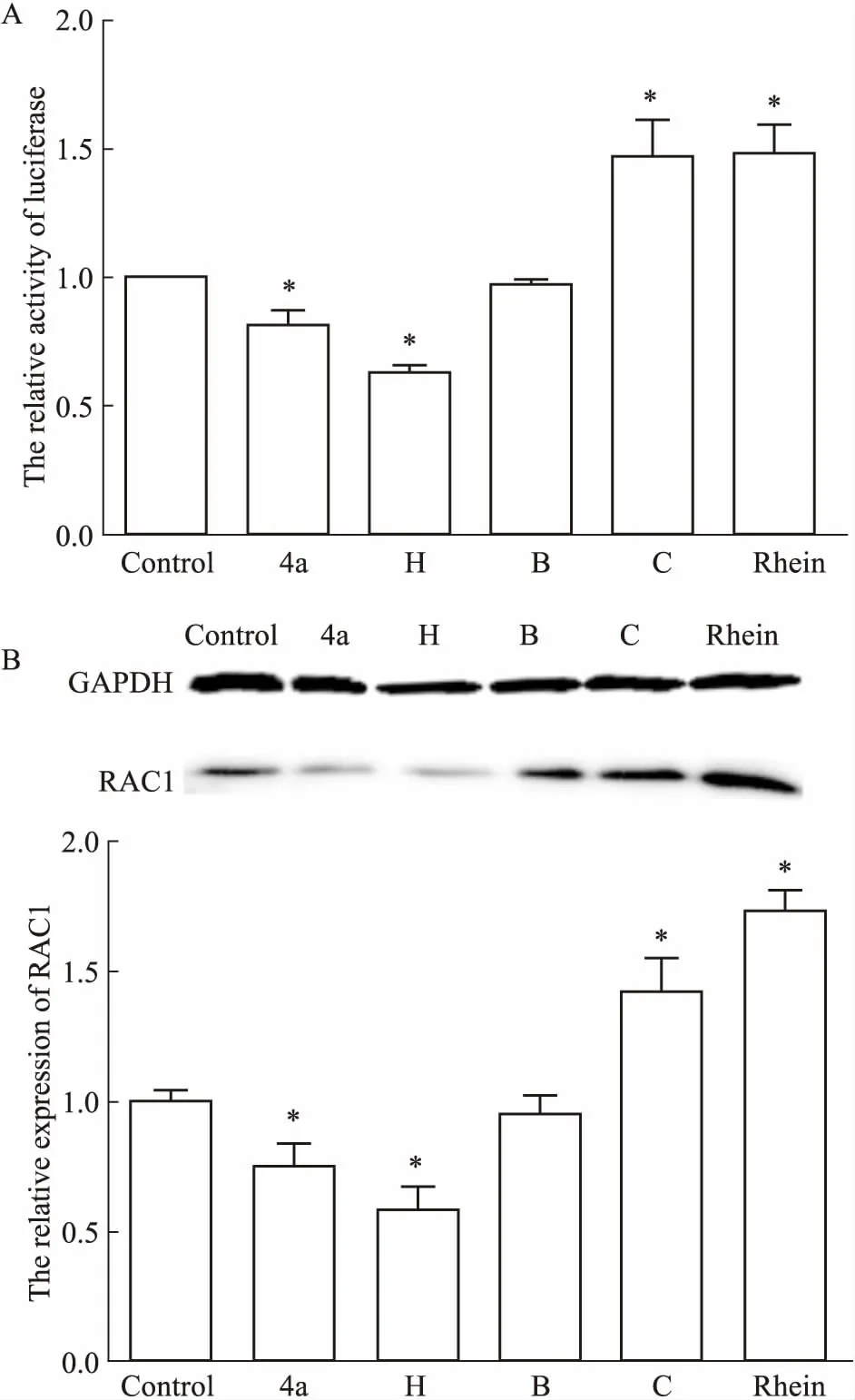
Fig 7 Targeted regulation of RAC1 by a series
A:Effects of a series of rhein derivative compounds on luciferase activity; B:Expression of RAC1 after treatment with a series of rhein derivative compounds by Western blot.*P<0.05vscontrol.
課題組前期研究發現,含蒽醌母核結構的大黃素、大黃酸及多種蒽醌類化合物,可以靶向調控RAC1活性,增加NPC細胞對射線的敏感性,抑制卵巢癌細胞的轉移與侵襲[14-15]。本研究所使用的受試物為在大黃酸蒽醌母核結構上引入喹唑啉環的系列化合物,期待能發現更多活性高、毒性低,針對RAC1靶向性良好的化合物。采用含RAC1啟動子的螢光素酶報告基因檢測系統發現:受試化合物對RAC1螢光素酶的活性的激活或抑制與Western blot結果一致。研究結果表明,所構建的含RAC1啟動子的螢光素酶報告基因的細胞模型可用于靶向調控RAC1啟動子化合物的篩選,具有快速、靈敏、操作簡便的優點,可指導針對RAC1為靶點的化合物設計、修飾與篩選,提高藥物的研發效率。