靶向干擾Kv1.3通道基因表達對大鼠調節性T細胞的影響
李夢佳,徐 琦,程路峰
(新疆醫科大學1. 藥學院藥理學教研室、2. 基礎醫學院免疫學教研室,新疆 烏魯木齊 830011)
心肌纖維化是慢性心衰發展過程中的最重要的病理表現,但發病機制尚未完全揭示,主要認為腎素-血管緊張素系統(renin-angiotensin system,RAS)過度激活是導致心肌纖維化的因素。抗心肌纖維化的一線藥物血管緊張素轉化酶抑制劑(angiotensin coverting enzyme inhibitor,ACEI)或血管緊張素Ⅱ一型受體拮抗劑(angiotensinⅡ type1 receptor antagonist,AT1)長期應用出現“醛固酮逃逸”現象[1]。醛固酮將會促進轉化生長因子β(transforming growth factor β,TGF-β)等的表達,進而刺激多種細胞向纖維母細胞轉化,增加基質蛋白等的合成而促纖維化[2-3]。因此,闡明心肌纖維化發生、發展的機制,及預防和治療是現代醫學研究領域的熱點。
有報道稱[4],多種免疫細胞參與炎癥反應,而調節性T細胞(regulatory T lymphocytes,Tregs)構建了T細胞的抗炎體系。自然性Tregs來源于胸腺,誘導型則依賴局部炎癥環境產生。CD4+T淋巴細胞活化后,TGF-β的促進下向Tregs細胞分化,且通過進一步自分泌TGF-β等因子而被活化增殖(正反饋)。Tregs主要分泌TGF-β和IL-10,有報道[5],靜脈回輸Tregs主要通過IL-10介導而逆轉心肌纖維化。但是,TGF-β又是重要的致纖維化因子,故Tregs細胞在心肌纖維化進程中扮演怎樣的角色還需進一步證實。
Kv1.3通道作為調控T淋巴細胞增殖的靶點意義重大,其通過維持細胞靜息膜電位,使T細胞處于能被活化的狀態[8],T細胞活化后,促進第二信使Ca2+內流,增加細胞因子TGF-β的轉錄。通過阻斷Kv1.3通道能抑制促炎細胞因子的產生和體外增殖[6-7]。前期研究發現[8],Tregs可通過分泌較多的TGF-β,促進心肌成纖維細胞(cardiac fibroblasts,CFs)的增殖,而依普利酮則可能通過阻斷Kv1.3通道,抑制Tregs細胞活化增殖,減少TGF-β的分泌,而未引起CFs的增殖。基于此,本研究通過沉默Kv1.3通道基因并轉染Tregs細胞,擬進一步明確Kv1.3通道在Tregs細胞活化增殖致心肌纖維化的靶點地位,明確依普利酮是否通過直接阻斷Kv1.3通道功能,抑制Tregs細胞活化增殖而抑制纖維化進程。
1 材料與方法
1.1 實驗動物SPF級SD大鼠,♂,體質量(200±20)g,由新疆維吾爾自治區實驗動物研究中心提供,實驗動物生產許可證號: SYXK(新)2016-0003。
1.2 藥物與試劑Biotin小鼠抗兔CD4(BD554836)、PE小鼠抗大鼠CD25(BD554866),購自美國BD公司;Multisort microbeads Kit、Anti-PE Microbeads,購自德國Miltenyi Biotic公司;依普利酮、大鼠淋巴分離液(LTS 1083)、胎牛血清,購自Sigma公司;RPMI 1640培養基,購自HyClone公司;SYBRTMSelect Master Mix,購自Life Technologies;抗大鼠CD3單抗、抗大鼠CD28單抗,購自Thermofisher eBioscience公司;重組大鼠IL-2、TGF-β1,購自Peprotech公司;IL-10、TGF-β試劑盒,購自武漢華美生物技術有限公司;靶向抑制Kv1.3的慢病毒載體及陰性對照病毒載體,由上海吉凱基因公司構建及包裝。
1.3 儀器Midi型磁力架分選器、25LS型分選柱(德國Miltenyi);KDC 40低速離心機(中科中佳科學儀器有限公司);HF 240二氧化碳培養箱(Heal Force);CT15RE型低溫離心機(日本Hitachi);Port-a-path?工作站、負壓控制器、NPC?-1芯片(德國Nanion,Part-a-Patch?NPC?-1);EPC-10放大器(德國HEKA)。
1.4 方法
1.4.1大鼠Tregs細胞的分選及活化 摘取正常大鼠脾臟,通過加入大鼠淋巴分離液,密度梯度離心得到單個核細胞;免疫磁珠雙陽性分選兩步法獲得Tregs細胞(純度≥95%)。將分離好的Tregs細胞接種于前1 d由CD3抗體包被過夜,并于次日吸出CD3抗體,用等體積的PBS體積洗板1次,含CD28抗體(2 mg·L-1)的24孔板中,在37 ℃、5% CO2飽和濕度下,用含IL-2(10 g·L-1)、TGF-β1(5 μg·L-1)、雙抗100 kU·L-1及RPMI 1640培養基500 μL培養活化該細胞,細胞在刺激24 h后體積略微增大,進入活化狀態,刺激48 h可進行病毒感染。
1.4.2RNAi-Kv1.3通道基因轉染大鼠Tregs細胞 收集活化的Tregs細胞,以無血清培養基饑餓Tregs細胞12 h,以備轉染。按每孔1×105個細胞的濃度接種于24孔板中,按MOI=100,將LV-KCNA3(64803-1)、LV-KCNA3(64804-1)、LV-KCNA3(64805-1)3個不同的干擾靶點及陰性對照病毒CON077(No target Kv1.3)(Tab 1),分別加入活化的Tregs細胞,同時加入感染增強液聚凝胺至終濃度6 μg ·L-1,最終感染體積為500 μL,十字交叉法晃動24孔板以保證鋪板均勻;于1 000 r·min-1離心感染60 min。離心結束后,將平板放入37 ℃、5% CO2培養箱中培養12 h,于次日加入500 μL含IL-2 (10 μg·L-1)、TGF-β1(5 μg·L-1)、雙抗100 kU·L-1及RPMI 1640培養基繼續培養。倒置熒光顯微鏡觀察細胞轉染后熒光。

Tab 1 Targeted interference sequences
1.4.3實時定量PCR檢測Kv1.3通道基因的表達 將LV-KCNA3(64803-1)、LV-KCNA3(64804-1)、LV-KCNA3(64805-1)三個不同的干擾靶點及陰性對照病毒CON077(No target Kv1.3),感染Tregs細胞成功后,TRIzol法提取總RNA,逆轉錄cDNA,于冰上將2.0 μL cDNA加入擴增體系(SYBR 5 μL、Prim 0.7 μL、H2O 1.6 μL),共10 μL。反應條件為:61 ℃、5 min,42 ℃、1 h,70 ℃、5 min,4 ℃循環。PCR反應以GAPDH作為內參照(管家基因),每個樣本均以GAPDH的表達來標準化,所有孔均設3個復孔,實驗重復3次,每次實驗設標準曲線。以相對定量2-△△CT表示目的基因的表達相對于對照組的變化倍數,△△CT=實驗組(目的基因的拷貝數-管家基因的拷貝數)/對照組(目的基因的拷貝數-管家基因的拷貝數)。同時比較干擾載體組及陰性對照病毒組基因的表達量,計算干擾效果。引物序列見Tab 2。

Tab 2 Primer sequences
1.4.4全細胞膜片鉗檢測正常組Tregs、RNAi-Kv1.3 Tregs細胞電流變化 使用EPC10放大器,負壓控制器通過數據轉換器與計算機連接,刺激信號及電流、電壓輸人信號的采集均由軟件控制。NPC?-1芯片內層注入5 μL電極內液,NPC?-1芯片電極入水阻抗為8~12 MΩ。膜電位鉗制在-80 mV,Tregs細胞Kv1.3鉀通道予以-80~+40 mV斜率刺激,刺激時長為500 ms。記錄得到Kv1.3鉀通道的電流-電壓(I-V)曲線。
1.4.5細胞因子水平檢測 將細胞分為Tregs組、Tregs+EPL組、RNAi-Tregs組、RNAi-Tregs+EPL組,收集各組細胞培養液,外液通過1 300 r·min-1離心10 min,收集上清液,分裝置于200 μL EP管(避免反復凍融);內液細胞分泌因子通過PBS清洗,放在-20 ℃冰箱10 min,37 ℃水浴鍋中5 min,如此反復凍融3~5次,離心收集上清液。按照試劑盒說明書檢測各組細胞內外液分泌的IL-10、TGF-β水平。

2 結果
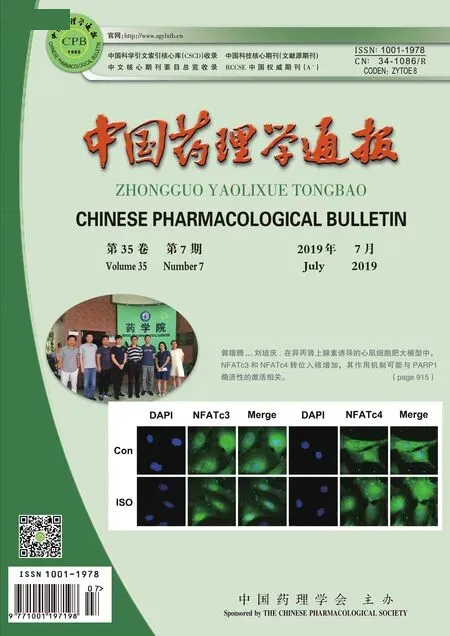
2.1 Treg細胞的分選免疫磁珠分選的Tregs細胞經過CD3/CD28刺激活化,細胞體積變大,邊緣透亮(Fig 1)。
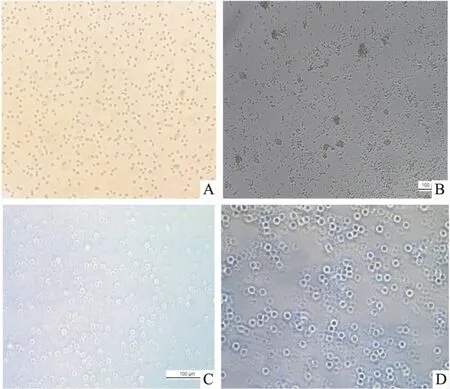
Fig 1 Tregs and CFs cell separation
A: Immunomagnetic beads separation Tregs cell (×200); B: Stimulate the activation of Tregs by CD3/CD28 (×100); C: Stimulate the activation of Tregs by CD3/CD28 (×200); D: Lentivirus infects Tregs cell(×200).
2.2 RNAi-Kv1.3轉染大鼠Tregs細胞Tregs細胞在MOI=100、感染增強液聚凝胺6 μg L-1、離心轉染條件下,進行GFP慢病毒轉染后,在熒光倒置顯微鏡下可觀察到GFP綠色熒光蛋白(Fig 2)。
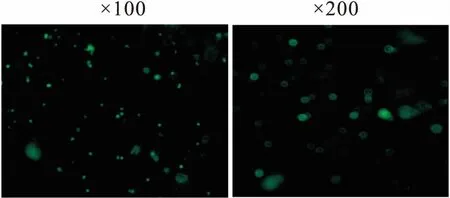
Fig 2 Tregs cells infected by lentivirus
2.3 RNAi Kv1.3轉染Treg細胞對Kv1.3通道mRNA表達的影響LV-Kcna3 64803-1(Kv1.3-64803)、LV-Kcna3 64804-1(Kv1.3-64804)、LV-Kcna3 64805-1(Kv1.3-64805)三個不同的干擾靶點及陰性對照病毒CON077(No target Kv1.3)感染Tregs細胞成功后,Kv1.3-64803轉染Tregs細胞Kv1.3 mRNA表達較其他各組表達明顯較低(P<0.01),其中干擾靶點Kv1.3-64803對Tregs細胞mRNA抑制率最大為78%(Fig 3)。
Fig 3 Relative expression and inhibition rate of Kv1.3 channel mRNA in each
A:Control;B:NO-target kv1.3;C:KV1.3-64803;D:KV1.3-64804;E:KV1.3-64805.*P<0.05,**P<0.01vscontrol;##P<0.01vsKv1.3-64804orKv1.3-64805
2.4 RNAi-Kv1.3轉染Treg細胞對Kv1.3通道電流密度的影響全細胞膜片鉗模式測定正常Tregs細胞與沉默組Tregs細胞在+40 mV Kv1.3鉀通道電流變化,與正常組Tregs細胞Kv1.3鉀通道+40 mV的電流峰值密度[(601.7±11.76) pA/pF,n=10]相比,沉默組峰值電流密度[(172.5± 16.94) pA/pF,n=12],抑制率為71.3%(Fig 4)。
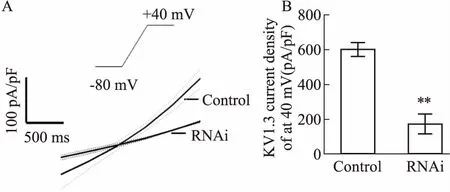
Fig 4 Kv1.3 channel current changes between normal group and silent group
A: The original graph of the current density with the slope stimulation,the dotted line is the standard error; B: The Kv1.3 current density bar chart under +40 mv.**P<0.01vscontrol.
Tab 3 IL-10,TGF-β levels secreted by Tregs(ng·L-1,n=8)

GroupIL-10IntracellularExtracellularTGF-βIntracellularExtracellularTregs28.48±2.7938.37±4.88174.18±4.15154.96±1.29Tregs+EPL26.53±4.6027.01±3.90?139.54±3.90??124.05±0.56?RNAi-Tregs26.58±1.8633.96±2.88123.49±1.91??111.59±4.27??RNAi-Tregs+EPL21.47±1.5132.79±1.92120.56±2.47110.66±0.91
*P<0.05,**P<0.01vsTregs
2.5 Tregs細胞分泌IL-10、TGF-βELSIA法檢測細胞Tregs組、Tregs+EPL組、RNAi-Tregs組、RNAi-Tregs+EPL組IL-10、TGF-β分泌水平,EPL濃度為30 μmol·L-1。與Tregs組相比,RNAi-Tregs組內外液TGF-β水平明顯降低(P<0.01),Tregs+EPL組內外液TGF-β水平亦降低(P<0.05);與RNAi-Tregs組相比,RNAi-Tregs+EPL組內外液TGF-β水平無明顯變化;而Tregs組、Tregs+EPL組、RNAi-Tregs組和RNAi-Tregs+EPL組內外液IL-10水平無明顯變化(Tab 3)。
3 討論
Tregs在機體免疫與平衡中占據著重要地位。但是,Tregs在炎癥情況下對器官纖維化的作用并未引起足夠重視,而且有爭議:一種假設認為免疫抑制Tregs能引起器官纖維化;另一種觀點卻認為,Tregs主要分泌TGF-β而導致了纖維化。因此,減少不必要的T淋巴細胞活化或增強Tregs細胞調節作用,有可能作為治療心力衰竭的新靶標[9-10]。
越來越多的間接和直接證據提示,Kv1.3通道與Tregs細胞的關系密切。Varga等[11]在多發性硬化患者的Tregs中發現Kv1.3通道含量較少。Estes等[12]利用高通量定量方法,分析了人初始淋巴細胞的K+通道功能性活動,結果提示Kv1.3通道的活性可作為T細胞的功能活性標志物。而既往的研究[13-15]發現,可以通過沉默記憶T細胞上的Kv1.3通道,作為治療自身性免疫性疾病的一種手段。因此,RNAi技術在細胞與分子水平上很大程度上都得到了廣泛應用。本研究通過采用RNAi技術,將RNAi-Kv1.3慢病毒載體轉染至大鼠Tregs細胞。Tregs細胞主要為懸浮細胞,非貼壁生長,難轉染。經慢病毒轉染后,沉默組Kv1.3通道基因水平抑制率達到78.0%,電流降低71.3%。ELSIA法檢測Tregs細胞分泌因子水平,Tregs+EPL組內外液TGF-β水平降低,RNAi-Tregs組內外液TGF-β水平也明顯降低,但是RNAi-Tregs+EPL組內外液TGF-β水平相比RNAi-Tregs組卻無明顯變化。而體外不給予EPL或給予EPL情況下,RNAi-Kv1.3 Tregs組并沒有任何變化,這表明沉默Kv1.3通道后,EPL不再發揮抑制Tregs細胞分泌TGF-β水平;且沉默Kv1.3通道后,可抑制Tregs細胞內外液分泌的TGF-β水平,與EPL可通過下調Tregs細胞Kv1.3通道表達,進而抑制Tregs細胞內外液分泌的TGF-β水平結果相一致。這表明Kv1.3通道在Tregs細胞調控纖維化的作用中扮演著重要角色。
以上研究結果闡明了Kv1.3通道介導著Tregs細胞的活化增殖,而EPL可通過直接抑制Kv1.3通道,進而減少TGF-β的分泌,從而抑制心肌纖維化,這與我們前期分子對接顯示結果相一致[16]。提示Kv1.3通道可作為心衰診治的潛在免疫學靶點。