趨化因子CCL2對大鼠學習記憶的影響及其機制
陳健民,譚麗秋,蔣俊俊,梁冰玉,周 燕,
(廣西醫科大學1. 藥學院、2. 廣西艾滋病防治研究重點實驗室,廣西 南寧 530021)
趨化因子是細胞因子家族中的重要組成成員之一,根據其N末端半胱氨酸殘基的數量和排列不同,可進一步將趨化因子分為4類,即C類、CC類、CXC類以及CX3C類。最初認為趨化因子是免疫調節的重要參與者之一,具有募集、趨化免疫細胞到達炎癥部分并發揮免疫應答的作用。近年來的研究發現,趨化因子在中樞神經系統(central nervous system, CNS)中扮演著重要且多重的角色,其中,CC類趨化因子配體2(chemokine CC motif ligand 2, CCL2)作為趨化作用最強的因子之一,近年來備受關注。在CNS中,CCL2具有維持神經元正常活性,并參與神經元通訊交流等生理功能。然而,過表達的CCL2參與了如中風、癲癇、神經退行性疾病[1-3]等CNS疾病發生的病理生理過程。在腦部,CCL2主要由星形膠質細胞和小膠質細胞產生,此外,血管內皮細胞以及來源于外周并遷移至CNS的巨噬細胞等,也可產生CCL2[4]。這些細胞釋放的CCL2能通過誘導炎癥反應、興奮毒性、氧化應激等途徑損傷神經元,并可能導致患者出現學習記憶力減退及認知功能低下的臨床表現。研究人員在阿爾茨海默癥(Alzheimer′s disease, AD)、艾滋性認知功能障礙(HIV-associated neurocognitive disorder, HAND)等患者的腦脊液中檢測到了高水平的CCL2,而這些患者均伴隨有不同程度的認知功能障礙[5-6],提示CCL2可能與認知功能損害有關。但由于相關的實驗數據和結論太少,導致對CCL2的致病機制還不是十分清楚。故本研究采用腦部立體定位技術,首次將CCL2注射至大鼠雙側海馬腦區,制備一種動物模型來研究CCL2對大鼠學習記憶的影響及機制。我們利用Morris水迷宮(Morris water maze, MWM)檢測CCL2對大鼠的學習記憶的影響,實時熒光定量PCR(RT-PCR)檢測海馬組織中參與細胞凋亡相關蛋白caspase-8、caspase-3 mRNA的表達水平,探討其誘導海馬神經元凋亡的機制;RT-PCR法檢測各組大鼠海馬組織內磷酸激活谷氨酰胺酶(phosphate-activated glutaminase, PAG))mRNA的表達,ELISA法檢測各組大鼠海馬組織內腫瘤壞死因子ɑ(tumor necrosis factorɑ, TNF-ɑ)、乙酰膽堿酯酶(cholinesterase, AChE)的含量以及谷氨酰胺合成酶(glutamine synthetase, GS)的活力,來探究其誘發神經損傷的機制。該研究旨在探究CCL2對學習記憶的影響和機制,為后續的臨床治療提供研究基礎和治療見解。
1 材料與方法
1.1 實驗動物及分組40只SPF級♂SD大鼠,體質量(215±15)g,購自于廣西醫科大學實驗動物中心,實驗動物生產許可證:SCXK桂2014-0002,實驗動物使用許可證:SCXK桂2014-0003。適應性喂養1周,給予規律光照(9 ∶00~17 ∶00),允許自由攝食飲水。SD大鼠隨機分為5組:空白對照組(control)、假手術組(sham)、CCL2(0.5、5、50 ng)組,每組8只。將CCL2先配成100 mg·L-1的母液,用時用無菌生理鹽水分別稀釋成0.1、1、10 mg·L-1,除空白對照組外,其余各組均進行雙側海馬內注射,每側注射體積為2.5 μL,假手術組給予等量無菌生理鹽水。
1.2 試劑與儀器CCL2(R&D systems,批號:279-MC/CF);caspase-8、caspase-3、PAG、GAPDH引物(上海捷瑞生物工程有限公司);AxyPrep總RNA制備試劑盒(康寧生命科學有限公司,批號:07418KD1);逆轉錄試劑盒(TaKaRa,批號:RR047A);SYBR熒光染料擴增試劑盒(TaKaRa,批號:RR820A);大鼠TNF-ɑ、GS、AChE酶聯免疫分析試劑盒(北京安迪華泰生物科技有限公司);BCA蛋白濃度測定試劑盒(碧云天,批號:P0010S)。腦立體定位儀(深圳瑞沃德生命科技有限公司);10 μL Hamilton微量注射器(Hamilton公司,型號:701N);Morris水迷宮實驗裝置及分析系統(淮北正華生物儀器設備有限公司)。
1.3 模型制備配制1%的戊巴比妥鈉,按45 mg·kg-1劑量腹腔注射麻醉。待動物麻醉后,顱頂區常規備皮,碘伏消毒。參照大鼠腦立體定位圖譜,以前囟為原點,按AP=-3.7 mm、ML=±3.0 mm、DV=-3.0 mm的坐標位置進行海馬區注射,注射速度為0.3 μL·min-1,注射完成后停針5 min避免藥物外漏,隨后緩慢提針。注射完成后縫合皮膚,并注射青霉素(30萬單位·kg-1)防止感染。
1.4 Morris水迷宮實驗術后的d 3開始進行Morris水迷宮實驗。水池直徑為160 cm,池壁分為NW、SW、SE、EN四個象限,每個象限水池壁的中心位置各放置1個不同形狀的標志物,水溫控制在(22±1)℃,在SW象限中心的水面下2 cm處放置1個平臺。實驗由3部分組成:① 適應階段:在正式實驗前1 d將大鼠放置水池中任意游60 s,目的是讓其適應環境;② 定位航行實驗:該階段共進行5 d,每天進行4次,每次將大鼠從不同的象限放入水中,記錄每次從入水點到找到水下平臺的時間(即逃避潛伏期)、游泳速度及游泳路程。實驗記錄的總時長為90 s,若大鼠在90 s內未能找到平臺,則手動引導其到達平臺30 s,此次的逃避潛伏期記為90 s。③ 空間探索實驗:該階段在定位航行實驗結束后的24 h進行,在本實驗中撤去水下平臺,將大鼠從任一象限放入水中,記錄其在90 s內在原平臺所在象限的路程百分比及原平臺穿越次數。
1.5 qPCR檢測caspase-8、caspase-3、PAG mRNA的表達Morris水迷宮實驗結束后,于d 10分離各組大鼠海馬組織,按柱式RNA提取試劑盒的說明提取總RNA,按逆轉錄試劑盒的說明將RNA逆轉錄成cDNA,按擴增試劑盒的說明對目的基因進行擴增,獲得目的基因的擴增曲線和熔解曲線,記錄各基因的Ct值,GAPDH為內參基因,引物序列見Tab 1。結果用2-ΔΔCt法進行計算。

Tab 1 Primer sequence of target genes
1.6 ELISA法檢測海馬組織內TNF-α、AChE的含量以及GS的活力將各組大鼠于冰上迅速斷頭取腦,分離海馬組織,并制備10%的海馬勻漿,BCA法檢測各樣本蛋白總濃度,TNF-α、AChE的含量檢測以及GS的活力檢測按照相關試劑盒的說明操作。

2 結果
2.1 各組大鼠游泳速度、逃避潛伏期和游泳路程的結果比較Tab 2結果顯示,與假手術組相比,在各組大鼠游泳速度無明顯差異的前提下,各CCL2處理組大鼠的逃避潛伏期及游泳路程均明顯增長,且呈劑量依賴性,差異具有統計學意義(P<0.05)。d 5各組大鼠的游泳軌跡見Fig 1。
2.2 各組大鼠原平臺穿越次數、原平臺所在象限路程百分比結果Tab 3結果顯示,與假手術組相比,各CCL2處理組大鼠原平臺穿越次數及原平臺所在象限的路程百分比均明顯減少,并呈現劑量依賴性,差異具有統計學意義(P<0.05)。
2.3 海馬組織內caspase-8、caspase-3、PAG mRNA的表達結果如Fig 2所示,與假手術組相比,各CCL2處理組大鼠海馬組織內caspase-8 mRNA的相對表達有升高趨勢,結果呈現劑量依賴性關系,50 ng CCL2組差異有統計學意義(P<0.01)。caspase-3 mRNA的相對表達量均有升高趨勢,結果呈現劑量依賴性關系,但差異無統計學意義。PAG mRNA的相對表達呈現劑量依賴性關系增加,50 ng CCL2組差異有統計學意義(P<0.05)。

Fig 1 Typical swim-tracking path in probe trial on 5th training day
A:Control; B: Sham; C: 0.5 ng CCL2; D:5 ng CCL2; E: 50 ng CCL2.

Tab 2 Results of swimming speed, escape time and swimming distance of each
*P<0.05,**P<0.01vssham

Tab 3 Results of crossing times, percentage of distance spent in target quadrant of each
*P<0.05,**P<0.01vssham
2.4 海馬組織內TNF-α、AChE的含量以及GS的活性檢測如Fig 3所示,與假手術組相比,各CCL2處理組大鼠海馬組織內TNF-α、AChE含量均升高,50 ng CCL2組結果有統計學意義(P<0.05);GS的活力均降低,5、50 ng CCL2組差異具有統計學意義(P<0.01)。
3 討論
CCL2又被稱為單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1),是CC趨化家族的重要成員,是目前已知的趨化作用最強的細胞因子之一,在顱腦創傷、多發性硬化癥,腦缺血等多種中樞神經系統疾病中具有重要作用[7-9]。研究發現,CCL2主要與CC類趨化因子受體2(CCR2)結合,并募集單核細胞到達特定部位,介導炎癥反應的發生。CCL2-CCR2軸在老年癡呆、艾滋性癡呆以及帕金森病患者表現出的抑郁癥等疾病的病理生理過程中扮演了重要的角色,研究人員從這些患者的腦脊液中檢測到了高表達的CCL2以及CCR2,而這些患者通常伴有不同程度的認知功能障礙,說明CCL2可能影響患者的學習記憶、認知能力以及情緒活動[5,10-11],但其具體的作用和機制仍不是十分明確。因此,本研究首次將不同劑量的CCL2注射至大鼠雙側海馬腦區制備動物模型,來研究CCL2對學習記憶的影響及其機制。我們利用Morris水迷宮實驗檢測大鼠的學習記憶能力,探究CCL2對大鼠的學習記憶功能的影響。經典的Morris水迷宮實驗由定位航行實驗和空間探索實驗兩部分組成,前者著重檢測嚙齒動物的學習能力,后者主要用于檢測動物記憶的維持能力。本研究結果表明,在各組大鼠游泳速度無明顯差異的前提下,不同劑量的CCL2均能明顯延長大鼠的逃避潛伏期,增加游泳路程,且結果呈劑量依賴性關系,表明CCL2能夠損傷大鼠的學習能力。在空間探索實驗中,不同劑量的CCL2均能明顯減少平臺的穿越次數以及原平臺所在象限的路程百分比,表明各模型組大鼠的空間記憶受到不同程度的損害,且呈劑量依賴性關系。提示CCL2能劑量依賴性地損傷大鼠的學習記憶能力。此外,臨床研究也發現,患者出現認知障礙的程度與腦脊液中CCL2表達水平呈正相關。
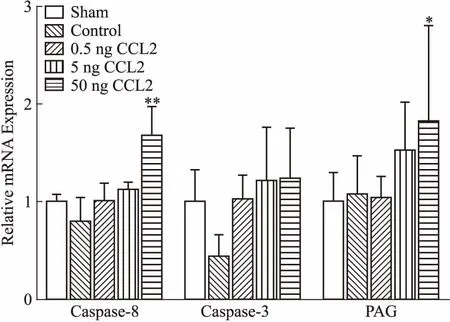
Fig 2 The relative expression of caspase-8, caspase-3 and PAG mRNA in rat
*P<0.05,**P<0.01vssham
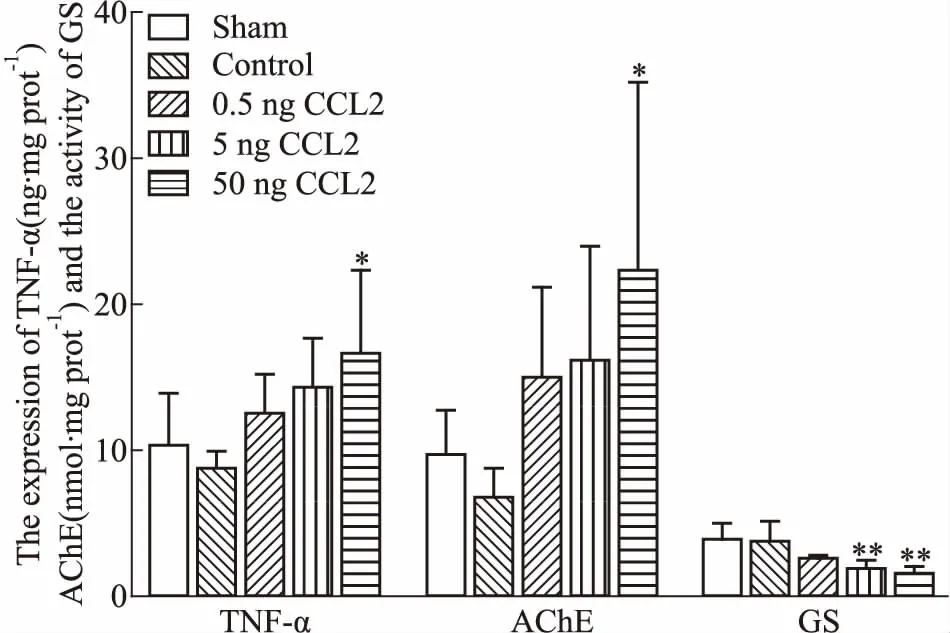
Fig 3 Expression of TNF-α, AChE and activity of
*P<0.05,**P<0.01vssham
上述行為學實驗已經表明,CCL2能損傷大鼠的學習記憶和認知功能,而膽堿能神經系統在學習記憶中發揮了重要的作用,在阿爾茨海默癥患者中能觀察到膽堿能神經元的丟失,而高表達的AChE能水解ACh,降低ACh的含量,從而降低患者的學習記憶能力。故我們進一步檢測了大鼠海馬組織內AChE的表達,探究CCL2是否能影響ACh的水平。結果表明,各模型組大鼠海馬組織內AChE的活性升高,表明CCL2可通過升高AChE,減少ACh的含量,降低大鼠的學習記憶力。
中樞神經炎癥和興奮性毒性是CNS疾病發病過程涉及的兩大機制。CCL2的促炎癥反應已經是公認的事實,CCL2作為一種促炎性趨化因子,能誘導多種炎性細胞因子和趨化因子的表達,放大炎癥反應并損傷組織細胞。在本研究中,我們檢測了各組大鼠海馬組織內TNF-α的表達,結果證明0.5~50 ng的CCL2能增加TNF-α的水平,且該效應呈劑量依賴關系,表明CCL2能誘導TNF-α的表達,促進炎癥反應的發生。
CNS的興奮性在突觸傳遞中具有重要意義,谷氨酸是腦內重要的興奮性氨基酸,通過激活突觸后膜上的NMDA受體,增強長時程增強效應(long-term potentiation,LTP),而該效應被認為是學習記憶重要的分子機制之一。但是,突觸間隙過多累積的谷氨酸能過度激活NMDA受體,導致細胞內Ca2+超載,并由此引發細胞凋亡,因此,神經系統過度興奮會導致興奮性毒性的發生。我們前期的研究發現[12-13],CCL2不僅僅是增強NMDA受體介導的興奮性突觸后電流(excitatory postsynaptic current,EPSC),介導Ca2+內流增加,并且還能導致神經元結構損傷,并引起神經元死亡,表明CCL2介導突觸傳遞的增強過程與興奮毒性有關。故我們進一步猜測CCL2與谷氨酸的生成有關。在神經元和神經膠質細胞中存在一個谷氨酸-谷氨酰胺循環,其中GS和PAG是該循環中具有重要調節作用的兩種酶。GS能將攝入到膠質細胞中的谷氨酸變成谷氨酰胺,降低谷氨酸的水平,而PAG則能使谷氨酰胺脫氨基生成谷氨酸,從而提高谷氨酸的水平。故我們檢測了上述兩種酶的表達。實驗結果表明,CCL2能降低GS的活力,同時上調PAG的表達,這兩種效應的綜合結果使得谷氨酸的合成增加。我們前期研究結果表明,CCL2能增加NMDA受體介導的EPSC幅度,在給予NMDA受體阻斷劑后,其幅度明顯下降,而谷氨酸具有激活NMDA受體的作用。因此,我們認為CCL2促進神經興奮毒性發生的機制可能與增加谷氨酸在神經突觸間隙的濃度,并過度興奮NMDA受體有關。
綜上,我們發現CCL2參與了炎癥反應和興奮性毒性的發生。這些傷害性刺激往往能誘導神經元凋亡的發生,且神經元凋亡導致神經元丟失應該是引起學習記憶力下降的證據之一。細胞凋亡是機體內清除老化、壞死的細胞結構,維持內環境穩態的程序性細胞死亡過程,對于保證機體的正常生理功能具有重要意義。然而,在如炎癥、興奮性毒性引起的Ca2+超載、氧化應激等條件的刺激下,導致凋亡異常發生,進而參與腫瘤、自身免疫性疾病、神經退行性疾病等疾病的病理生理過程。細胞凋亡途徑分為caspase依賴性途徑和非caspase依賴性途徑,前者主要由caspase分子執行,又主要分為兩類:①線粒體通路,由線粒體內的細胞色素c釋放至胞質中,并切割caspase-9前體,激活caspase-9啟動凋亡程序,該通路又被稱為內源性途徑。②外源性通路,也被稱為死亡受體通路,即Fas/FasL通路,由FasL與Fas結合并活化caspase-8啟動級聯反應。死亡受體隸屬于腫瘤壞死因子受體超家族,因此,TNF-ɑ能激活神經元細胞膜上的死亡結構域,進而引起caspase級聯效應,此外,興奮性毒性也能誘導細胞凋亡的發生。前已述及CCL2能促進TNF-ɑ和谷氨酸的表達,故本研究進一步檢測了參與外源性凋亡途徑中caspase-8、caspase-3的相對表達,將炎癥反應、興奮性毒性與外源性凋亡途徑聯系起來,探討CCL2誘導海馬神經元凋亡的機制。實驗結果表明,各劑量CCL2能夠以劑量依賴性關系上調海馬組織內caspase-8、caspae-3 mRNA的相對表達,尤其是高劑量CCL2對caspase-8 mRNA相對表達的上調作用明顯,證明CCL2可通過外源性細胞凋亡途徑,導致海馬神經元發生細胞凋亡。
綜上,本研究發現,在行為學實驗中,0.5~50 ng的CCL2劑量依賴性地損傷大鼠的學習記憶能力,并有以下幾個方面作用:① 通過促進TNF-α表達,誘導炎癥反應的發生;② 通過上調PAG表達,抑制GS活性,并促進EPSCNMDAR的幅度,介導神經興奮毒性的發生;③ 通過上調AChE的表達,水解ACh,降低ACh的含量;④ 可活化caspase-8依賴的外源性細胞凋亡途徑,介導細胞凋亡的發生。由此可以得出結論,0.5~50 ng的CCL2能劑量依賴性損傷學習記憶力,其機制和腦組織炎癥反應、神經興奮毒性及ACh含量下降有關,并最終誘導caspase-8依賴的外源性細胞凋亡途徑,介導神經細胞凋亡的發生。
(致謝:本文中水迷宮實驗在廣西醫科大學公共衛生學院完成,ELISA、RT-PCR在廣西醫科大學醫學實驗中心細胞與免疫實驗室完成。感謝各位老師和同學給予的幫助。)