白藜蘆醇對高脂所致心肌細胞氧化應激損傷的保護作用及其與AMPK/mTORC1/p70S6K信號通路的相關性
張景怡,鮑翠玉,李 晶
(湖北科技學院 1. 藥學院、2. 糖尿病心腦血管病變湖北省重點實驗室,湖北 咸寧 437100)
糖尿病是一種在醫療保健系統中造成嚴重經濟影響,且發病率越來越高的代謝性疾病[1],其心血管并發癥的發病率和死亡率在逐年增加[2]。而糖尿病性心肌病是一種特殊的心臟并發癥,近年來,諸多文獻報道表明,糖尿病心肌病的發病過程與脂毒性密切相關[3],經常伴有相關的脂肪酸代謝失調。在糖尿病嚙齒動物模型和肥胖患者中,盡管出現了高胰島素血癥和高血糖癥,但心肌的損害幾乎完全依賴于脂肪酸的利用,飽和脂肪酸的過量供應抑制葡萄糖氧化速率,并加劇心肌耗氧,增加了活性氧的產生和脂質體堆積,導致心肌氧化損傷[4-5]。
白藜蘆醇是一種存在于虎杖、何首烏等天然植物中的非黃酮類多酚化合物,具有抗炎、抗血小板聚集、抗癌和抗衰老、保護血管和抗糖尿病及其并發癥的作用[6]。研究發現,白藜蘆醇可以降低血糖、改善血脂、抗氧化、抑制炎癥因子表達等[7],據報道,白藜蘆醇的這些作用可能與調控內質網應激、線粒體凋亡通路相關[8-9]。但AMPK/mTORC1/p70S6K信號通路與白藜蘆醇抗脂毒性心肌細胞損傷的相關性,目前尚無文獻報道。基于此,本研究以AMPK/mTORC1/p70S6K信號通路為切入點,采用棕櫚酸(palmitic acid,PA)誘導的心肌細胞脂毒性損傷模型,探討白藜蘆醇對高脂所致心肌細胞損傷的保護作用及其機制。
1 材料與方法
1.1 材料
1.1.1細胞株 H9c2大鼠心肌細胞,購自上海通派生物有限公司。
1.1.2試劑 AMPKα、p-AMPKα(Thr172)、mTORC1、p-mTORC1(Ser2448)、p70S6K、p-p70S6K(Thr398)、Bcl-2、cleaved caspase-3、β-actin(8H10D10)抗體,購自美國CST公司;Bax抗體,購自Proteintech公司;PA、白藜蘆醇,購自美國Sigma公司;DMEM培養基,購自美國HyClone公司;胎牛血清,購自浙江天杭生物科技股份有限公司;BCA蛋白定量試劑盒,購自VazymE公司;丙二醛(malondialdehyde,MDA)檢測試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒,購自南京建成生物工程研究所;活性氧(reactive oxygen species,ROS)檢測試劑盒、MTT檢測試劑盒,均購自碧云天公司。
1.1.3儀器 細胞CO2培養箱(Thermo公司);超凈工作臺(蘇州凈化公司);恒溫空氣浴搖床(上海福瑪實驗設備有限公司);CKX41倒置相差顯微鏡(日本OLYMPUS公司);多功能酶標儀(美國寶特公司);流式細胞儀(美國BD Biosciences公司);電泳槽、電轉膜儀(Bio-Rad公司);化學發光凝膠成像系統(英國SYNGENE公司)。
1.2 方法
1.2.1PA及白藜蘆醇的配制 用0.1 mol·L-1的NaOH溶液,在70 ℃水浴中溶解一定量的PA,振蕩混勻10 min,過濾,配成100 mmol·L-1的PA儲存液。在55 ℃水浴中,用去離子水配制50 g·L-1的牛血清白蛋白(bovine serum albumin,BSA)溶液,過濾。將上述PA溶液和BSA溶液按1 ∶19的體積比混合,配成PA/BSA復合液,在水浴中振蕩10 s,繼續水浴10 min,取出后冷卻至室溫,過濾。然后,將上述復合液分別用DMEM培養基稀釋。白藜蘆醇則溶解于DMSO,使母液濃度達到100 mmol·L-1,使用前將其融于DMEM(含血清、雙抗)達到工作液濃度,渦旋混勻后使用。
1.2.2細胞培養 從液氮中取出H9c2心肌細胞,接種于含25 mmol·L-1的葡萄糖、10%胎牛血清、雙抗的DMEM培養基中,37 ℃、5% CO2培養箱培養24~48 h后更換培養液,直至細胞生長密度達到70%~80%時,用含有0.25% EDTA的胰酶輕輕吹打消化、傳代至所需培養皿中進行實驗。
1.2.3實驗分組 ① PA濃度梯度: control組(空白對照組加入同等體積的PBS)、PA(0.1、0.2、0.4、0.8 mmol·L-1)刺激24 h組,進行MTT檢測。② PA時間梯度: control組(空白對照組加入同等體積的PBS)、PA(0.4 mmol·L-1)刺激0、12、24、48 h組,進行MTT檢測。③ 白藜蘆醇作用實驗:control組(空白對照組加入同等體積的PBS);PA(0.4 mmol·L-1)組;白藜蘆醇(0、25、50、100 μmol·L-1)組,用含白藜蘆醇培養基預處理1 h后吸出培養基,再加入含PA+白藜蘆醇的培養基;白藜蘆醇100 μmol·L-1組,用含白藜蘆醇培養基預處理1 h后吸出培養基,再加入含PBS+白藜蘆醇的培養基,進行MTT檢測。④白藜蘆醇作用機制實驗: control組、PA 0.4 mmol·L-1組、PA 0.4 mmol·L-1+白藜蘆醇100 μmol·L-1組(含白藜蘆醇培養基預處理1 h后吸出培養基,再加入含PA+白藜蘆醇的培養基),進行其他檢測。
1.2.4MTT檢測細胞增殖 以每孔含1×106個細胞為標準,接種于96孔板中(設立6個復孔),培養24 h后給藥,進行孵育,每孔加入20 μL MTT(5 g·L-1,美國Sigma公司),將96孔板放置CO2培養箱培養4 h后,棄去上清液,并每孔加入DMSO 150 μL,用酶標儀檢測570 nm處的各孔OD值。細胞活力=OD處理孔/OD陰性對照孔×100%。
1.2.5免疫熒光及流式檢測ROS H9c2細胞接種6孔板,當細胞貼壁生長至70%~80%融合度,分組給藥后,培養箱內孵育24 h,PBS反復沖洗后,一部分細胞培養板內加入10 mmol·L-1DHE,培養箱內孵育30 min,PBS反復沖洗后,采用熒光顯微鏡進行拍照,并用ImageJ 1.41軟件分析紅色熒光強度。另一部分細胞培養板,用胰酶消化制備成單細胞懸液,直接收集細胞。用0.5~1 mL冰冷PBS重懸細胞,用流式細胞檢測儀檢測ROS陽性細胞所占的比率。免疫熒光檢測和流式細胞檢測均采用480~535 nm波長激發,測定590~610 nm以上的發射,細胞應可分成兩個亞群:ROS陰性細胞僅有很低的熒光強度,ROS陽性細胞有較強的紅色熒光。
1.2.6氧化應激相關生化指標的檢測 H9c2細胞接種6孔板,當細胞貼壁生長至70%~80%融合度,分組給藥后,培養箱內孵育24 h,PBS反復沖洗后,收集H9c2細胞,經超聲破碎處理后,分別按照試劑盒說明測定MDA含量和SOD活性。
1.2.7免疫印跡法檢測蛋白表達 H9c2細胞放入5% CO2培養箱培養24 h后,PBS洗去細胞雜質,每個皿加入裂解液充分裂解細胞,細胞刮刀收集于離心管,離心后收集上清,用BCA試劑盒測定蛋白含量。蛋白定量后,取20 μL的蛋白樣品上樣于5%~15%的SDS-PAGE凝膠,電泳分離,冰浴下濕法轉移至PVDF膜2 h,用5%的脫脂奶粉室溫搖床封閉1 h,加入對應一抗4 ℃搖床孵育過夜。次日換為HRP標記的二抗室溫孵育1 h,用ECL化學發光顯影,然后凝膠成像系統檢測AMPKα、p-AMPKα、mTORC1、p-mTORC1、p70S6K、p-p70S6K、β-actin的表達水平,以及凋亡相關蛋白Bcl-2、Bax、cleaved caspase-3的表達水平。

2 結果
2.1 白藜蘆醇對高脂誘導的H9c2心肌細胞增殖能力低下的影響體外培養H9c2心肌細胞,用含PA(0.1、0.2、0.4、0.8 mmol·L-1)的DMEM培養基刺激24 h。如Fig 1A所示,隨著PA濃度的增加,H9c2細胞存活率呈下降趨勢,PA濃度在0.4 mmol·L-1時,降低明顯(P<0.05)。Fig 1B結果顯示,含PA 0.4 mmol·L-1的DMEM培養基刺激細胞0、12、24、48 h后,H9c2心肌細胞隨著刺激時間的延長,細胞數量明顯減少,在刺激細胞24 h時,細胞存活率開始明顯降低(P<0.05)。因此,我們將PA濃度定為0.4 mmol·L-1,刺激時間定為24 h開展下一步實驗。如Fig 1C所示,當0.4 mmol·L-1PA刺激24 h時,H9c2心肌細胞的增殖能力明顯降低,隨著白藜蘆醇濃度的升高,PA+白藜蘆醇組的細胞增殖率呈現濃度依賴性升高趨勢。提示白藜蘆醇對高脂誘導的心肌細胞增殖率的損傷有明顯的改善作用,因此,在后續實驗中選擇白藜蘆醇濃度為100 μmol·L-1。

Fig 1 Viability of H9c2 cells treated with PA alone or combination of PA and resveratrol n=5)
A: Concentration-dependent cell damage induced by PA at 24 h stimulation time.*P<0.05,**P<0.01vs0 mmol·L-1group. B: Time-dependent cell damage induced by PA at 0.4 mmol·L-1concentration.*P<0.05,**P<0.01vs0 h group. C: Viability of cells treated with varied drugs (culture time: 24 h).*P<0.05vscontrol group;#P<0.05,##P<0.01vsPA group.
2.2 白藜蘆醇對高脂誘導的H9c2細胞內氧化應激水平的影響如Fig 2、Fig 3A所示,0.4 mmol·L-1PA刺激24 h后,細胞內ROS的紅色熒光強度及用流式細胞儀檢測的細胞內ROS的水平均出現高表達狀態(P<0.05),而預處理白藜蘆醇組可以明顯降低心肌細胞內高脂誘導的ROS產生(P<0.05)。如Fig 3B、3C所示,0.4 mmol·L-1PA刺激24 h 后,細胞內MDA的水平明顯升高(P<0.05),而細胞內SOD的水平明顯降低(P<0.05);白藜蘆醇預處理組可以明顯降低心肌細胞內高脂誘導的MDA產生(P<0.05),并升高SOD水平。
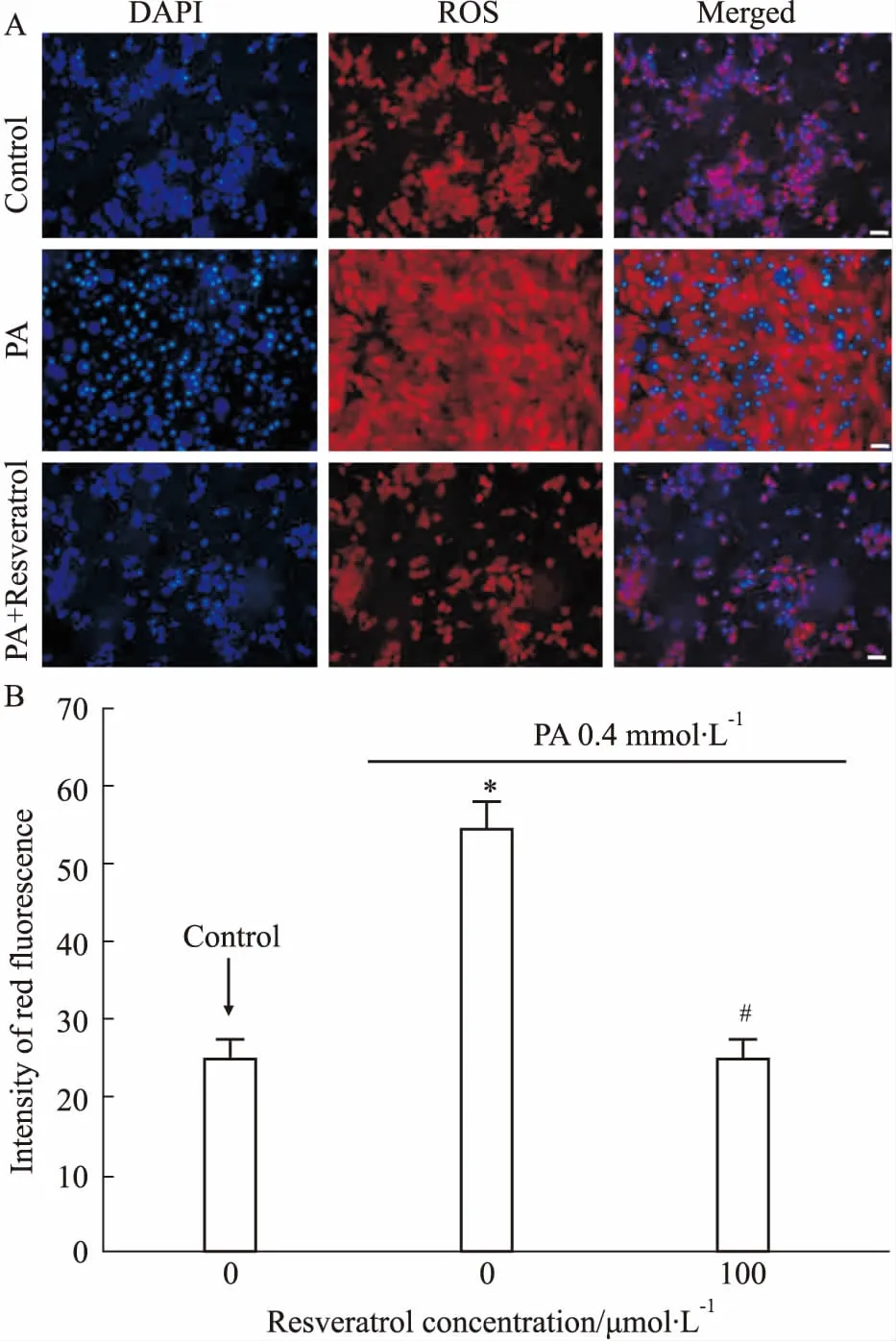
Fig 2 Effect of resveratrol on PA-induced cardiomyocyte oxidative damage (scale bar: 50 μm)

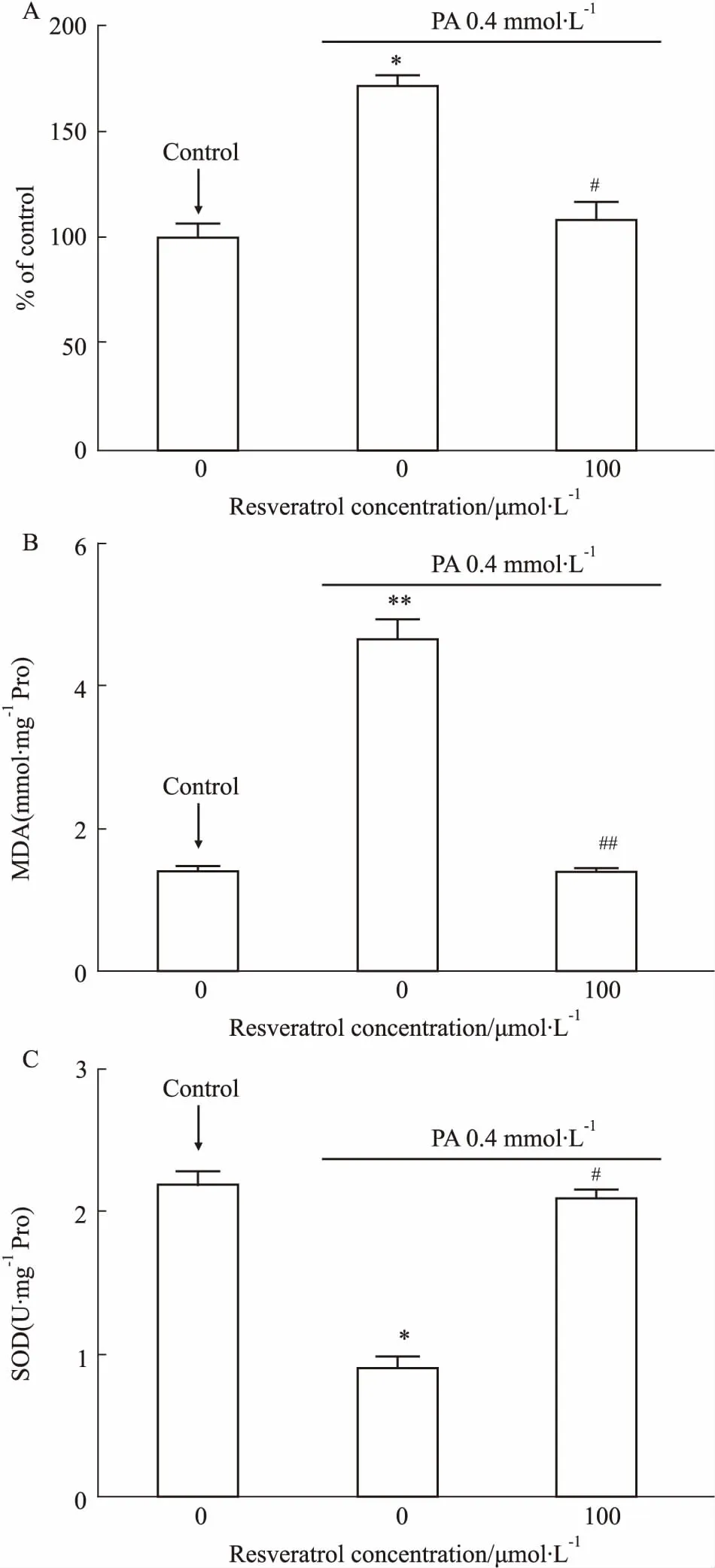
Fig 3 Level of major biochemical parameters of H9c2 cells treated with PA alone or combination of PA and resveratrol for 24 h n=3)
A: The level of ROS was determined by flow cytometry; B: MDA levels in cells; C: SOD activity in cells.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsPA group.
2.3 白藜蘆醇對高脂誘導的H9c2細胞AMPK/mTORC1/p70S6K信號通路蛋白及凋亡蛋白表達的影響如Fig 4A所示,用含0.4 mmol·L-1PA的DMEM培養基刺激H9c2心肌細胞24 h時,p-AMPKα表達明顯下降(P<0.05),而p-mTORC1、p-p70S6K蛋白表達明顯升高;預處理白藜蘆醇組可以明顯逆轉心肌細胞內高脂誘導的p-AMPKα蛋白的降低以及p-mTORC1、p-p70S6K蛋白表達的升高(P<0.05)。如Fig 4B所示,用含0.4 mmol·L-1PA的DMEM培養基刺激H9c2心肌細胞24 h時,Bcl-2水平明顯下降(P<0.05),而Bax、cleaved caspase-3表達均明顯升高(P<0.05)。而預處理白藜蘆醇組可以明顯逆轉心肌細胞內高脂誘導的Bcl-2蛋白表達的降低以及Bax、cleaved caspase-3蛋白表達的升高(P<0.05)。
3 討論
糖尿病性心肌病的危險因素包括高糖化血紅蛋白、肥胖、老年、伴發冠心病、視網膜病變、蛋白尿和白蛋白尿、腎病、長期使用胰島素治療以及糖尿病病程等。研究顯示,糖尿病患者的心衰發病率明顯高于對照組,心衰是僅次于外周血管病的第二大糖尿病心血管并發癥。糖尿病心肌病的病因復雜,隨著對糖尿病的深入研究,發現脂毒性是糖尿心肌病發病的重要原因之一[4]。當機體營養過剩時,脂肪細胞增大,且功能出現異常,對胰島素抗脂解作用減弱,導致游離脂肪酸增多;其次,增大的脂肪細胞降低了儲脂能力,一旦脂肪的量大于儲備能力時,多余的甘油三酯就會分流到肝臟、肌肉以及胰島細胞,從而引發外周胰島素抵抗和胰島素分泌功能障礙,這就是所謂的脂肪分存及脂毒性。脂毒性不僅影響肝臟、肌肉和胰島細胞,對機體其他的重要組織也有影響,其中對心臟功能的危害性最大。近年來發現,在血糖升高的胰島素抵抗階段,患者的心臟功能已經受到損害。動物實驗也證實,高游離脂肪酸血癥和高甘油三酯血癥可以導致心肌脂質沉積、心室壁增厚、心室重構、心臟收縮功能降低。本研究結果顯示,不同濃度的PA刺激心肌細胞時,細胞存活率呈濃度梯度下降趨勢,符合文獻報道;而白藜蘆醇預處理可以明顯減輕高脂對心肌細胞存活率的影響。
脂毒性心肌病發病機制復雜,與多條信號通路相關,尤其是AMPK相關通路已成為近年來的研究熱點[5]。機體存在氧化-抗氧化的平衡機制,SOD作為體內重要的抗氧化物酶亦釋放增多,用以清除體內過度釋放的自由基,減少細胞膜的損傷。因此,MDA常被用于間接反映機體的氧化損傷,而SOD反映抗氧化能力。基于此,我們檢測了心肌細胞內ROS的生成和MDA、SOD的水平,發現高脂刺激心肌細胞24 h后,心肌細胞內ROS的含量及MDA含量均明顯升高,SOD活性明顯降低,而白藜蘆醇預處理可以明顯逆轉高脂誘導的上述指標的變化。提示白藜蘆醇可以明顯抑制高脂誘發的細胞內氧化應激。
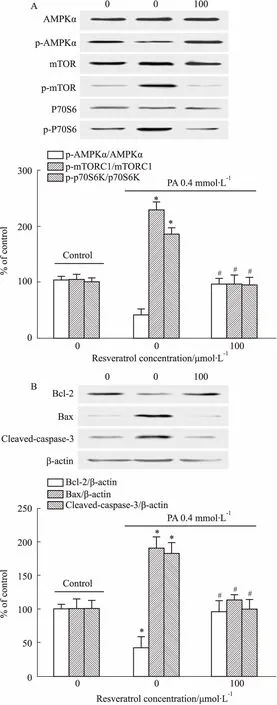
Fig 4 Effect of resveratrol on expression of AMPK/mTORC1/ p70S6K pathway-related proteins(A) and apoptosis-related proteins(B) in cardiomyocytes induced by PA n=3)
*P<0.05vscontrol group;#P<0.05vsPA group
AMPK是重要的能量傳感器,有研究發現,在肥胖和2型糖尿病患者的骨骼肌組織中,AMPK活性和PGC-1α表達量明顯降低,而激活AMPK后,PGC-1α的表達量隨之增高,胰島素的敏感性也隨之增高[10]。因此,尋找AMPK的激活劑對慢性病的防治具有重要的意義。mTORC1是AMPK信號通路下游分子之一[11-12],AMPK磷酸化被激活后,可通過抑制mTORC1的磷酸化來抑制心臟肥大,而心臟肥大是肥胖和高脂飲食導致心機重構的重要特征之一[13]。反之,激活的mTORC1可通過S6K1激活SREBP1,從而加重心肌損傷[14-15]。p70S6K是S6K1的同源異構體,也是mTORC1信號的下游特異性蛋白。由此認為,AMPK磷酸化的抑制、mTORC1及p70S6K磷酸化的增強,可成為脂毒性心肌細胞損傷的機制之一。在本研究中,我們發現高脂刺激心肌細胞24 h后,心肌細胞內p-AMPKα的表達明顯降低,p-mTORC1及p-p70S6K蛋白的表達明顯升高,而白藜蘆醇預處理可以明顯逆轉高脂所致的p-AMPKα蛋白的表達降低及p-mTORC1、p-p70S6K蛋白的表達升高。這些結果表明白藜蘆醇可以調控細胞內AMPK/mTORC1/p70S6K信號通路,保護心肌細胞出現脂毒性損傷。
脂毒性造成的心肌損害增加心肌細胞凋亡,使細胞活性降低,數量減少,最終導致心肌功能障礙。本研究數據顯示,PA刺激H9c2心肌細胞,抗凋亡蛋白Bcl-2的表達降低明顯,而促凋亡蛋白Bax和cleaved caspase-3的表達明顯升高。提示PA可以導致心肌細胞出現明顯的凋亡現象,而白藜蘆醇預處理可以明顯逆轉高脂所致抗凋亡蛋白表達的降低和促凋亡蛋白表達的升高。
綜上所述,心肌細胞給予高脂刺激能夠抑制細胞的增殖,并且會導致細胞內氧化應激水平的增加,調控心肌細胞內AMPK通路,從而促進細胞凋亡。白藜蘆醇可以有效恢復細胞增殖率,降低氧化損傷,最終減少細胞凋亡,起到保護心肌細胞的作用,其分子機制與AMPK/mTORC1/p70S6K信號通路的調控密切相關。