藥品零售企業(yè)新版GSP認(rèn)證缺陷項(xiàng)目分析
(長(zhǎng)春市食品藥品認(rèn)證中心 吉林 長(zhǎng)春 130000)
一、新版GSP概述
《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范》簡(jiǎn)稱GSP,是規(guī)范藥品經(jīng)營(yíng)行為的質(zhì)量管理準(zhǔn)則。國(guó)家食品藥品監(jiān)督管理總局于2016年7月20日在其官網(wǎng)發(fā)布了《國(guó)家食品藥品監(jiān)督管理總局關(guān)于修改〈藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范〉的決定》[1],即新版GSP,并于同年12月對(duì)《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范現(xiàn)場(chǎng)檢查指導(dǎo)原則》進(jìn)行了修訂[2],其中規(guī)定藥品零售企業(yè)檢查項(xiàng)目共176項(xiàng),其中嚴(yán)重缺陷項(xiàng)(**)8項(xiàng),主要缺陷項(xiàng)目(*)53項(xiàng),一般缺陷項(xiàng)115項(xiàng)。
二、GSP認(rèn)證檢查結(jié)論概述
2018年1~12月,長(zhǎng)春地區(qū)市縣級(jí)藥品零售企業(yè)進(jìn)行新版GSP認(rèn)證現(xiàn)場(chǎng)檢查共計(jì)503家,檢查結(jié)論為通過企業(yè)440家,結(jié)論為限期整改企業(yè)56家,結(jié)論不通過企業(yè)7家。詳情見表1。
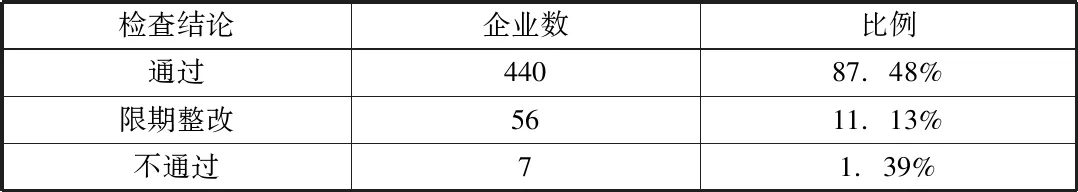
表1 現(xiàn)場(chǎng)檢查結(jié)論統(tǒng)計(jì)
三、GSP認(rèn)證現(xiàn)場(chǎng)檢查缺陷項(xiàng)目概況
(一)GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目
GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目匯總見表2;GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目分析見表3。

表2 GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目匯總
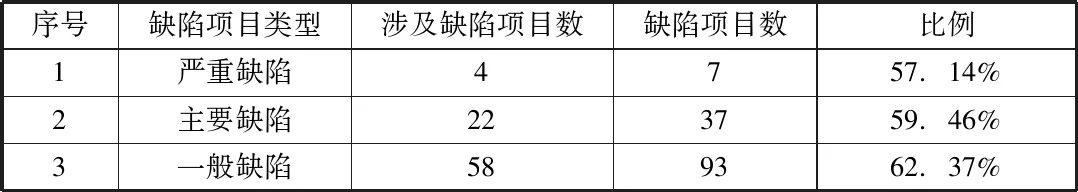
表3 GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目分析
由表2和表3可知,GSP認(rèn)證現(xiàn)場(chǎng)檢查涉及的缺陷項(xiàng)目共84項(xiàng),其中嚴(yán)重缺陷項(xiàng)4項(xiàng),主要缺陷項(xiàng)22項(xiàng),一般缺陷項(xiàng)58項(xiàng),以上數(shù)據(jù)說明我市藥品零售企業(yè)基本做到了依規(guī)守法,誠(chéng)信經(jīng)營(yíng)。嚴(yán)重缺陷項(xiàng)、主要缺陷項(xiàng)、一般缺陷項(xiàng)分別占各自缺陷項(xiàng)百分比為57.14%、59.46%、62.37%,說明企業(yè)在實(shí)施GSP過程中,能夠按照GSP標(biāo)準(zhǔn)規(guī)范經(jīng)營(yíng),但是對(duì)GSP條款理解不夠透徹,實(shí)施不夠規(guī)范,落實(shí)不夠細(xì)致;一般缺陷項(xiàng)涉及的項(xiàng)目較多,企業(yè)需在銷售管理、人員管理、陳列與儲(chǔ)存等方面加強(qiáng)細(xì)節(jié)操作。
(二)GSP認(rèn)證現(xiàn)場(chǎng)檢查缺陷項(xiàng)目在不同檢查內(nèi)容分布情況
長(zhǎng)春地區(qū)市縣級(jí)藥品零售企業(yè)GSP認(rèn)證現(xiàn)場(chǎng)檢查缺陷項(xiàng)目在不同檢查內(nèi)容的分布情況見表4。
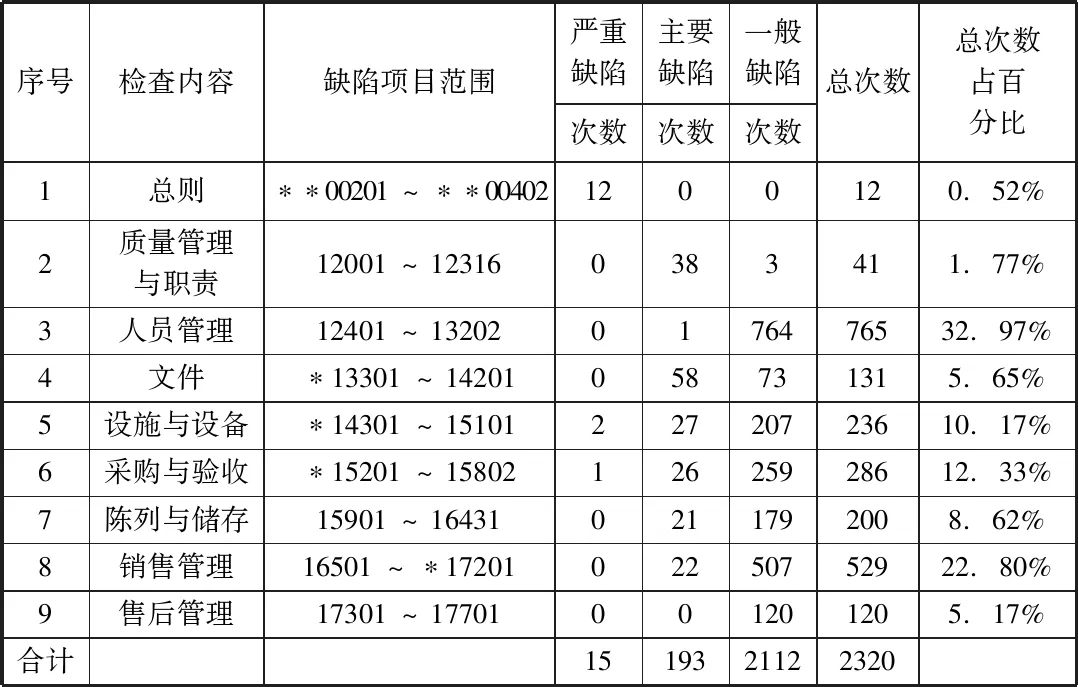
表4 長(zhǎng)春地區(qū)市縣級(jí)藥品零售企業(yè)GSP現(xiàn)場(chǎng)檢查缺陷項(xiàng)目分布情況
由表4可知,企業(yè)在落實(shí)GSP過程中,各項(xiàng)檢查內(nèi)容均存在缺陷項(xiàng)目;其中人員管理和銷售管理涉及比例較大,說明企業(yè)需從人員管理入手,加強(qiáng)銷售方面的管控。
(三)GSP認(rèn)證現(xiàn)場(chǎng)檢查不同類型缺陷項(xiàng)目出現(xiàn)次數(shù)統(tǒng)計(jì)
GSP認(rèn)證現(xiàn)場(chǎng)檢查不同類型缺陷項(xiàng)目出現(xiàn)次數(shù)統(tǒng)計(jì)見表5、表6、表7。
注:表中百分比為缺陷項(xiàng)目出現(xiàn)次數(shù)/嚴(yán)重缺陷項(xiàng)目出現(xiàn)總次數(shù)*100%

表6 主要缺陷項(xiàng)出現(xiàn)次數(shù)
注:表中百分比為缺陷項(xiàng)目出現(xiàn)次數(shù)/主要缺陷項(xiàng)目出現(xiàn)總次數(shù)*100%

表7 一般缺陷項(xiàng)出現(xiàn)次數(shù)
注:表中百分比為缺陷項(xiàng)目出現(xiàn)次數(shù)/一般缺陷項(xiàng)目出現(xiàn)總次數(shù)*100%
由表5可知,嚴(yán)重缺陷項(xiàng)目共計(jì)出現(xiàn)15次,其中**00201(6次)、**12101(6次)出現(xiàn)次數(shù)較多,分別占比40%,具體表現(xiàn)為:藥品信息未錄入計(jì)算機(jī)系統(tǒng),無相關(guān)采購(gòu)、驗(yàn)收記錄,無法提供相關(guān)溫濕度記錄,不能實(shí)現(xiàn)藥品可追溯;無質(zhì)量管理文件或質(zhì)量管理文件與實(shí)際不符,未按規(guī)定設(shè)置計(jì)算機(jī)系統(tǒng),建立的計(jì)算機(jī)系統(tǒng)不能實(shí)時(shí)控制并記錄藥品經(jīng)營(yíng)各環(huán)節(jié)和質(zhì)量管控。同時(shí)也存在采購(gòu)藥品未向供貨單位索取發(fā)票,經(jīng)營(yíng)冷藏藥品無冷藏設(shè)備等問題。2018年不通過檢查企業(yè)共7家,占比1.39%,說明仍有個(gè)別企業(yè)無法正確理解和實(shí)施GSP規(guī)范,在藥品質(zhì)量控制上實(shí)施不夠細(xì)致,流通監(jiān)管人員需加強(qiáng)對(duì)此類企業(yè)的引導(dǎo)和監(jiān)管,確保藥品質(zhì)量安全。
由表6可知,主要缺陷項(xiàng)共計(jì)出現(xiàn)193次,其中出現(xiàn)次數(shù)較多的缺陷項(xiàng)目為:*14601(26次)、*15207(23次)、*13901(19次)、*12701(18次)、*13401(17次)、*12502(16次)、*16801(16次),具體表現(xiàn)為:企業(yè)建立的計(jì)算機(jī)系統(tǒng)不滿足藥品追溯的要求、不能自動(dòng)識(shí)別處方藥,未留存符合要求的供貨單位人員的相關(guān)資質(zhì),相關(guān)記錄不完整,人員培訓(xùn)不到位,處方審核不規(guī)范,銷售憑證不符合要求等問題;同時(shí)還存在藥品擺放不規(guī)范、制度文件不健全等問題。這些問題說明了,個(gè)別企業(yè)在GSP規(guī)范的理解上存在偏差,對(duì)GSP規(guī)范的落實(shí)、人員的管理、銷售的管理存在疏忽、大意的狀況;流通監(jiān)管人員需加強(qiáng)藥品知識(shí)的宣傳力度,增加GSP規(guī)范等相關(guān)內(nèi)容的培訓(xùn)講座。
由表7可知,一般缺陷項(xiàng)目共計(jì)出現(xiàn)2112次,其中出現(xiàn)次數(shù)較多的缺陷項(xiàng)目為:16601(276次)、13101(245次)、12802(199次)、15405(130次)、12401(99次)、17401(97次)、14506(96次),具體表現(xiàn)為:營(yíng)業(yè)人員佩戴的工作牌不規(guī)范,人員健康檔案不完整,從事驗(yàn)收、養(yǎng)護(hù)人員未做辨色力檢查,培訓(xùn)檔案不完整,驗(yàn)收人員未在驗(yàn)收記錄上簽署姓名和驗(yàn)收日期,不簽訂勞動(dòng)合同,未公布藥品監(jiān)督管理部門的監(jiān)督電話,配備的藥品拆零調(diào)配工具不完整等問題。一般缺陷項(xiàng)目出現(xiàn)次數(shù)較多,說明藥品經(jīng)營(yíng)企業(yè)普遍存在疏忽大意、細(xì)節(jié)不到位、追求整體而忽略細(xì)節(jié)等現(xiàn)象。藥品經(jīng)營(yíng)企業(yè)應(yīng)端正經(jīng)營(yíng)態(tài)度、樹立經(jīng)營(yíng)理念、完善長(zhǎng)遠(yuǎn)計(jì)劃、樹立品牌形象、加強(qiáng)企業(yè)管理。
四、小結(jié)
正確理解和實(shí)施《藥品經(jīng)營(yíng)質(zhì)量管理規(guī)范》是藥品經(jīng)營(yíng)企業(yè)規(guī)范藥品經(jīng)營(yíng)行為的基礎(chǔ)。通過對(duì)長(zhǎng)春地區(qū)2018年1-12月認(rèn)證的503家市縣級(jí)藥品零售企業(yè)缺陷項(xiàng)目的分析,可以看出,我市藥品經(jīng)營(yíng)企業(yè)基本能夠做到依法依規(guī)經(jīng)營(yíng),積極努力的實(shí)施GSP,但仍存在細(xì)節(jié)方面的問題,提示流通監(jiān)管人員加強(qiáng)宣傳、加強(qiáng)監(jiān)管,保障藥品流通正常運(yùn)轉(zhuǎn)。

