地塞米松影響大鼠成骨細胞脂質分化相關基因表達的實驗觀察*
宋麗君,劉 軍,魏 波,郭偉雄,胡資兵,向 昊,孫 欣,彭智恒,孫杰聰,文琳釗
(廣東醫科大學附屬醫院:1.生殖醫學中心;2.骨科,廣東湛江 524001)
糖皮質激素(glucocorticoids,GC)被廣泛應用于自身免疫性疾病、炎癥性疾病的治療,遺憾的是伴隨激素的應用產生了各種各樣的不良反應。骨壞死是其中一種嚴重的并發癥[1-2]。長期應用GC可能導致高脂血癥,血清三酰甘油、膽固醇升高,同時它也可誘發骨髓脂肪細胞肥大、增生。大量臨床與實驗研究表明GC誘發的脂質代謝紊亂存在于骨壞死的病理過程中[3-5]。成骨細胞是GC作用的靶組織之一,是維持骨質平衡與代謝穩定的主要結構。適宜的GC水平在骨的發育與維持中起著相當重要的作用。靶組織中細胞內GC的濃度不僅依賴細胞外激素水平,同時也依賴于激素的局部代謝。GC的生物學活性受到11β-羥脫氫酶(11β-HSD)的調節,能夠催化無活性皮質酮與活性皮質醇相互轉換[6]。成骨細胞能夠活化非活性形式的GC,通過11β-HSD1 來調節激素的水平維持良好的內環境。甘珀酸能夠抑制11β-HSD1的轉換活性。
本文觀察在應用活性抑制劑甘珀酸前后,地塞米松(Dex)作用于成骨細胞后,對成骨細胞的成脂與成骨分化的標志性基因及成骨細胞標志基因PPARγ、C/EBPα、runx2、Col.1、OPG的表達,初步分析地塞米松對誘發細胞內脂質積聚與基因表達異常之間的關系。
1 材料與方法
1.1實驗動物與試劑 4月齡SD大鼠由廣東醫學院動物研究中心提供。胰蛋白酶、aMEM、膠原酶(GIBCO)、小牛血清(Biological industries)、堿性磷酸酶試染色劑盒、堿性磷酸酶活性試劑盒(Sigma), RT-PCR kit,RNA-Plus,PCR 熒光試劑(Gibco),甘珀酸(CBX,Sigma)。
1.2成骨細胞培養鑒定 拉頸脫臼處死SD大鼠,取出顱骨,去掉附著的軟組織,PBS液洗凈后,在aMEM培養基中剪成約1 mm3大小骨塊,以1 cm2密度種植于培養瓶內,反轉培養瓶,加入3 mL含有20%胎牛血清的aMEM培養液,培養瓶置于細胞培養箱中2 h,待骨植塊稍干涸粘于瓶底,然后翻轉培養瓶,使組織塊浸沒于培養基中,待細胞長滿后傳代(約12 d),用相差貼壁法純化成骨細胞。堿性磷酸酶染色鑒定:在成骨細胞長滿蓋玻片后,用4 ℃ 10%甲醛固定,蒸餾水沖洗,將ALP孵育液直接滴加到蓋玻片上,室溫下孵育30 min,在相差顯微鏡下觀察。
1.3實驗分組 成骨細胞接種于6孔培養板中,按照所用地塞米松濃度分為7個實驗組:空白對照組(加生理鹽水),A組(Dex 1×10-8mol/L),B組(Dex 1×10-7mol/L),C組(Dex 1×10-6mol/L),D組(Dex 1×10-8mol/L+CBX),E組(Dex 1×10-7mol/L+CBX),F組(Dex 1×10-6mol/L+CBX),CBX劑量為8×10-7mol/L,所有組作用6 h。
1.4總RNA 提取及Real-time PCR分析 總mRNA提取:按照RNA-Plus試劑盒(Gibco)說明從成骨細胞提取總RNA。所得沉淀溶解于DEPC溶液,取2 μL稀釋至100 μL,紫外分光光度計測定RNA含量及OD值。剩余部分存放于-80 ℃以備逆轉錄。
逆轉錄:取細胞RNA樣本,根據上述mRNA的含量計算1 μg mRNA所需的適量RNA體積,加入:5×g DNA Eraser Buffer 2 μL+gDNA Eraser 1 μL+適量DEPC水構成10 μL體系,室溫下放置5 min,將上述反應液10 μL加入:5×PrimeScript Buffer 4 μL+ PrimeScript?Enzyme 1 μL+RT Primer Mix 1 μL+DEPC水4 μL直至20 μL,反應條件為:37 ℃ 15 min,85 ℃ 5 s,4 ℃下保存。最終得到的cDNA放置于-20 ℃冰箱中保存以備下一步PCR反應過程。
Real-time PCR:應用LightCycler?480PCR反應系統檢測11β-HSD1,PPAR,C/EBPα,RUX2,C/EBP)α mRNA表達。β-actin作為內參引物。反應體系包含10 μL TaqMan通用PCR反應液,2 μL引物,2 μL TaqMan探針及2 μL cDNA。 反應條件為:95 ℃預變性5 min;95 ℃變性15 s,60 ℃退火15 s,72 ℃延伸32 s,共40個循環。按照試劑盒說明根據測得Ct值計算出≥Ct值,△Ct目的基因Ct-內參Ct;△△Ct待測樣品中目的基因△Ct-參照樣品中目的基因△Ct;相對表達量=-△△Ct。引物:11-HSD1,正向:5′-CTCAGCTATGTGGTCCTGAGC-3′,反向: 5′-AATGGTGGAAAAGAACCCATC-3′;C/EBPα,正向:5′-GTCGGTGGATAAGAACAGCAAC-3′,反向:5′-CTGGTCAA CTCCAACACCTTCT-3′;PPARr,正向:5′-GT GGCTGCTATAATTTGCTGTG-3′,反向:5′-GGAGTT TTGGGAAGAGAAAGGT-3′;runx2,正向:5′-CCATAACGG TCTTCACAAATCC-3′,反向:5′-GCGGGACACCTACTCTCATACT-3′;β-Actin,正向:5′-CACCCGCGAGTACAACCTTC -3′,反向:5′-CCCATACCCACCATCACACC -3′。
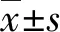
2 結 果
2.1成骨細胞分離培養鑒定 見圖1。

A:第二代成骨細胞(×40);B:細胞堿性磷酸酶染色陽性
圖1成骨細胞分離鑒定
2.2成骨細胞內脂質沉積 油紅O染色顯示,地塞米松(1×10-7mol/L)作用后成骨細胞細胞質內出現散在紅染的均勻顆粒,細胞質內有脂質形成與積聚。見圖2。

A:(×40);B:(×200)
圖2激素作用后成骨細胞油紅染色

表1 分離RNAs濃度及OD值
2.3mRNAs分析 所分離獲得的RNAOD值為1.7~2.0,表明RNA含量穩定,可以用于下一步RNA分析(表1)。RT-PCR分析,當地塞米松由低濃度向高濃度作用時,PPARγ,C/EBPα RNA表達上升, runx2表達下降,成骨細胞的標志物OPG與Ⅰ型膠原表達無明顯改變;應用11β-HSD1酶活性抑制劑CBX不能改變這種趨勢(圖3)。


PPARγ,C/EBPα RNA表達在應用地塞米松后上升,A、B、C組間差異有統計學意義(P<0.05);應用甘珀酸后表達仍呈上升趨勢,高低深度間仍存在統計學差異(P<0.05),runx2表達下降。成骨性標志基因表達變化各組間不顯著,OPG在激素組呈略下降趨勢,組間差異無統計學意義(P>0.05)。
3 討 論
骨壞死是伴隨糖皮質激素應用的一種嚴重并發癥。迄今為止對于它們之間的關系與機制研究已開展了大量研究工作。JONES等[7]研究認為過量的糖皮質激素可能誘發脂肪肝,引起脂肪栓塞阻塞骨的血管,并最終導致骨壞死。大量的臨床與基礎研究表明脂質代謝紊亂存在于股骨頭壞死的病理過程中[8]。KAWAI等[4]認為發生于股骨頭缺壞死的缺血性改變可能是非直接或者是繼發的改變,而不是一種原發的原因。接受激素治療的動物表現出軟骨下骨區域骨細胞的脂肪壞死,以及與骨細胞脂肪沉積相平行的漸進性的骨細胞變性。骨細胞脂肪變是骨壞死病理過程中脂質代謝紊亂的一項重要機制。脂質沉積可能發生在激素治療后的股骨頭的各系細胞。隨激素應用時間延長,脂質沉積逐漸增加,并且融合成脂滴。細胞核受壓、邊集,細胞器功能受到干擾,最終導致細胞壞死[4,9]。這提示骨細胞的脂肪變性是股骨頭壞死的一項重要病理改變,是否這一改變的原因是由于成骨細胞發生了轉分化(表型改變)?目前報道較少。成骨細胞表達堿性磷酸酶,OPG,Ⅰ型膠原是成熟成骨細胞的標志。本研究中作者發現當應用大劑量的糖皮質激素時,成骨細胞出現脂質積聚改變,成脂肪標志基因PPARγ、C/EBPα表達顯著升高,而成骨性標志基因runx2表現下降,這提示在皮質激素誘發的成骨細胞脂質變可能是由于細胞本身發生了表型異常所致。
11β-HSD1是一種NADPH依賴性酶主要起還原酶活性,在人轉換非活性皮質酮為有活性的皮質醇,在嚙齒類動物則轉換11去氫皮質酮為皮質酮,從而擴大了激素的作用。有研究認為地塞米松不能被11β-HSD1轉換,僅僅上調其表達[10-11]。本文發現成骨細胞受地塞米松作用后,出現明顯細胞內脂質小滴形成。說明糖皮質激素能夠明顯誘導成骨細胞內的脂質積聚過程。而地塞米松能夠誘導成骨細胞表達成脂分化基因,表現為PPARγ,C/EBPα隨激素濃度遞增上升,應用皮質激素活性抑制劑甘珀酸后這種表達增高的趨勢未被抑制,而影響成骨分化基因runx2則有下降趨勢。兩種情況下成骨細胞Ⅰ型膠原與OPG表達未見顯著變化。由此提示地塞米松可能如文獻所述不需經過11β-HSD1酶的活性轉換,而直接進入細胞起作用。再者地塞米松抑制了該酶的表達,導致內源性皮質激素轉換下降,不能有效促進成骨,表現為膠原與OPG表達無上升改變。PPARγ是維持脂質穩定的重要核受體家族成員。體外研究提示潑尼松能夠打破SD大鼠runx2與PPARγ之間的平衡,破壞成骨與成脂的內在穩定,從而削弱成骨能力[9-10]。因此作者認為糖皮質激素作用下成骨細胞內的脂質積聚可能是由于誘導了成脂分化性基因表達的結果,但這種脂質調節異常的結果是否直接影響到了成骨細胞的功能與機制,還有待于更深入的研究以獲取充分證據。
當SD大鼠顱骨成骨細胞在體外受到人工合成的糖皮質激素作用時,表現為細胞內脂滴形成,成脂分化性基因表達增加,成骨相關基因表達下降,酶活性抑制劑不能有效影響這一趨勢,提示過量的人工合成皮質激素可能通過改變了成脂分化性基因的表達而使細胞表型發生了改變,抑制了成骨性能,從而成為激素誘發的骨壞死的原因之一,但仍需更深入的研究來闡明詳細機制。

