油酸微生物計數(shù)方法適用性試驗研究
劉娜,潘雯,張紅霞
(1. 西寧聯(lián)勤保障中心藥品儀器監(jiān)督檢驗站,甘肅 蘭州 730000;2. 廣州市藥品檢驗所,廣東 廣州 510000)
油酸是一種常見的藥用輔料,該品種在現(xiàn)行版美國藥典(USP)、英國藥典(BP)、歐洲藥典(EP)輔料中都有收載,但無微生物限度檢查項,在中國藥典(CHP)及日本藥典(JP)中均未收載該品種;USP、EP、CHP中僅規(guī)定藥用輔料限度為需氧菌總數(shù)不得過103CFU/g,霉菌和酵母菌總數(shù)不得過102CFU/g。本文通過試驗,首次確定了油酸的微生物限度檢查方法,該方法操作簡便,結果可靠。
1 儀器與試藥
1.1 樣品
油酸原料藥:生產(chǎn)企業(yè):德國Lipoid Gmgh公司;批號:520200-2150681;520200-2150682;520200-2150683
1.2 試驗環(huán)境
在C級受控潔凈環(huán)境,局部A級單向流空氣的無菌室內進行。陽性菌操作在符合國家Ⅱ級生物安全標準的生物安全柜內進行。
1.3 適用性試驗用菌種
金黃色葡萄球菌(Staphylococcus aureus) [CMCC(B)26003] 、銅綠假單胞菌(Pseudomonas aeruginosa)[CMCC(B)10104] 、大腸埃希菌(Escherichia coli)[CMCC(B)44102] 、枯草芽孢桿菌(Bacillus subtilis)[CMCC(B)63501] 、白色念珠菌(Candida albicans)[CMCC(F)98001] 、黑曲霉(Aspergillus niger)[CMCC(F)98003] 的冷凍干燥第0代菌種,由中國食品藥品檢定研究院提供,經(jīng)本實驗室菌種復蘇和確認,實驗中使用第三代培養(yǎng)物。
1.4 稀釋液
pH7.0無菌氯化鈉-蛋白胨緩沖液(批號:151103),由北京三藥科技開發(fā)公司提供。
1.5 儀器
HVE-50型高壓滅菌器(日本HIRAYAMA);PL602-L型電子天平(梅特勒-托利多儀器上海有限公司);HVE-50BSC-1360A2 型生物安全柜(北京東聯(lián)哈爾儀器制造有限公司);SLI-1200型恒溫培養(yǎng)箱(上海愛朗儀器有限公司);MJPS-250型霉菌培養(yǎng)箱(上海精宏實驗設備有限公司);JLQ-S1型菌落計數(shù)器(江蘇無錫市電化教具廠);XW-80A型旋渦混合器(上海醫(yī)科大學儀器廠);DK-S型電熱恒溫水浴鍋(上海森信實驗儀器有限公司)。
1.6 培養(yǎng)基與試劑
胰酪大豆胨肉湯培養(yǎng)基(批號:170523),沙氏葡萄糖肉湯培養(yǎng)基(批號:170706),沙氏葡萄糖瓊脂培養(yǎng)基(批號:170613),胰酪大豆胨瓊脂培養(yǎng)基(批號:170627),麥康凱液體培養(yǎng)基(批號:1704242),麥康凱瓊脂(批號:170330),卵磷脂吐溫80醇液(批號:160422)(含0.1%卵磷脂,0.7%吐溫80),聚山梨酯80,均由北京三藥科技開發(fā)公司提供,本實驗室培養(yǎng)基適用性檢查結果證明上述批次的培養(yǎng)基均符合2015年版中國藥典要求。
2 方法
2.1 常規(guī)法
采用常規(guī)法對3批樣品進行3次獨立的平行試驗。
2.2 菌液的制備
分別接種金黃色葡萄球菌、銅綠假單胞菌、大腸埃希菌、枯草芽孢桿菌至胰酪大豆胨肉湯培養(yǎng)基,35℃培養(yǎng)24小時。接種白色念珠菌至沙氏葡萄糖肉湯培養(yǎng)基,25℃培養(yǎng)2~3天,備用。接種黑曲霉至沙氏葡萄糖瓊脂斜面培養(yǎng)基,25℃培養(yǎng)5~7天,洗脫孢子,備用。以上試驗菌用無菌生理鹽水按10倍稀釋使接入菌量不大于100 cfu,備用。
2.2 稀釋劑的選用
經(jīng)試驗考察,最終確定選用含0.1%卵磷脂和0.7%聚山梨酯80的pH 7.0無菌氯化鈉-蛋白胨緩沖液作為稀釋劑。
2.3 需氧菌總數(shù)、霉菌及酵母菌計數(shù)方法適用性試驗
2.3.1 供試液的制備無菌吸取油酸10 mL,加含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0無菌氯化鈉-蛋白胨緩沖液至100 mL,作為1︰10的供試液。
2.3.2 供試品對照組取1:10供試液1 mL,傾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨瓊脂培養(yǎng)基,30℃~35℃,培養(yǎng)3天,沙氏葡萄糖瓊脂培養(yǎng)基,20℃~25℃,培養(yǎng)5天,計數(shù)。
2.3.3 稀釋劑對照組取含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0無菌氯化鈉-蛋白胨緩沖液替代供試液,按試驗組操作加入試驗菌,培養(yǎng),計數(shù)。
2.3.4 試驗組取5支試管各加入1∶10供試液9.9 mL,每管分別加入金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉0.1 mL,從試管中取1 mL,操作方法如2.3.2供試品對照組,傾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨瓊脂培養(yǎng)基,30℃~35℃,培養(yǎng)3天;另取2支試管各加入1∶10的供試液9.9 mL,每管分別加入白色念珠菌、黑曲霉0.1 mL,從試管中取1 mL同上操作,傾注沙氏葡萄糖瓊脂培養(yǎng)基,20℃~25℃,培養(yǎng)5天,計數(shù)。
2.3.5 菌液組取pH7.0無菌氯化鈉-蛋白胨緩沖液替代供試液,按試驗組操作加入試驗菌,培養(yǎng),計數(shù)。(注:所加菌液的體積不超過供試液體積的1%。)
2.3.6 回收率計算公式

2.3.7 實驗結果
供試品制備成含0.1%卵磷脂和0.7%聚山梨酯80的1︰10供試液,采用常規(guī)法對金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白色念珠菌、黑曲霉進行試驗,在含0.1%卵磷脂和0.7%聚山梨酯80的TSA平板上的比值均在0.5~2范圍內;對白色念珠菌、黑曲霉進行試驗,在SDA平板上的比值均在0.5~2范圍內。見表1和表2。
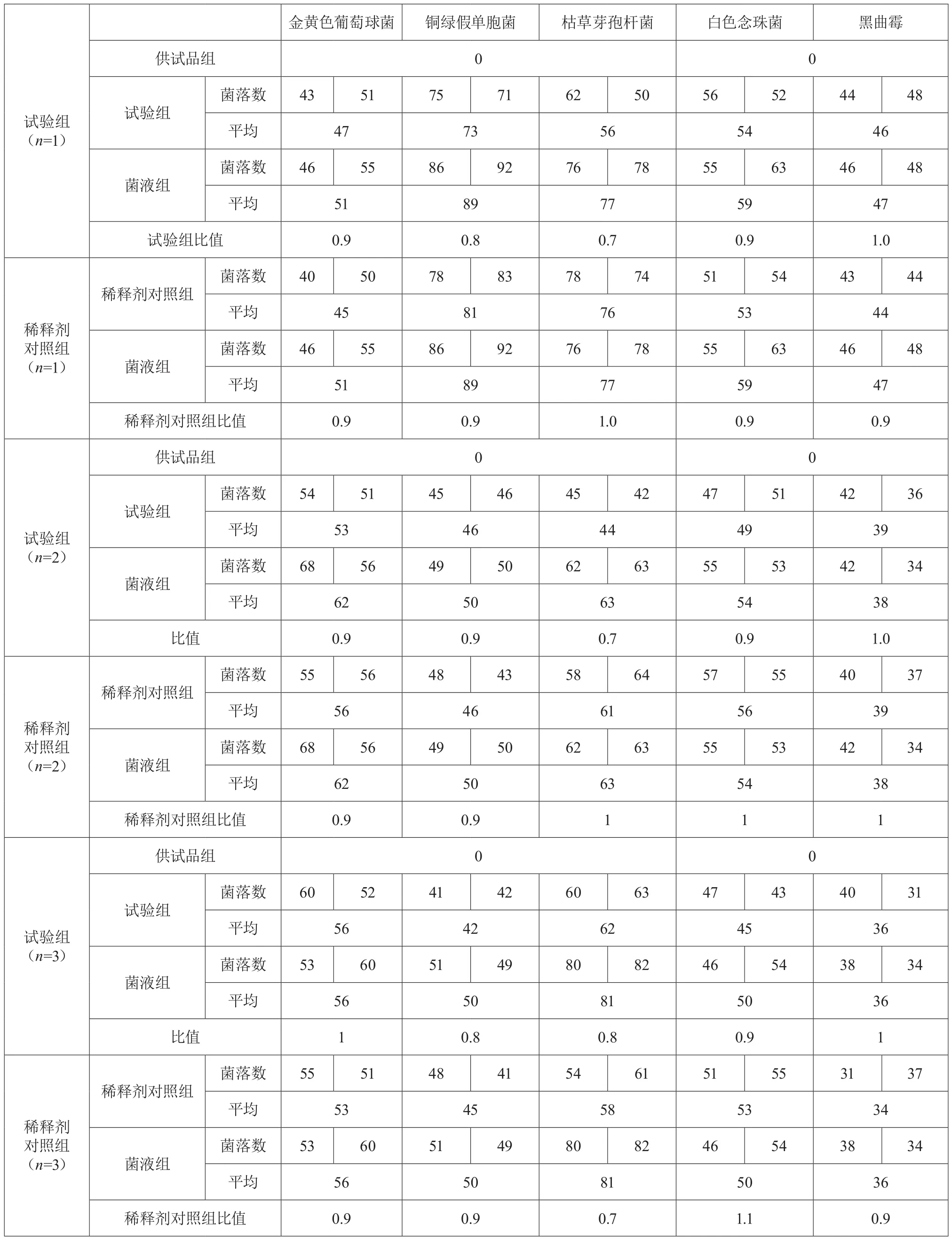
表1 需氧菌總數(shù)計數(shù)法適用性試驗結果
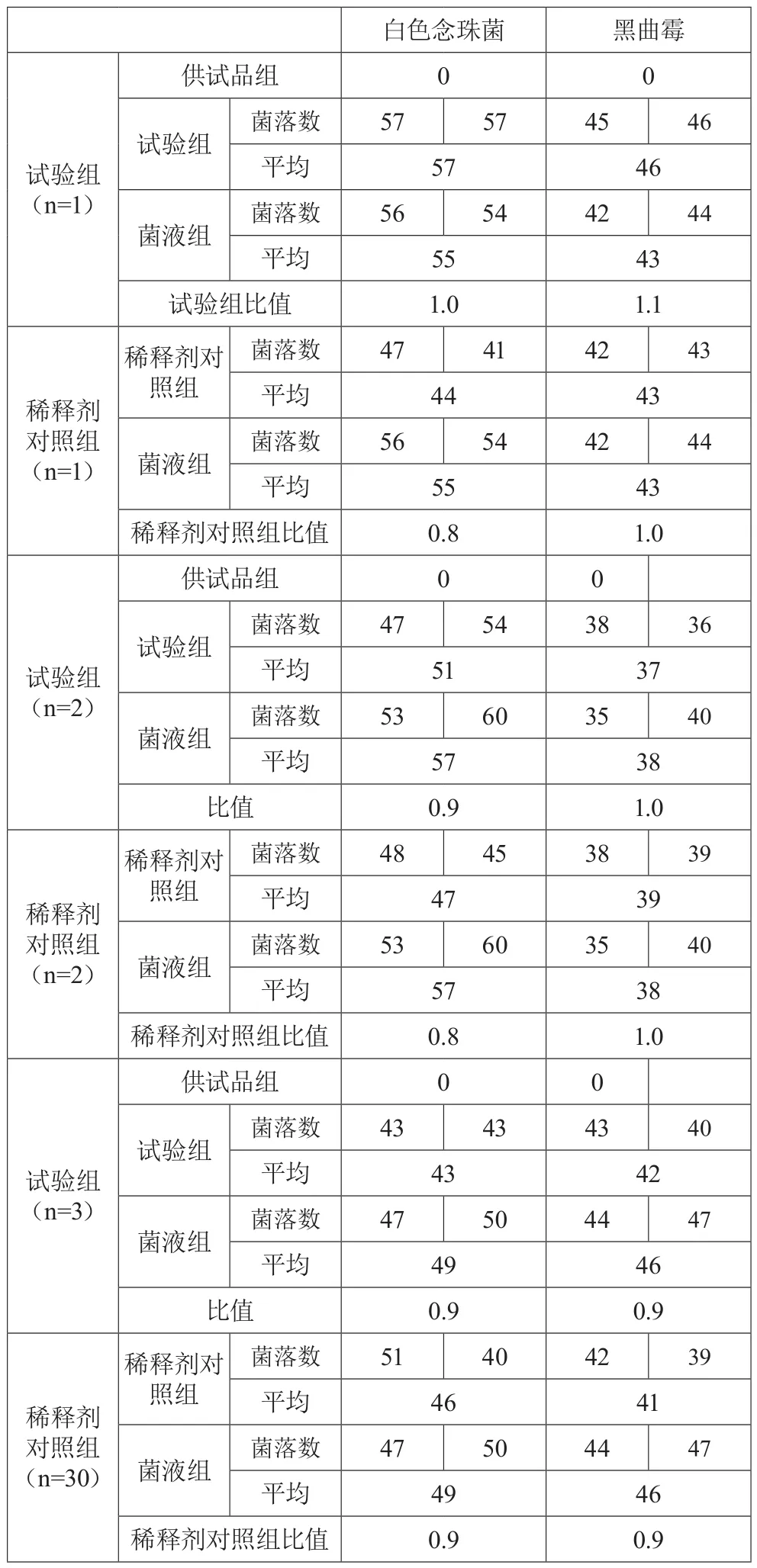
表2 霉菌和酵母菌總數(shù)計數(shù)方法適用性試驗結果
2.4 控制菌檢查方法驗證
大腸埃希菌檢查采用常規(guī)法,按照《中國藥典》2015年版四部[1]大腸埃希菌檢查方法檢查。結果表明,供試品的大腸埃希菌檢查可采用常規(guī)法檢驗。見表3。

表3 控制菌檢查方法驗證結果
3 討論
2015年版中國藥典的施行,微生物限度檢查方法在操作和培養(yǎng)基都有了非常大的改變,針對具體品種的特點,需要通過培養(yǎng)基適用性試驗來確定檢驗方法的可行性。
本文分別采用常規(guī)法、薄膜過濾法、培養(yǎng)基稀釋法進行試驗,結果表明薄膜過濾法回收率和培養(yǎng)基稀釋法回收率都不符合規(guī)定要求;并且樣品黏稠,具有吸附性,薄膜過濾法試驗操作難度大。常規(guī)法分別考察了①稀釋液加20 mL十四烷酸異丙酯,萃取取下層;②稀釋液加2%卵磷脂醇液;③TSA瓊脂加1%卵磷脂醇液。這三種方法均不符合回收率要求。最終確定取本品10 g,加含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0無菌氯化鈉-蛋白胨緩沖液至100 mL,制成1︰10的供試液,按平皿法,傾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨瓊脂,依法檢查(《中國藥典》2015年版四部通則<1105>與<1106>)。
該品種在現(xiàn)行版USP、BP、EP中有收載,但無微生物限度檢查項,在CHP及JP中均未收載;USP、EP、CHP中藥用輔料限度為:需氧菌總數(shù)不得過103CFU/g,霉菌和酵母菌總數(shù)不得過102CFU/g,結合進口藥品標準和企業(yè)標準,最終確定限度為每1 g供試品中需氧菌總數(shù)不得過100 cfu,霉菌和酵母菌總數(shù)不得過20 cfu,每1 g不得檢出大腸埃希菌[2-4]。該方法操作簡便,試驗菌回收率均在0.5~2.0范圍內,控制菌均能檢出,方法可行。

