玉米葉綠素含量的全基因組關聯分析
史大坤,姚天蘢,劉楠楠,鄧敏,段海洋,王路林,萬炯,高炯浩,謝惠玲,湯繼華,張雪海
?
玉米葉綠素含量的全基因組關聯分析
史大坤1,姚天蘢1,劉楠楠2,鄧敏3,段海洋1,王路林1,萬炯1,高炯浩1,謝惠玲1,湯繼華1,張雪海1
(1河南農業大學農學院/省部共建小麥玉米作物學國家重點實驗室,鄭州 450002;2福建農林大學海峽聯合研究院,福州 350002;3湖南農業大學農學院/湖南省玉米工程技術研究中心,長沙 410128)
【】葉綠素含量與作物產量呈正相關。通過提高葉綠素含量來提高作物產量是作物育種的方向之一。因此,利用全基因組關聯分析(genome-wide association study, GWAS)解析玉米葉綠素含量的遺傳基礎,可為玉米高光效理想株型設計育種提供理論指導。以538份玉米自交系構成的關聯群體為研究對象,在5個環境下,通過對其授粉后5 d的棒三葉(穗位葉、穗上葉、穗下葉)葉綠素含量進行測定,并借助覆蓋玉米全基因組的558 629個單核苷酸多態性標記(SNPs),利用3種模型(Q、K和Q+K)對葉綠素含量進行全基因組關聯分析,隨后選擇最優模型的GWAS結果并結合eQTL(expression quantitative trait loci)分析對葉綠素含量的自然變異進行解析。5個環境下,棒三葉葉綠素含量均遵從正態分布且葉綠素含量間呈正相關;方差分析表明棒三葉葉綠素含量的環境效應、基因型效應、基因型與環境互作效應均達到了極顯著水平;此外,穗上葉、穗位葉和穗下葉葉綠素含量的遺傳力分別為0.66、0.66和0.67。比較3種模型發現K模型對假陽性(I型錯誤)控制最好,在此模型下共檢測到29個與棒三葉葉綠素含量顯著關聯的SNP(≤3.99×10-6),涉及到18個位點,共有76個候選基因落在這18個位點內,其中85.5%(65/76)的候選基因具有eQTL,11.8%(9/76)的候選基因與對應表型顯著相關(<0.05),說明這9個基因可能是通過表達量變化來調控表型變異。在這76個基因中,60個候選基因有功能注釋,功能涉及到能量代謝、物質輸送代謝途徑和生物合成調節等過程。此外還發現2個可以在不同環境或不同葉片共定位的位點,其中,共定位位點內的基因編碼一種與AAE3高度相似的酰基活化酶,該基因通過提高α-酮戊二酸(ALA)和草酰乙酸含量進而影響氨基酸生物合成,提高籽粒賴氨酸含量,改善玉米品質。此外,ALA的合成會促使葉綠素含量升高,進而提高作物產量,推測該基因為最可能的候選基因。K模型對假陽性的控制效果最好,基于K模型,共檢測到18個玉米葉綠素含量顯著關聯位點,發現多個參與葉綠素合成途徑相關基因。
玉米;葉綠素含量;全基因組關聯分析;高光合效率
0 引言
【研究意義】植物干物質的90%—95%通過光合作用產生,作物產量主要來源于葉片的光合產物[1]。而葉綠素含量是決定作物光合效率和生物量或產量的重要因素[2],也是高光效育種的重要育種目標之一。因此,對玉米葉綠素含量的遺傳基礎進行解析可為玉米高光效理想株型的設計育種提供理論支持。【前人研究進展】葉綠素是植物葉片的主要光合色素,也是植物光合作用的物質基礎,已成為研究玉米生長特性及生理變化的重要指標[2]。孫紅等[3]通過研究玉米生長期冠層反射光譜與葉綠素含量的關系,表明玉米拔節期和灌漿期冠層反射光譜與葉綠素含量呈正相關,從而認為葉綠素對玉米的生長至關重要。左寶玉等[4]研究表明玉米葉片的葉綠素含量為多基因控制的數量性狀。文自翔等[5]通過親本雜交建立的遺傳群體結合連鎖分析表明,QTL(quantitative trait locus)定位的準確性由親本之間的遺傳差異所決定,還發現一些位點在特定雙親間沒有發生分離和重組,認為使用基于連鎖分析的QTL定位存在一定的局限性。近年來,以連鎖不平衡為基礎的全基因組關聯分析已被證明是一種解析復雜農藝性狀遺傳基礎的強大工具[6-8]。隨著測序技術發展、測序成本降低及統計模型改善,全基因組關聯分析在作物QTL鑒定中被廣泛應用[10]。Atwell等[11]用約200份擬南芥材料,結合216 130個SNPs標記,對其開花期、抗病及發育相關的107個表型進行GWAS,鑒定到大量主效位點,其中一些位點內含已知基因,說明GWAS對植物復雜性狀遺傳基礎的解析是可行的。Thornsberry等[12]首次將關聯分析用于玉米開花期研究,成功發掘到并驗證其功能。而在玉米中,較早的GWAS則是對553份自交系成熟籽粒脂肪酸含量的分析[13]。在水稻和擬南芥中,部分葉綠素含量相關的基因已被克隆,WANG等[14]通過對水稻劍葉期的劍葉SPAD(soil and plant analyzer development)值、葉綠素a、葉綠素b進行測定,并結合高密度標記對不同亞型的水稻群體進行GWAS,檢測到多個葉綠素相關性狀顯著位點,并發現已知基因也影響葉綠素含量;擬南芥編碼二乙烯基葉綠素酯還原酶,該酶是二乙烯脫植基葉綠素a形成的關鍵酶,該基因突變會導致擬南芥葉片變黃[15]。在擬南芥發育初期,葉綠素合酶基因的突變體使葉片呈黃綠色,植株生長緩慢,野生型的綠色程度顯著高于該突變體[16]。【本研究切入點】在玉米中,葉綠素含量QTL鮮有報道,且對其自然變異遺傳基礎的了解較少。玉米具有豐富的遺傳多樣性及快速的連鎖不平衡衰減等特性,是進行全基因組關聯分析的理想材料[17]。玉米不同葉位葉片的葉綠素含量決定各葉位葉光合強度,進而導致各葉位葉對籽粒產量貢獻不同,而棒三葉(穗位葉及穗位葉的上下兩片葉)作為有效光合層,對玉米籽粒產量貢獻最大[18]。因此,通過全基因組關聯分析對玉米棒三葉葉綠素含量的遺傳結構進行解析,為快速獲取葉綠素含量相關的標記及候選基因尤為重要,同時也可為高光合效率玉米品種的改良提供理論支持。【擬解決的關鍵問題】本研究以538份玉米自交系構成的關聯群體為研究對象,通過對其棒三葉葉綠素含量進行測定,并結合高密度SNP標記,用3種不同的統計模型(Q、K、Q+K)對葉綠素含量進行GWAS分析,隨后結合最優模型的GWAS結果及eQTL分析,探索玉米葉綠素含量的遺傳基礎,為玉米高光效的理想株型設計育種提供理論基礎。
1 材料與方法
1.1 試驗材料與田間種植
所用關聯群體為華中農業大學嚴建兵教授提供,由538份玉米自交系構成。該群體于2012年夏季種植于河南鶴壁(12年鶴壁)鶴壁農業科學院浚縣試驗站(浚縣,北緯N35°41′51.37″,東經E114°18′22.96″),2017年冬季種植于海南三亞(17年三亞)河南農業大學南繁基地(三亞,北緯N18°22′55.49″,東經E108°58′32.47″),2018年春季種植于湖南長沙(18年長沙)湖南農業大學試驗基地(長沙,北緯N28°12′40.27″,東經E113°16′59.29″),2018年夏季種植于河南原陽(18年原陽)國家2011計劃河南農業大學現代農業科技園區(原陽,北緯N35°03′58.63″,東經E113°56′2.78″)及河南永城(18年永城)棉花原種場(永城,北緯N33°52′53.11″,東經E116°27′11.51″)。采用單行區種植,單次重復,行長3 m,株距0.25 m,行距0.65 m,種植密度約63 000株/hm2。
1.2 葉綠素含量測定
為了準確測定玉米棒三葉的葉綠素含量,于授粉后5 d,使用手持SPAD儀(型號:SPAD-502 plus)對關聯群體棒三葉(穗上葉(above the uppermost ear leaf)、穗位葉(uppermost ear leaf)、穗下葉(below the uppermost ear leaf))的SPAD值(葉綠素相對含量)進行測定。每行測定5株,對于每一株的棒三葉,選擇每片葉的中間三分之一位置進行測定,重復3次(誤差小于5%),3次測量均值作為該片葉的葉綠素含量;5株對應葉片的SPAD值的均值作為該自交系棒三葉對應葉片的葉綠素含量并用于后續的表型一般統計分析和全基因組關聯分析。
1.3 數據處理與分析
利用Excel 2016對每個環境每個基因型棒三葉葉綠素含量的異常值進行剔除,并獲得平均值。利用R語言的corrplot函數對不同環境下葉綠素含量進行相關性分析[19]。利用Excel 2016對5個環境下棒三葉葉綠素含量進行無重復雙因素方差分析。利用R語言的lme4包[20]的混合線性模型[Y=(1|LINE)+(1|ENV)+ (1|LINE:ENV)]計算5個環境下每一個材料每一性狀的最佳線性無偏預測(best linear unbiased prediction,Blup)值,基因型為隨機因子,環境為固定因子,公式中,Y為性狀數據,括號表示隨機效應,“1|”表示分組,“:”表示互作,LINE表示所有材料,ENV表示環境。Blup值可減少不平衡數據造成的預測偏差,最終也用于一般統計分析及全基因組關聯分析。廣義遺傳力的計算采用混合線性模型將基因型和環境作為隨機效應,得到2和2的估計值。利用公式2=2/(2+2/)計算每個部位的葉綠素含量的遺傳力,其中,2為遺傳方差,2為協方差,為環境數[21]。
1.3.1 全基因組關聯分析 所用基因型為Yang等[22]推算得到的覆蓋玉米全基因組且最小等位基因頻率≥0.05的558 629個SNP。考慮到很多標記間可能存在高度的連鎖不平衡,利用GEC軟件[23]計算該套標記的有效標記數(effective number,En),并以該有效標記數En作為判斷性狀-標記顯著的依據(≤1/En)。統計學功效(即檢測到真實顯著關聯的能力)是進行全基因組關聯分析的首要考慮因素。因此,在Tassel 3.0軟件[24]中使用3種模型,即只控制親緣關系的K模型、只控制群體結構的Q模型、同時控制群體結構和親緣關系的Q+K模型對關聯群體棒三葉葉綠素含量分別進行全基因組關聯分析,通過3種模型Quantile-quantile(QQ)圖的比較,選擇最優模型并對其結果進行進一步解析。
前期已有研究用558 629個SNP對該關聯群體的連鎖不平衡(linkage disequilibrium,LD)衰減程度進行評價,結果表明,該群體的LD衰減距離為50 kb(2=0.1)[25]。因此,定義一個顯著SNP標記物理位置的上下游各50 kb的區間范圍為一個位點。基于B73參考基因組(RefGen_v2),從玉米數據庫MaizeGDB(http://www.maizegdb.org)中下載玉米全基因組基因列表并從列表中搜索每個顯著位點內的所有候選基因。根據基因的功能注釋及其在B73參考基因組中的表達部位及表達量,選擇一個最可能的候選基因作為該位點的候選基因。
1.3.2 表達量QTL分析 利用RNA-seq技術深度測序368份關聯群體自交系授粉后15 d的籽粒,每個自交系有50%以上的基因表達且至少有10個reads可用,共獲得了28 850個基因的表達量[26],通過eQTL定位鑒定調控基因表達的位點,方法同表型的全基因組關聯分析。
2 結果
2.1 玉米棒三葉葉綠素含量表型數據分析
通過對該關聯群體葉綠素含量進行分析,發現多個環境的穗位葉葉綠素含量均高于穗上葉和穗下葉。同時發現除鶴壁穗下葉葉綠素含量的偏度值絕對值大于1外,其余環境棒三葉葉綠素含量偏度值的絕對值均小于1(表1),表明不同葉片的葉綠素含量均遵從正態分布,為典型的數量性狀。
2.2 玉米棒三葉葉綠素含量的相關性分析、方差分析及遺傳力
通過對不同環境玉米棒三葉葉綠素含量的相關性分析,發現不同環境的棒三葉(穗上葉、穗位葉、穗下葉)葉綠素含量間均呈正相關(圖1),并且發現各環境下棒三葉葉綠素含量間的相關系數,大多在0.6以上,推測棒三葉葉綠素的生物合成調控存在著相互協同促進作用。
方差分析表明關聯群體棒三葉葉綠素含量的基因型效應、環境效應、基因型與環境互作效應均達極顯著水平(表2),說明棒三葉不同葉片的葉綠素含量存在顯著的遺傳變異,且受環境影響較大;若在環境影響較大的不同環境間檢測到相同的位點或基因,則說明這些位點或基因可以穩定遺傳。此外,穗上葉、穗位葉和穗下葉的葉綠素含量的遺傳力分別為0.66、0.66和0.67。

表1 關聯群體不同環境下玉米棒三葉葉綠素含量的描述統計分析
sd.:STDEVP,標準差,計算基于給定的樣本總體的標準偏差;Ske.:SKEW,偏度,用來體現相對平均值的不對稱程度;Kur.:KURT,峰度,用來體現一組數據的峰值
sd.: STDEVP. Calculate the standard deviation based on the given sample population; Ske.: SKEW. The degree of asymmetry used to represent the relative mean; Kur.: KURT. A peak value used to represent a set of data

a、b、c、d、e、f分別表示2012年鶴壁、2017年三亞、2018年長沙、2018年永城、2018年原陽及Blup等6個環境。字母后面的數字1—3分別代表穗上葉、穗位葉、穗下葉。下同
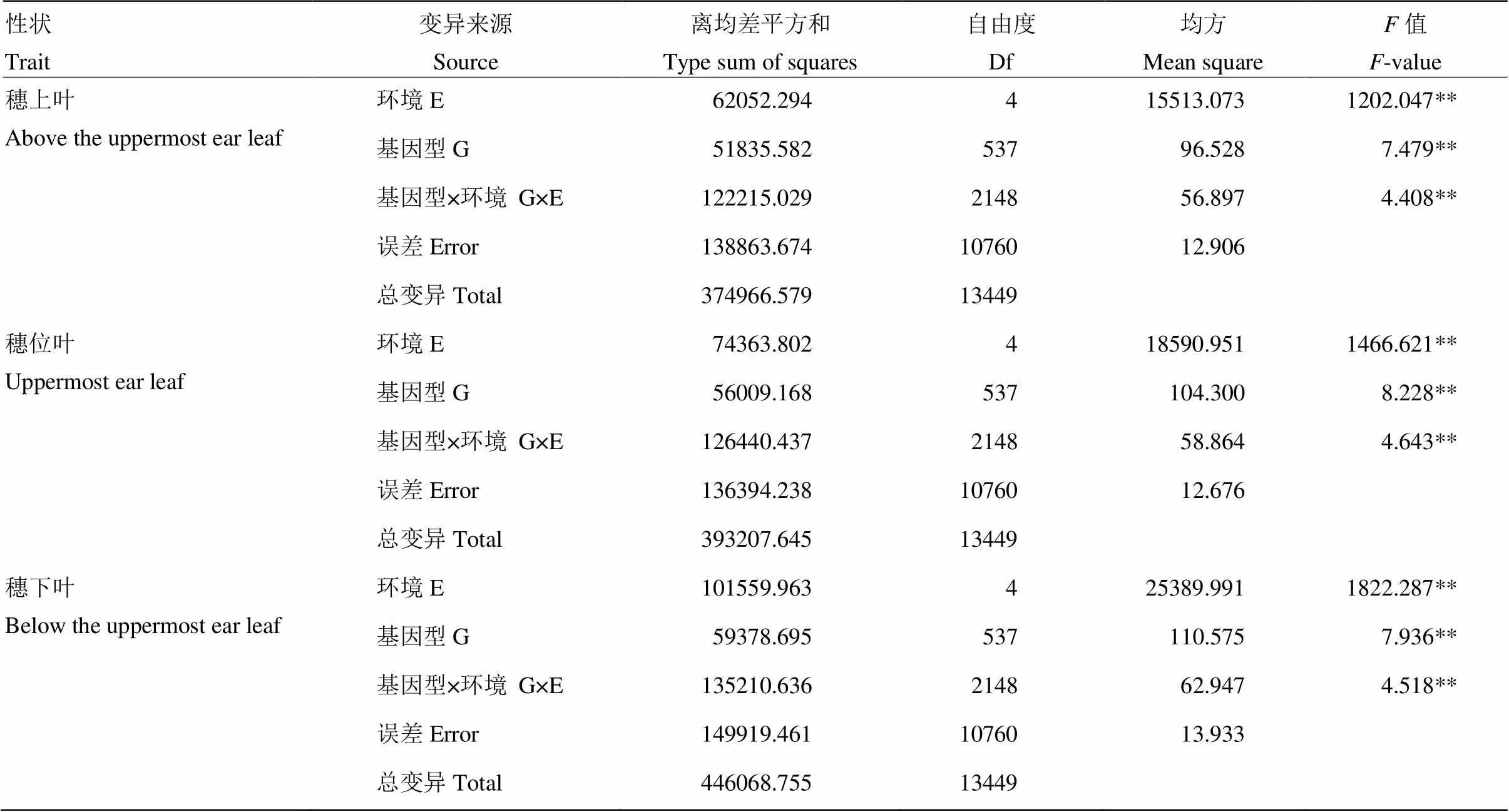
表2 5個環境玉米棒三葉葉綠素含量的方差分析
E:環境;G:基因型;G×E:基因與環境互作。**:在0.01水平上差異顯著
E: environment; G: genotype; G×E: genotype-by-environment interaction. **: Significant at the 0.01 level
2.3 玉米棒三葉葉綠素含量的全基因組關聯分析
2.3.1 閾值確定 利用GEC軟件計算558 629個SNPs的有效標記數(En),結果表明,En為250 345,軟件建議的3.99×10-6(1/En),該值作為關聯分析的顯著閾值。
2.3.2 關聯分析結果 對6個環境下的棒三葉葉綠素含量的GWAS結果進行分析,通過比較3種模型的QQ圖(圖2),針對不同模型對假陽性的控制來看,Q模型(圖中紅點)最差,K模型(圖中黑點)和Q+K模型(圖中藍點)優于Q模型。從對假陰性的控制效果看,Q+K模型比K模型稍微過于嚴格。因此,選用表現相對好的K模型的GWAS結果用于后續的位點挖掘和基因預測。基于K模型,在≤3.99×10-6下,6個環境一共檢測到29個SNPs與棒三葉葉綠素含量顯著關聯,涉及到18個位點(圖3;表3)。
對其他幾個環境來說,在鶴壁,共鑒定到7個顯著SNP,涉及到6個位點,分別是位于第8染色體與穗上葉葉綠素有關的1個位點,解釋5.55%的表型變異;位于第5和第10染色體與穗位葉葉綠素有關的3個位點,分別解釋5.36%、4.76%和4.75%的表型變異;其余2個與穗位葉葉綠素有關,位于第3和第7染色體,可分別解釋6.52%和6.37%的表型變異。
在三亞,共檢測到7個顯著SNP(4個位點),其中1個位于第7染色體與穗下葉葉綠素相關的位點,解釋6.07%的表型變異;另外3個位于玉米第1和第9染色體,與穗位葉葉綠素有關,解釋的表型變異分別為5.43%、6.01%和6.59%。
在長沙,檢測到5個SNP-性狀關聯,這5個SNP落在3個位點內,其中位于第1和第10染色體的2個與穗位葉葉綠素顯著相關的位點,能分別解釋5.89%和6.71%的表型變異;位于第10染色體上與穗上葉葉綠素含量顯著相關的位點,能解釋5.80%的表型變異。
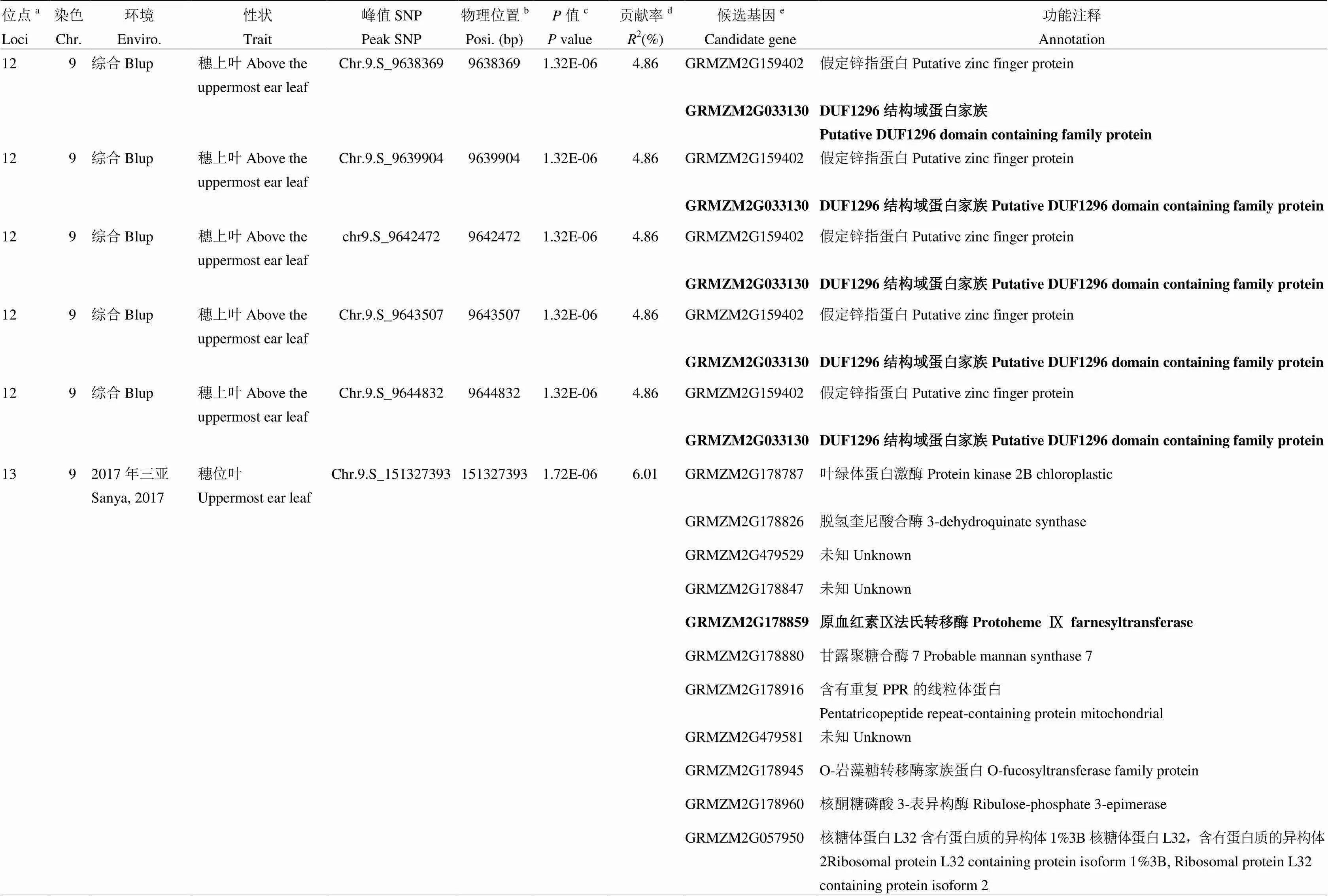
在5個環境綜合(Blup)條件下,共檢測到10個SNP,涉及到5個位點。其中有3個位點與穗上葉葉綠素含量顯著相關,分別位于第3、第5和第9染色體,解釋的表型變異分別為5.10%、4.80%和4.86%;1個位于玉米第8染色體與穗位葉葉綠素有關的位點,可解釋4.70%的表型變異,此位點在鶴壁也被檢測到,為后續的進一步研究奠定了基礎;此外,還有1個位于第5染色體,與穗下葉葉綠素含量顯著關聯,可解釋5.03%的表型變異。利用線性回歸模型計算了穗上葉、穗位葉與穗下葉葉綠素含量檢測到的位點的總表型變異,分別可解釋18.5%、26.2%和11.4%的表型變異;但仍有部分變異未能被解釋,由此造成的缺失遺傳力(missing heritability)可能因為存在微效位點或上位性互作導致,當前GWAS方法難以檢測。
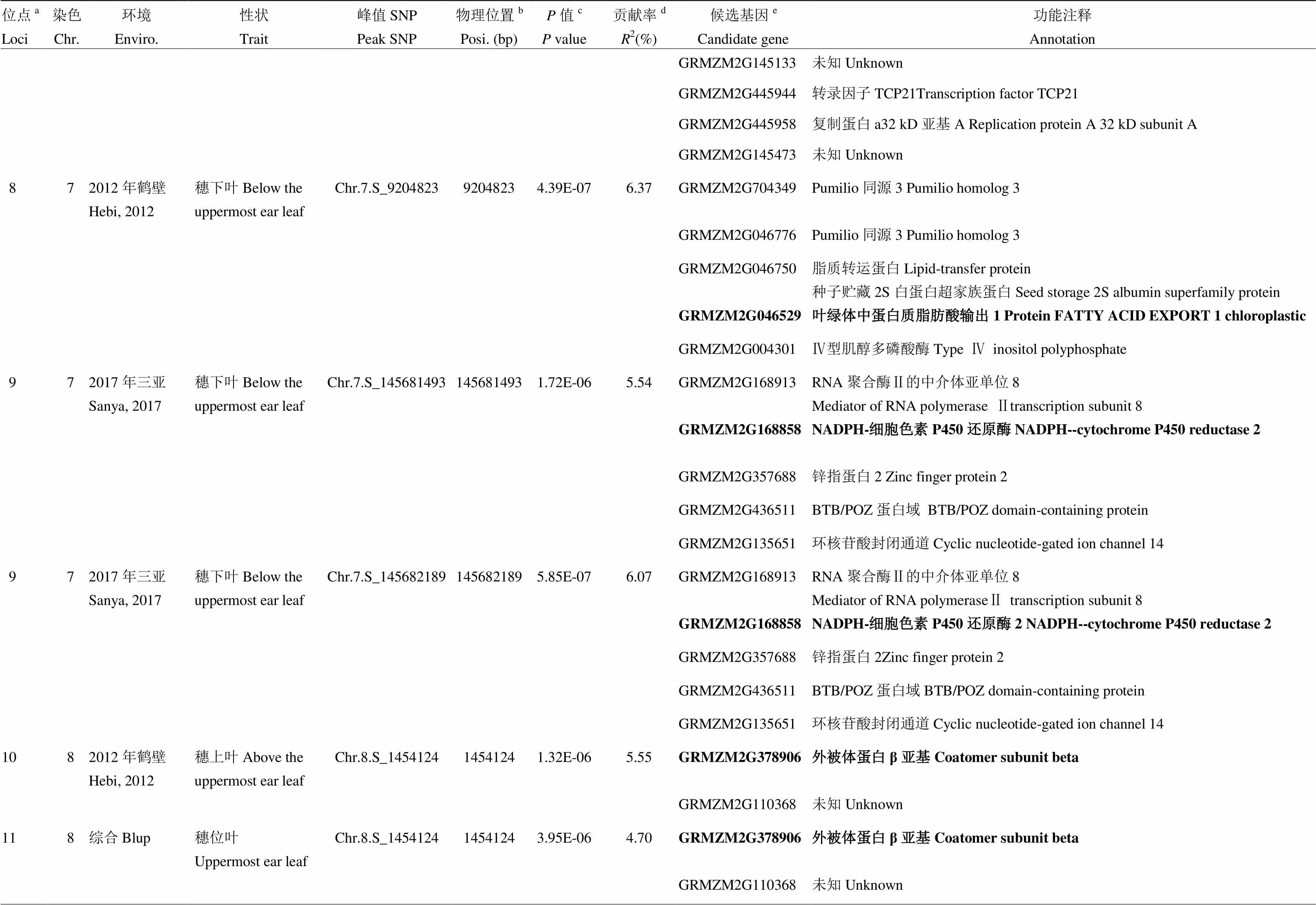
鑒定的18個位點,其中10號與11號位點共定位于第8染色體1.40—1.50 Mb區間內,分別解釋5.55%和4.70%的表型變異,該區間內共有2個基因(表3)。17號和18號位點共定位于第10染色體148.59—148.69 Mb區間,分別解釋6.71%和5.08%的表型變異,該區間內共有6個基因(表3)。共定位結果表明,這兩個位點受環境影響較小,可在不同環境下穩定遺傳;此外,2號位點可同時被長沙環境下的穗上葉與穗位葉葉綠素含量檢測到(表3)。遺憾的是,原陽和永城均未檢測到顯著位點(3.99×10-6)(圖3和表3)。表達量QTL分析(eQTL)發現76個候選基因中,85.5%的基因具有eQTL(65/76),表型與表達量之間的相關性分析發現,11.8%(9/76)的基因與對應表型顯著相關(<0.05),說明這些基因可能是通過表達量的變化來調控表型變異(數據未列出)。
2.3.3 候選基因確定 由于該群體的連鎖不平衡衰減距離是50 kb(2=0.1),因此,在峰值SNP的上下游各50 kb,即100 kb范圍內搜索候選基因。一共有76個候選基因落在這18個位點內,其中60個具有功能注釋(表3),根據基因功能注釋及其在B73參考基因組中的表達部位及表達量,選擇一個最可能的候選基因作為該位點的候選基因(表3)。
3 討論
統計功效是GWAS首要考慮因素,對玉米來說,受群體結構影響,不同性狀對不同模型的敏感程度不同。Yang等[27]研究表明,使用最優統計模型,可增加GWAS的統計功效。此外,劉坤等[28]使用3種模型(Q、K、Q+K)對玉米株高(plant height,PH)、穗位高(ear height,EH)、EH/PH、總葉片數(leaf number,LN)、穗上葉片數(leaf number above ear,LNAN)、LNAN/LN等6個性狀進行GWAS,發現Q模型對假陽性的控制不好,Q+K模型對假陽性的過于嚴格,而K模型表現最優;Zhao等[29]使用3種相同模型對玉米籽粒、穗軸、苞葉、莖桿、葉片等5個組織的砷含量進行GWAS,發現K和Q+K模型對假陽性的控制過于嚴格,最終選擇表現較好的Q模型的結果進行解析。本研究中,Q模型的表現最差,K模型和Q+K模型相當,但Q+K模型過于嚴格(圖2),因此,選擇K模型結果對玉米棒三葉葉綠素含量的遺傳基礎進行解析。

圖2 6個環境下棒三葉葉綠素含量3種模型(Q、K、Q+K)的QQ圖

表3 玉米棒三葉葉綠素含量候選基因及功能注釋

續表3 Continued table 3
續表3 Continued table 3
續表3 Continued table 3

續表3 Continued table 3

續表3 Continued table 3
a所有有重疊區間的QTL被歸為一個位點,位點的ID根據染色體及物理位置升序排序命名;b每個SNP的物理位置是基于B73參考基因組v2版本得到;c相應性狀的值是通過K模型計算得到;d相應位點解釋的表型變異;e位點內一個可能的生物學候選基因或離峰值SNP最近的候選基因。候選區間內最可能的候選基因用粗體標注
aAll QTLs with overlapping QTL regions were categorized as a loci, ID of loci was numbered according to chromosome and position by an ascending order method;bPhysical position of each SNP based on B73 RefGen_v2;cvalue of the corresponding trait calculated by K model;dThe phenotypic variance explained by the corresponding locus;eA plausible biological candidate gene in the locus or the nearest annotated gene to the lead SNP. The most possible candidate gene in each locus is marked in bold

圖3 棒三葉葉綠素含量關聯分析的曼哈頓圖
趙永萍[30]通過對玉米單交種先玉335的棒三葉進行剪葉處理,探索玉米各部位葉片對百粒重、果穗干重、產量的影響,發現棒三葉的缺失會造成產量的明顯下降,證明棒三葉對產量貢獻至關重要。陳永欣等[31]對玉米棒三葉相關性狀進行分析,得出棒三葉各葉片面積差異不大,在光合作用中發揮的作用近乎相同。本研究所測的棒三葉葉綠素含量相差不大,表明棒三葉在光合作用中可能發揮相似作用,與該結果吻合。唐海濤等[32]對65個玉米雜交種棒三葉的葉長、葉寬、葉肉厚度、葉面積、葉綠素含量、葉向值、光合速率、葉片干重和比葉重等性狀進行分析,發現穗上葉、穗位葉、穗下葉間存在一定的相關性,且棒三葉比葉重(單位葉面積的葉片重量從小到大依次為穗位葉、穗上葉、穗下葉)和葉綠素含量(從小到大依次為穗上葉、穗位葉、穗下葉)呈現一定變化規律。左寶玉等[4]對玉米不同葉位葉片進行葉綠體超微結構觀察及葉綠素含量進行測定,發現葉綠體的光合膜系統是葉綠素含量最高的部位,并且發現葉綠素含量和光合速率和產量之間呈顯著正相關[33-34]。蘇云松等[35]研究發現馬鈴薯葉片葉綠素含量(SPAD值)在正常日照條件下與馬鈴薯產量呈顯著正相關,認為SPAD值的大小會直接影響馬鈴薯產量。王康等[36]研究表明夏玉米生育期的SPAD值與其產量呈正相關。以上研究均表明葉綠素含量對產量有重要貢獻。
在前人研究中,擬南芥中發現的,將其進行過表達可顯著抵抗氧化脅迫,可以修復突變體中受損的葉綠體膜結構,保護葉綠體膜,使葉綠素免受進一步降解[37]。在水稻中,與野生型相比,過表達植株的葉綠素a、葉綠素b和葉綠素總量分別比野生型增加5%、100%和25%,光合速率、生物量和產量相對增加20%、17%和16%[38]。作為的上位基因,表達的增加導致葉綠素含量顯著增加,葉片葉色變為深綠色,光合速率和產量均顯著提高[39]。在玉米中,也有葉綠素含量定位相關報道,王愛玉等[40]通過玉米A150-3-2和Mo17為親本構建的189個F2單株為作圖群體,分別在喇叭口期和開花期對葉綠素a,葉綠素b,葉綠素c和總葉綠素含量進行測定,共檢測到32個與葉綠素含量相關的QTL。劉宗華等[41]以優良玉米雜交種農大108的203個F2:3家系為材料,利用復合區間作圖法,在施氮和不施氮情況下,對玉米不同發育時期的葉綠素含量進行了QTL分析,認為葉綠素含量的QTL表達存在時空差異,其中2個QTL(和)可以在整個生育期被檢測到,是生長發育必需的QTL。方永豐等[42]對已定位的玉米葉綠素QTL進行整合,利用薈萃分析(meta-analysis)發現多個共定位熱區,并在這些熱點區內挖掘與玉米葉綠素含量相關的候選基因。以上研究僅停留在連鎖分析層面,需要構建作圖群體,費時費力,且定位精度較低。隨著測序技術的發展和測序成本的降低,關聯分析在植物中被廣泛使用,因其定位精度可達單基因水平,已成為挖掘植物基因的重要工具。
本研究對538份玉米自交系的棒三葉葉綠素含量(SPAD值)進行測定,結合55萬個SNPs標記,通過全基因組關聯分析,檢測到29個與棒三葉葉綠素含量顯著關聯的SNP,涉及18個位點,共有76個候選基因落在這18個位點內,其中60個候選基因有功能注釋,16個功能未知。已注釋基因主要編碼轉運蛋白,結合蛋白,還原酶等,涉及功能包括能量代謝、生物合成調節及物質輸送代謝等途徑。18個位點中,有2個位點(第10和第11位點)在不同環境下共定位(表3),表明該位點受環境影響較小,在不同環境可穩定遺傳。此外,另2個位點(第17和第18位點)在相同環境不同葉片被檢測到(表3),說明這兩個葉片的葉綠素含量有共同的遺傳機制。此外還發現一些參與葉綠素合成及分解途徑的基因。
3.1 共定位結果及候選基因分析
對定位結果進行分析發現2012年鶴壁穗上葉有關的第10位點和Blup條件下穗位葉相關的第11位點共定位,該位點內共有2個基因,分別為和。其中功能未知,而編碼外被體β蛋白亞基(coatomer subunit beta),該基因僅在人類中有過描述,當敲除外被體β蛋白亞基時可使人類前列腺癌細胞凋亡速率升高,從而降低癌細胞的存活率[43]。但在植物中外被體β蛋白亞基的研究未見報道,因此,其作用機理尚不明確,推測其在玉米中也可能與細胞凋亡有關。
位于第10染色體上的與2018年長沙穗位葉相關的第17位點和2018年長沙穗上葉相關的第18位點共定位,位點內存在6個基因,(DNA mismatch repair protein MSH3)、(Nuclear transcription factor Y subunit C-4)、(acyl activating enzyme3,AAE3)、(C2 calcium/lipid-binding plantphosphoribosyltransferase family protein)、(Expressed protein)和(DNA binding protein)。編碼一種與AAE3高度相似的酰基活化酶。的不透明表型即是由該酶減少所引起的α-玉米醇溶蛋白的濃度降低導致,通過氨基酸和代謝物的分析表明,該基因可能通過提高α-酮戊二酸(ALA)和草酰乙酸含量進而影響氨基酸生物合成,將該基因轉入水稻中,同樣會出現不透明胚乳表型。該基因的克隆為谷物種子貯藏蛋白含量的遺傳調控提供了有效靶點[44]。也有研究表明,ALA的合成會促使葉綠素含量升高[45-47]。結合前人研究認為基因在參與調控玉米棒三葉葉綠素含量的同時也參與調控玉米籽粒賴氨酸的合成,當該基因過表達時葉綠素含量及籽粒中賴氨酸含量均升高。
3.2 葉綠素代謝相關候選基因
通過eQTL分析,發現2個參與葉綠素代謝的基因(和)。葉綠素屬于四吡咯物質,當四吡咯物質不與蛋白結合時,會產生對植物有害的自由基。為了保護植物免受自由基的傷害,可以通過調節ALA的合成來阻止四吡咯物質的積累[45]。Pontoppidan等[46]證明谷氨酰-tRNA還原酶(Glu TR)在ALA合成中起拮抗作用,而血紅素參與Glu TR活性的調節。在擬南芥中,可通過降低血紅素加氧酶活性積累血紅素,進而降低Glu TR活性[47]。本研究鑒定到的位于第9染色體的基因編碼原血紅素Ⅸ法氏轉移酶,該酶可增加植物中血紅素量積累,進而降低Glu TR活性,促進ALA的合成,從而促進葉綠素的合成。此外,7號染色體上檢測到的編碼NADPH-細胞色素P450還原酶2(CPR2)的基因參與葉綠素代謝。細胞色素P450(CYPs)是一種血紅素結合蛋白,細胞色素P450接受電子后才能發揮活性。CPR2是細胞色素P450的主要電子供體,CPR2的存在使得細胞中血紅素積累,谷氨酰-tRNA還原酶(Glu TR)活性降低,促使ALA合成,葉綠素合成增加[48]。并且,具有CPR功能,由于P450家族中的酶或基因功能多樣,在玉米中并未明確其作用機理,僅在其他植物中有報道,表明CPR是一種將電子從NADPH轉移到細胞色素P450酶的關鍵酶。在杉木中已明確CPR基因表達和酶活性的調控機制,通過Northern blot發現CPR在種子成熟前與萌發過程中的表達均受發育調控,而在種子和幼苗組織的子葉、胚根和大配子體中存在差異[49],推測其在玉米中具有類似功能,即CPR在玉米籽粒成熟前調控籽粒大小。
4 結論
基于K模型的GWAS結果,共檢測到29個與棒三葉葉綠素含量顯著關聯的SNP,涉及到18個位點,其中2個位點可以在2個環境或2個組織中被共定位。18個位點內共有76個基因,其中85.5%的候選基因具有eQTL(65/76),11.8%的候選基因與對應表型顯著相關(<0.05)。此外,共有76個候選基因落在這些位點內,其中60個基因具有功能注釋并討論了共定位以及與葉綠素代謝相關的基因。
致謝:本研究所用關聯群體材料及基因型由華中農業大學作物遺傳改良國家重點實驗室嚴建兵教授提供,在此表示感謝。
[1] 劉紅梅, 周新躍, 劉建豐, 邱穎波, 范峰峰, 徐慶國. 秈型雜交稻光合特性的配合力分析. 植物遺傳資源學報, 2014, 15(4): 699-705.
LIU H M, ZHOU X Y, LIU J F, QIU Y B, FAN F F, XU Q G. Combining ability analysis of photosynthetic characteristics of indica hybrid rice., 2014, 15(4): 699-705. (in Chinese)
[2] 李合生. 現代植物生理學. 北京: 高等教育出版社, 2012.
LI H S.. Beijing: Higher education press, 2012. (in Chinese)
[3] 孫紅, 李民贊, 張彥娥, 趙勇, 王海華. 玉米生長期葉片葉綠素含量檢測研究. 光譜學與光譜分析, 2010, 30(9): 2488-2492.
SUN H, LI M Z, ZHANG Y E, ZHAO Y, WANG H H. Study of chlorophyll content in maize leaves during growing period., 2010, 30(9): 2488-2492. (in Chinese)
[4] 左寶玉, 李世儀, 匡廷云, 段續川. 玉米不同層次葉片葉綠體的超微結構和葉綠素含量變化. 作物學報, 1987, 13(3): 213-218.
ZUO B Y, LI S Y, KUANG T Y, DUAN X C. The changes of ulterastructure and chlorophyll content of chloroplast of leaves in different ranks in maize., 1987, 13(3): 213-218. (in Chinese)
[5] 文自翔, 趙團結, 鄭永戰, 劉順湖, 王春娥, 王芳. 中國栽培和野生大豆農藝及品質性狀與SSR標記的關聯分析: Ⅱ.優異等位變異的發掘. 作物學報, 2008, 34(8): 1339-1349.
WEN Z X, ZHAO T J, ZHENG Y Z, LIU S H, WANG C E, WANG F. Association analysis of agronomic and quality traits with SSR markers inandin China: II. Exploration of elite alleles., 2008, 34(8): 1339-1349. (in Chinese)
[6] 李瑋瑜, 張斌, 張嘉楠, 昌小平, 李潤植, 景蕊蓮. 利用關聯分析發掘小麥自然群體旗葉葉綠素含量的優異等位變異. 作物學報, 2012, 38(6): 962-970.
LI W Y, ZHANG B, ZHANG J N, CHANG X P, LI R Z, JING R L. Exploring elite alleles for chlorophyll content of flag leaf in natural population of wheat by association analysis., 2012, 38(6): 962-970. (in Chinese)
[7] TIAN F, BADBURY P J, BROWN P J, HUNG H, BUCKLER E S. Genome-wide association study of leaf architecture in the maize nested association mapping population., 2011, 43(2): 159-162.
[8] ZHAO K, TUNG C W, EIZENGA G C, WRIGHT M H, ALI M L, PRICE A H. Genome-wide association mapping reveals a rich genetic architecture of complex traits in., 2011, 2: 467.
[10] 劉濤, 權文彥, 吳雪蓮, 周露, 程宇坤, 姚方杰. 四川地方小麥品種產量與品質相關性狀SSR標記位點的優異等位變異遺傳解析. 麥類作物學報, 2015, 35(4): 449-456.
LIU T, QUAN W Y, WU X L, ZHOU L, CHENG Y K, YAO F J. Genetic analysis of SSR markers related to elite alleles of associated with yield and quality traits of sichuan wheat landraces., 2015, 35(4): 449-456. (in Chinese)
[11] ATWELL S, HUANG Y S, VILHJALMSSON B J, WILLEMS G, HORTON M, LI Y, MENG D, PLATT A, TARONE A M, HU T T, JIANG R, MULIYAFI N W, ZHANG X, ALNER M A, BAXTER I, BRAEHI B, CHORY J, DEARL C, DEBIEU M, DE MEAUX J, ECKER J R, FAURE N, KNISKERN J M, JONES J D, MICHAEL T, NEMRI A, ROUX F, SALT D E, TANG C, TODESCO M, TRAW M B, WEIGEL D, MARJORAM P, BOREVITZ J O, BERGELSON J, NORDBORG M. Genome-wide association study of 107 phenotypes ininbred lines., 2010, 465: 627-631.
[12] THORNSBERRY J M, GOODMAN M M, DOEBLEY J, KRESOVICH S, NIELSEN D, BUCKLER E S. Dwarf8 polymorphisms associate with variation in flowering time., 2001, 28(3): 286-289.
[13] ANDRé BELó, ZHENG P, LUCK S, SHEN B, MEYER D J, LI B, TINGEY S, RAFALSKI A. Whole genome scan detects an allelic variant offad2 associated with increased oleic acid levels in maize., 2008, 279(1): 1-10.
[14] WANG Q, XIE W, XING H, YAN J, MENG X, LI X, FU X, XU J, LIAN X, YU S, XING Y, WANG G. Genetic architecture of natural variation in rice chlorophyll content revealed by a genome-wide association study., 2015, 8(6): 946-957.
[15] NAGATA N, TANAKA R, SATOH S, Tanaka A. Identification of a vinyl reductase gene for chlorophyll synthesis inand implications for the evolution of Prochlorococcus species., 2005, 17(1): 233-240.
[16] WU Z, ZHANG X, HE B, DIAO L, WAN J. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis., 2007, 145(1): 29-40.
[17] 陶士珩, 劉曉明, 儲建華, 張榮梅, 杜麗萍, 羅澤偉. 混合群體連鎖不平衡的衰減速率與基因定位. 科學通報, 2000, 45(21): 2274-2280.
TAO S H, LIU X M, CHU J H, ZHANG R M, DU L P, LUO Z W. Attenuation rate and gene location of linkagedisequilibrium in mixed population., 2000, 45(21): 2274-2280. (in Chinese)
[18] 趙可夫. 玉米抽雄后不同葉位葉對籽粒產量的影響及其光合性能. 作物學報, 1981, 7(4): 259-266.
ZHAO K F. Effect of the leaves of different positions in maize on the corn yield and the photosynthetic properties of those leaves after the growing out of the female flowers., 1981, 7(4): 259-266. (in Chinese)
[19] MCKENNA S, MEYER M, GREGG C, GERBER S. CorrPlot: An Interactive scatterplot for exploring correlation., 2015, 25(2): 445-463.
[20] CORETEAM R. R: a language and environment for statistical computing., 2015, 14: 12-21.
[21] XIAO Y, TONG H, YANG X, XU S, PAN Q, QIAO F, RAIHAN M S, LUO Y, LIU H, ZHANG X, YANG N, WANG X, DENG M, JIN M, ZHAO L, LUO X, ZHOU Y, LI X, LIU J, ZHAN W, LIU N, WANG H, CHEN G, CAI Y, XU G, WANG W, ZHENG D, YAN J. Genome- wide dissection of the maize ear genetic architecture using multiple populations., 2016, 210(3): 1095-1106.
[22] YANG N, LU Y, YANG X, HUANG J, ZHOU Y, ALI F, WEN W, LIU J, LI J, YAN J. Genome wide association studies using a new nonparametric model reveal the genetic architecture of 17 agronomic traits in an enlarged maize association panel., 2014, 10(9): e1004573.
[23] LI M X, YEUNG J M Y, CHERNY S S, SHAM P C. Evaluating the effective numbers of independent tests and significant p-value thresholds in commercial genotyping arrays and public imputation reference datasets., 2012, 131(5): 747-756.
[24] BRADBURY P J, ZHANG Z, KROON D E, CASSTEVENS T M, BUCKLER E S. TASSEL: Software for association mapping of complex traits in diverse samples., 2007, 23(19): 2633-2635.
[25] LI H, PENG Z, YANG X, WANG W, FU J, WANG J, HAN Y, CHAI Y, GUO T, YANG N, LIU J, WARBURTON M L, CHENG Y, HAO X, ZHANG P, ZHAO J, LIU Y, WANG G, LI J, YAN J. Genome-wide association study dissects the genetic architecture of oil biosynthesis in maize kernels., 2013, 45(1): 43-72.
[26] FU J, CHENG Y, LINGHU J, YANG X, KANG L, ZHANG Z, ZHANG J, HE C, DU X, PENG Z, WANG B, ZHAI L, DAI C, XU J, WANG W, LI X, ZHENG J, CHEN L, LUO L, LIU J,QIAN X, YAN J, WANG J, WANG G. RNA sequencing reveals the complex regulatory network in the maize kernel., 2013, 4: 2832.
[27] YANG X, YAN J, SHAH T, WARBURTON M L, LI Q, LI L, GAO Y, CHAI Y, FU Z, ZHOU Y, XU S, BAI G, MENG Y, ZHENG Y, LI J. Genetic analysis and characterization of a new maize association mapping panel for quantitative trait loci dissection., 2010, 121(3): 417-431.
[28] 劉坤, 張雪海, 孫高陽, 閆鵬帥, 郭海平, 陳思遠, 薛亞東, 郭占勇, 謝慧玲, 湯繼華, 李衛華. 玉米株型相關性狀的全基因組關聯分析. 中國農業科學, 2018, 51(5): 821-834.
LIU K, ZHANG X H, SUN G Y, YAN P S, GUO H P, CHEN S Y, XUE Y D, GUO Z Y, XIE H L, TANG J H, LI W H. Genome-wide association studies of plant type traits in maize., 2018, 51(5): 821-834. (in Chinese)
[29] ZHAO Z, ZHANG H, FU Z, CHEN H, LIN Y, YAN P, LI W, XIE H, GUO Z, ZHANG X, TANG J. Genetic-based dissection of arsenic accumulation in maize using a genome-wide association analysis method., 2017, 91: 135-147.
[30] 趙永萍. 玉米不同葉位葉片與產量相關性研究. 現代農業科技, 2015, 644(6): 11-12.
Zhao Y P. Correlation between leaf position and yield of maize., 2015, 644(6): 11-12. (in Chinese)
[31] 陳永欣, 翟廣謙, 李彥良, 王計虎. 糯玉米自交系、雜交種棒三葉與產量之間相關性分析. 玉米科學, 2001, 9(2): 50-52.
CHEN Y X, ZHAI G Q, LI Y L, WANG J H. Analysis on correlativity of three-ear-leaves of inbred line and hybrid-strain yield of glutinous maize., 2001, 9(2): 50-52. (in Chinese)
[32] 唐海濤, 張彪, 田玉秀, 余東梅, 陳潔, 康繼偉. 玉米雜交種棒三葉光合性狀比較研究. 玉米科學, 2009, 17(2): 86-90.
TANG H T, ZHANG B, TIAN Y X, YU D M, CHEN J, KANG J W. Comparison of photosynthetic characteristics of three ear-leaves hybrids maize., 2009, 17(2): 86-90. (in Chinese)
[33] 袁吉, 李艷玉, 蔚榮海. 鮮食糯玉米自交系葉綠素含量及其與產量的關系. 吉林農業, 2011(12): 64-65.
YUAN J, LI Y Y, WEI R H. Relationship of content of chlorophyll and yield of inbred line of fresh-eating waxy corn., 2011(12): 64-65. (in Chinese)
[34] 劉貞琦, 劉振業, 馬達鵬, 曾淑芬. 水稻葉綠素含量及其與光合速率關系的研究. 作物學報, 1984, 10(1): 57-62.
LIU Z Q, LIU Z Y, MA D P, ZENG S F. A study on the relation between chlorophyll content and photosynthetic rate of rice., 1984, 10(1): 57-62. (in Chinese)
[35] 蘇云松, 郭華春, 陳伊里. 馬鈴薯葉片SPAD值與葉綠素含量及產量的相關性研究. 西南農業學報, 2007, 20(4): 690-693.
SU Y S, GUO H C, CHEN Y L. Relationship between SPAD readings chlorophyll contents and yield of potato (L.)., 2007, 20(4): 690-693. (in Chinese)
[36] 王康, 沈榮開, 唐友生. 用葉綠素測值(SPAD)評估夏玉米氮素狀況的實驗研究. 灌溉排水學報, 2002, 21(4): 1-3.
WANG K, SHEN R K, TANG Y S. Evaluating nitrogen status with chlorophyll meter in summer corn., 2002, 21(4): 1-3. (in Chinese)
[37] ZHANG L, KUSABA M, TANAKA A, Sakamoto W. Protection of chloroplast membranes by VIPP1 rescues aberrant seedling development innyc1 mutant., 2016, 7(73): 533.
[38] WANG F, WANG G, LI X, HUANG J, ZHENG J. Heredity, physiology and mapping of a chlorophyll content gene of rice (L.)., 2008, 165(3): 324-330.
[39] HUANG J, QIN F, ZANG G, KANG Z, ZOU H, HU F, YUE C, LI X, WANG G. Mutation of OsDET1 increases chlorophyll content in rice., 2013, 210(210C): 241-249.
[40] 王愛玉, 張春慶. 玉米葉綠素含量的QTL定位. 遺傳, 2008, 30(8): 1083-1091.
WANG A Y, ZHANG C Q. QTL mapping for chlorophyll content in maize., 2008, 30(8): 1083-1091. (in Chinese)
[41] 劉宗華, 謝惠玲, 王春麗, 田國偉, 衛曉軼, 胡彥民. 氮脅迫和非脅迫條件下玉米不同時期葉綠素含量的QTL分析. 植物營養與肥料學報, 2008, 14(5): 845-851.
LIU Z H, XIE H L, WANG C L, TIAN G W, WEI X Y, HU Y M. QTL analysis of chlorophyll content of maize under N-stress and no N-stress at different development stages., 2008, 14(5): 845-851. (in Chinese)
[42] 方永豐, 李永生, 白江平, 慕平, 孟亞雄, 張金林. 玉米持綠相關QTL整合圖譜構建及一致性QTL區域內候選基因發掘. 草業學報, 2012(4): 175-185.
FANG Y F, LI Y S, BAI J P, MU P, MENG Y X, ZHANG J L. Construction of integration QTL map and identification of candidate genes for stay-green in maize., 2012(4): 175-185. (in Chinese)
[43] MI Y, SUN C, WEI B, SUN F, GUO Y, HU Q, DING W, ZHU L, XIA G. Coatomer subunit beta 2 (COPB2), identified by label-free quantitative proteomics, regulates cell proliferation and apoptosis in human prostate carcinoma cells., 2018, 49(1): 473-480.
[44] WANG G, SUN X, WANG G, WANG F, GAO Q, SUN X, TANG Y, CHANG C, LAI J, ZHU L, XU Z, SONG R. Opaque7 encodes an acyl-activating enzyme-like protein that affects storage protein synthesis in maize endosperm., 2011, 189(4): 1281-1295.
[45] MESKAUSKIENE R, NATER M, GOSLINGS D, KESSLER F, OP DEN CAMP R, APEL K. FLU: A negative regulator of chlorophyll biosynthesis in., 2001, 98(22): 12826-12831.
[46] PONTOPPIDAN B, GAMINIKANNANGARA C. Purification and partial characterisation of barley glutamyl-tRNAGlu reductase, the enzyme that directs glutamate to chlorophyll biosynthesis., 2010, 225(2): 529-537.
[47] GOSLINGS D, MESKAUSKIENE R, KIM C,LEE KP, NATER M, APEL K. Concurrent interactions of heme and FLU with Glu tRNA reductase (HEMA1), the target of metabolic feedback inhibition of tetrapyrrole biosynthesis, in dark- and light-grownplants., 2010, 40(6): 957-967.
[48] 賀麗虹, 趙淑娟, 胡之璧. 植物細胞色素P450基因與功能研究進展. 藥物生物技術, 2008, 15(2): 142-147.
HE L H, ZHAO S J, HU Z B. Gene and function research progress of plant cytochrome P450s., 2008, 15(2): 142-147. (in chinese)
[49] TRANBARGER T J, FORWARD B S, MISRA S. Regulation of NADPH-cytochrome P450 reductase expressed during Douglas-fir germination and seedling development., 2000, 44(2): 141-153.
Genome-wide Association Study of Chlorophyll Content in Maize
SHI DaKun1, YAO TianLong1, LIU NanNan2, DENG Min3, DUAN HaiYang1, WANG LuLin1, WAN Jiong1,GAO JiongHao1, XIE HuiLing1, TANG JiHua1, ZHANG XueHai1
(1College of Agronomy, Henan Agricultural University/National Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450002;2Haixia Institute of Science and Technology, Fujian Agriculture and Forestry University, Fuzhou 350002;3College of Agronomy, Hunan Agricultural University/Maize Engineering Research Center of Hunan Province, Changsha 410128)
【】 Chlorophyll content was positively correlated with crop yield, improving crop yield by increasing chlorophyll content has become an important breeding goal in maize. Thus, elucidating the genetic basis of chlorophyll content using genome-wide association study (GWAS) can provide theoretical support for ideotype-based maize breeding with high photosynthetic efficiency. 【】 The association mapping panel (AMP) used in this study was consisted of 538 maize inbred lines, chlorophyll content of maize three leaves (above the uppermost ear leaf, uppermost ear leaf and below the uppermost ear leaf ) of the AMP was investigated at 5 days after pollination at five locations, then a GWAS with three models (Q, K, Q+K) were carried out using 558 629 single nucleotide polymorphisms (SNPs). The combination of optimal GWAS model with expression quantitative trait loci (eQTL) analysis, natural variation of chlorophyll content was further explored. 【】All traits measured at the five locations exhibited an approximately normal distribution and positive correlations between paired traits were also observed. Analysis of variance indicated that significant variations were observed across environment, genotype and the genotype × environment interaction. In addition, the heritability of chlorophyll content was 0.66, 0.66, and 0.67 for above the uppermost ear leaf, uppermost ear leaf and below the uppermost ear leaf, respectively. When test with the optimal GWAS model, K model has the greatest success in reducing false positive (type I errors) than other two models. Based on the result of K model, a total of 18 loci involving in 29 significantly SNP-traits associations were detected (≤3.99×10-6), and 76 candidate genes were found, including 42 genes that have functional annotation that involved in energy metabolism, biosynthetic regulation and material transportation and metabolic pathways. Of which, 85.5% (65/76) of the candidate genes have eQTLs and 11.8% (9/76) of the candidate genes were significantly associated with the corresponding phenotype (<0.05), indicating that these nine genes may affect phenotypic variation by regulating their expression. Moreover, two loci were found to be co-localized in two environments or leaves, the genewithin the co-localized locus, encodes an acyl-activating enzyme, highly similar to AAE3. It can increase the lysine content and improve maize quality by increasing the content of α-ketoglutarate (ALA) and oxaloacetate, in addition, ALA could promote chlorophyll biosynthesis and improve crop yield, this gene was considered as the most likely candidate gene. 【】The results indicated that K model having the best result in reducing the false positive. Based on the K model, a total of 18 loci associated with chlorophyll content and several candidate genes may be involved in chlorophyll synthesis pathway were identified.
maize (L);chlorophyll content; genome-wide association study; high photosynthetic efficiency
10.3864/j.issn.0578-1752.2019.11.001
2019-01-21;
2019-02-28
河南省科技攻關項目(182102110349)、省部共建小麥玉米作物學國家重點實驗室自主設置課題(39990080)、河南農業大學博士科研啟動金(30500563)、2019年度河南農業大學科技創新基金(KJCX2019A01)
史大坤,E-mail:912320091@qq.com。姚天蘢,E-mail:yaotianlong0629@qq.com。史大坤和姚天蘢為同等貢獻作者。通信作者張雪海,Tel:0371-63558122;E-mail:xuehai85@126.com
(責任編輯 李莉)

