腹腔鏡輔助雙通道重建術治療食管胃交界部腺癌
查 鵬,劉軍強,宋偉安,岳彩迎,趙嘉華,范博士,王振華,陳思禹,龔太乾
因食管胃交界部腺癌(adenocarcinoma of esop-hagogastric junction,AEGJ)解剖位置的特殊性,在較長時間里,AEGJ分類、手術入路、切除范圍及消化道重建方法均存在較大爭議[1]。胸外科采用左側開胸入路、食管部分切除術、近端胃大部切除術、食管胃左胸吻合術,存在手術創傷大、術后并發癥多、胃食管反流重、生活質量差的缺點;普通外科采用經腹入路、全胃切除術、空腸重建術,存在吻合口并發癥多、生活質量差的缺點[2]。
對AEGJ患者,我們過去采用左側開胸食管部分切除術、近端胃大部切除術、食管胃左胸吻合術,2015年7月起,開始實施腹腔鏡輔助近端胃大部切除術、限制性雙通道空腸重建術,取得了不錯的效果。本研究對接受不同手術方式的患者進行回顧性分析,評估腹腔鏡輔助近端胃大部切除術、限制性雙通道空腸重建術的安全性和可行性。
1 資料與方法
1.1 臨床資料 2010年1月—2018年12月,解放軍總醫院第六醫學中心胸外科共手術治療符合入排標準的AEGJ患者89例,男性71例,女性18例。患者年齡46~78歲。納入標準:年齡18~79歲,男女不限,美國麻醉醫師協會(American Society of Anesthesiologists,ASA)分級Ⅰ-Ⅱ級;于解放軍總醫院第六醫學中心胸外科接受根治性手術治療的SiewertⅡ型AEGJ患者。排除標準:①ASA分級≥Ⅲ級;②手術方式為右胸+腹部切口(Ivor-Lewis)或頸胸腹切口(Mckeown);③既往行胃大部切除手術。
60例接受左側開胸手術的患者作為對照組,29例接受腹腔鏡輔助限制性雙通道空腸重建術的患者作為觀察組。因為2組患者樣本量差別較大,為消除2組患者基線資料的統計學差異,對2組患者臨床基線資料進行傾向匹配分析(1:2),最終匹配出26例觀察組患者和52例對照組患者。在進行傾向匹配分析前后,對照組和觀察組患者的臨床基線資料情況如表1所示。
以上資料通過HIS收集,2015年9月以前手術患者,出院后通過電話隨訪;2015年9月以后手術患者,出院后通過零氪數據庫進行隨訪;隨訪資料截至2018年12月31日。
1.2 手術方法 左側開胸食管部分切除術、近端胃大部切除術、食管胃左胸吻合術:左側第7肋間后外側切口進胸,游離食管,清掃縱隔淋巴結;切開膈肌,游離胃,清掃腹腔淋巴結,將胃上提至左胸腔,以直線型切割縫合器行近端胃大部切除,制作管狀胃,于腫瘤上方5~8 cm處切斷食管,行食管胃端側機械吻合。
腹腔鏡輔助食管部分切除術、近端胃大部切除術、限制性雙通道空腸重建術:患者仰臥位,經腹部5個切口置入戳卡,腹腔鏡下游離胃及下段食管,并清掃腹腔及下縱隔淋巴結;將劍突下切口延長至5~10 cm,距腫瘤上方5 cm處切斷食管,置入圓形吻合器底座,于體外以直線型切割縫合器行近端胃大部切除術,制作管狀胃;Treitz韌帶遠端15 cm處切斷空腸,將遠端空腸封閉,遠端空腸距斷端10 cm處,遠端空腸與食管行食管空腸端側機械吻合,食管空腸吻合口遠端10 cm處遠端空腸與胃小彎行端側吻合;胃空腸吻合口遠端30 cm處,近端空腸與遠端空腸行端側吻合[2]。圖1。

表1 傾向匹配前后2組患者基線資料比較

圖1 腹腔鏡輔助限制性雙通道空腸重建術
1.3 觀察指標 ①手術情況:包括手術入路、切除范圍、吻合方式、手術時間、術中出血量、手術清掃淋巴結數量等;②術后并發癥:根據Clavien-Dindo手術并發癥分級系統,對術后30 d并發癥進行分級,其中3~5級定義為嚴重并發癥。
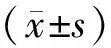
2 結果
2.1 手術結果 78例患者均成功地接受手術治療,其中左側開胸手術52例,腹腔鏡輔助限制性雙通道空腸重建術26例。手術時間130~500 min,術中出血量50~1 200 mL,清掃淋巴結數7~43個。2組患者手術時間、術中出血量差異比較無統計學意義(P>0.05);觀察組清掃淋巴結數量多于對照組,差異比較有統計學意義(P=0.002)。表2。

表2 手術時間、術中出血量及淋巴結清掃數
注:與對照組比較,*P<0.05
2.2 術后并發癥 對照組發生術后并發癥39例(75.0%),觀察組為13例(50.00%),2組1-2級并發癥患者均占發生并發癥患者總數的50%以上,多為術后輸血,主要是因為AEGJ患者術前常常伴有貧血,術后需要輸血;對照組發生嚴重并發癥患者為14例(26.92%),主要是因為拔管后出現胸腔積液,需要行胸腔穿刺/胸腔閉式引流術,1例患者因肺部感染、呼吸衰竭轉入ICU,1例患者死于術后吻合口瘺、肺部感染及呼吸衰竭;觀察組發生嚴重并發癥患者僅有5例(19.23%),無4級和5級并發癥。觀察組患者并發癥發生率(50.00% vs 75.0%,2=9.82,P=0.003)顯著低于對照組;觀察組患者嚴重并發癥(19.23% vs 26.92%,2=0.958,P=0.372)發生率低于對照組,但差異比較無統計學意義。術后并發癥情況詳見表3。

表3 術后并發癥[n(%)]
注:與對照組比較,*P<0.05
3 討論
近年來,AEGJ的發病率明顯升高,而且預后較差,根治性手術切除仍然是可切除AEGJ的主要治療方法[3-6]。由于解剖位置特殊性,AEGJ特別是SiewertⅡ型AEGJ的手術入路、切除范圍及消化道重建方法均存在較大的爭議。
國內胸外科常采用左側開胸入路,行食管部分切除術、近端胃大部切除術、食管胃左胸吻合術,其優勢在于食管切除范圍及縱隔淋巴結清掃,但存在手術創傷大、術后并發癥多、胃食管反流重、生活質量差的缺點;普通外科采用經腹入路、全胃切除術、空腸重建術,其優勢在于腹腔淋巴結清掃徹底、避免開胸手術相關并發癥,但存在吻合口并發癥多、生活質量差的缺點[2]。對SiewertⅡ型AEGJ,循證醫學證據證實:①經腹入路手術能夠減少開胸手術創傷、徹底清掃腹腔淋巴結,有利于降低手術并發癥,改善患者的長期預后[1,7-9]。②雖然推薦全胃切除術+D2淋巴結清掃作為標準手術方式,但其術后存在傾倒綜合征及營養不良等嚴重問題[10]。大部分可通過胃大部切除術及區域淋巴結清掃而治愈,而且可以避免全胃切除術的并發癥、提高患者生活質量并改善長期預后[11]。③近端胃切除術后消化道重建方式包括食管-殘胃吻合、雙通道吻合、間置空腸吻合等[12]。傳統的食管胃吻合簡單方便,但術后存在胃食管反流等并發癥;而雙通道重建術有助于改善上述問題[2,11-18]。
我們綜合國內外研究結果,改進為腹腔鏡輔助近端胃大部分切除、限制性雙通道空腸重建術:經劍突下5~10 cm小切口,手術時間比全腹腔鏡手術明顯縮短,吻合效果滿意;腹腔鏡下通過食管裂孔,下段食管游離及切除范圍更廣,避免食管殘端陽性,還能清掃下段食管旁淋巴結,保證手術的根治性;平衡雙通道內的壓力,減少因殘胃或空腸張力增加引起的反流;通過調整殘胃與輸出襻空腸角度,限制食糜直接進入空腸,優先進入殘胃及十二指腸,接近正常生理狀態,保留了殘胃及十二指腸排空、營養吸收等重要功能,手術效果優于單純的雙通道重建術[2]。
本研究中,觀察組的手術方式雖然更復雜,但2組患者手術時間、術中出血量無顯著性差異,說明隨著微創手術的進步,手術的安全性得以保障,有利于提高手術的可行性。觀察組清掃淋巴結數量顯著多于對照組,能夠改善淋巴結清掃,有利于提高手術的有效性,預期可以改善患者的預后。
本研究中2組患者的并發癥發生率較高(75.0% vs 50.00%),其中大部分為輸血等2級并發癥,主要是因為AEGJ患者常因腫瘤破潰及食欲減退導致貧血。觀察組患者并發癥發生率顯著低于對照組(P=0.03);嚴重并發癥發生率也低于對照組,而且無圍手術期死亡,但差異比較無統計學意義。說明限制性雙通道空腸重建術可以降低術后并發癥發生率,有利于提高手術的安全性。
本研究也存在一些不足之處,本研究是一項回顧性研究,樣本量小,僅評估手術的安全性和可行性,需要進行進一步前瞻性的研究;未進行手術前后的生活質量評分和生存分析研究,需要在今后的研究中進一步改善。

