Mdivi-1對帕金森病大鼠多巴胺能神經元損傷的保護作用研究
郭 欣,朱子建,白 雅,張 云,劉學東
帕金森病(Parkinson’s disease,PD)是臨床上常見的神經系統性疾病,其主要臨床表現為靜止性震顫和肌強直等,其病理特征為黑質紋狀體中多巴胺能神經元受損,導致多巴胺(dopamine,DA)的含量顯著減少,引起相應的病理改變[1]。目前普遍認為PD的發病可能與遺傳、環境因素以及氧化應激等相關[2],但其具體機制仍遠未明確。臨床上治療PD的藥物多為左旋多巴胺類,但該類藥物治療只能改善臨床癥狀和延緩病程進展,不能阻止疾病向前發展。而且為達到治療效果需要不斷加大劑量,其產生的不良反應如排尿困難等往往令患者難以忍受。因此,開發有效性高且不良反應小的藥物已然成為該領域的研究熱點之一。
線粒體是真核細胞內一種重要的細胞器,參與能量產生、氧化應激、細胞凋亡等諸多生命活動。研究發現,線粒體功能異常與PD的發病密切相關,例如線粒體ATP產生異常及氧自由基的含量異常升高都參與PD的發生[3-4]。新近研究表明,線粒體處于分裂融合的動態平衡當中,這種平衡對于維持線粒體功能及細胞穩態有重要意義[5]。參與線粒體分裂的分子主要為動力相關蛋白1(dynamin-related protein 1,DRP1)、線粒體分裂蛋白1(mitochondria fission protein 1,FIS1)、線粒體分裂因子(mitochondria fission factor,MFF),參與線粒體融合的分子主要為線粒體融合蛋白1(mitofusin 1,MFN1)、線粒體融合蛋白2(mitofusin 2,MFN2)和視神經萎縮癥蛋白1(optic atrophy 1,OPA1)[5-6]。線粒體分裂異常可導致多種疾病的發生[7-9]。α-突觸共核蛋白(α-synuclein,α-syn)的氧化損傷被認為是PD的重要發病機制之一[10-11]。有學者研究發現線粒體分裂融合異常可能導致α-syn的氧化損傷,從而參與PD的發生發展[12]。然而,關于線粒體分裂融合異常參與PD進展的具體分子機制尚未研究。本研究從調控線粒體分裂融合的具體分子出發,探究其在PD中的作用及初步機制,并以此為靶點進行干預,為開發治療PD的藥物進行初步探索。
1 材料與方法
1.1 試劑 6-羥基多巴胺(6-hydroxydopamine,6-OHDA)(上海容創生物技術有限公司,貨號RKY2061);阿樸嗎啡(apomorphine,APO)(美國Sigma公司,貨號A4393);美多巴(上海羅氏制藥有限公司,批準文號:國藥準字H10930198);線粒體分裂抑制劑1(mitochondrial division inhibitor 1,Mdivi-1)(美國Sigma公司,貨號M0199);SYBR Green Master Mix試劑盒(日本TAKARA公司,貨號RR820A);抗酪氨酸羥化酶抗體(英國Abcam公司,貨號ab112);免疫組化試劑盒(北京中杉金橋公司,貨號SP-9000-110ml);超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒(上海信裕生物科技有限公司,貨號XY-1560);丙二醛(malondialdehyde,MDA)檢測試劑盒(美國Sigma公司,貨號MAK085);還原型谷胱甘肽(glutathione,GSH)檢測試劑盒(美國Sigma公司,貨號CS0260);谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)檢測試劑盒(美國Sigma公司,貨號CGP1);一氧化氮(nitric oxide,NO)檢測試劑盒(美國Biovision公司,貨號K252-200);一氧化氮合酶(nitric oxide synthase,NOS)檢測試劑盒(臺灣Abnova公司,貨號KA1345)。
1.2 儀器 實時定量PCR儀(美國伯樂公司,型號CFX 384);腦立體定位儀(成都儀器廠,型號ST-5ND-C);Panlab旋轉記錄儀(美國Harvard Apparatus公司,型號LE902);轉棒疲勞儀(北京金洋萬達科技有限公司,型號JY-YLS-4C);顯微鏡(日本奧林巴斯奧林巴斯公司,型號SZ51);酶標儀(美國伯樂公司,型號iMark)。
1.3 實驗動物分組和處理 將周齡6~8周、體質量220~240 g的SPF級大鼠[許可證號:SCXK(陜)2018-001]隨機分為對照組(生理鹽水組)、模型組、Mdivi-1組和美多巴組,每組6只。Mdivi-1組給予Mdivi-1 50 mg/(kg·d),美多巴組給予美多巴 50 mg/(kg·d),模型組、對照組給予相同劑量的0.5%羧甲基纖維素鈉水溶液(灌胃給藥),給藥6周,1/d。
1.4 PD大鼠模型制備方法 將大鼠采用劑量為3.5 mL/kg水合氯醛麻醉后,利用腦定位儀固定大腦,消毒后手術切開充分暴露前囟。參照Paxinos等方法確定的腦圖譜,并按照Liu等[13]提供的方法對紋狀體三點進行注射。每點用微量注射器緩慢注射6-OHDA(濃度為4 g/L,母液為含0.02%抗壞血酸的生理鹽水)1.0 μL,結束后針頭繼續放置5 min。待針頭緩慢拔出后縫合切口并預防感染。對照組采用上述方法注射相同劑量的生理鹽水。術后第5周,采用APO(0.5 mg/kg)皮下注射的方法誘發大鼠旋轉并記錄從開始到30 min內旋轉的圈數。將向損傷側旋轉的圈數與向健側旋轉的圈數差值大于80 r/h的視為造模成功。
1.5 PD大鼠行為學觀察 在注射APO第3周和第6周后,分別觀察和記錄30 min內大鼠向健側旋轉的圈數。同時,采用旋轉棒實驗觀察大鼠術后第3和第6周的行為學變化。將大鼠置于旋轉棒上,旋轉棒啟動后立即計時。大鼠為穩定在旋轉棒上需不斷轉動,隨著旋轉棒加速,大鼠最終從旋轉棒上掉下,結束計時。
1.6 ELISA法檢測氧化應激相關指標 大鼠安樂死后,取出腦組織,將紋狀體和中腦黑質區域剝離并稱重,放于生理鹽水中,制成終濃度為10%的勻漿液。在3 000 r/min條件下離心后小心吸取上清液為待測樣品。采用商品化的試劑盒,按照操作說明步驟分別檢測SOD、過氧化氫酶(catalase,CAT)、GSH-Px、NOS活性和MDA、GSH、NO含量。
1.7 實時定量PCR檢測線粒體分裂融合相關分子 取出各組腦組織的紋狀體和中腦后,按照組織RNA提取試劑盒說明書步驟提取RNA,反轉錄成cDNA。采用實時定量PCR法檢測DRP1、FIS1、MFF、MFN1、MFN2和OPA1的mRNA表達水平。以GAPDH為內參,每個樣品設3個復孔。所用引物分別如下:DRP1,F:5′-CGTAGTGGGAACGCAGAG-3′和R:5′-ACAGGCACCTTGGTCATT-3′;FIS1,F:5′-AAAGGGAGCAAGGAGGAA-3′和R:5′-GGAGAACAGGGAAAGGACA3′;MFF,F:5′-ACATGCGCATTGGAGCAGTA-3和R:5′-GCCCCACTCACCAAATGAGA-3′;MFN1,F:5′-GTTTTTCCCTGGGCTGGTCT-3′和R:5′-CTCCTTGGCATGGGTGGTC-3′;MFN2,F:5′-GGGACCGCATCTTCTTTG-3′和R:5′-GTCTTGCCGCTCTTCACG-3′;OPA1,F:5′-TCATGGATCCGAAAGTGACA-3′和R:5′-ATCCTTCTGCAGCACCAACT-3′。
1.8 免疫組化檢測大鼠腦組織酪氨酸羥化酶(tyrosine hydroxylasez,TH)表達 將大鼠處死后取出腦組織后制成冰凍切片。放入0.3% Triton X-100溶液中處理30 min。在3%的H2O2中封閉15 min,在山羊血清中封閉20 min,加入TH一抗(1∶200稀釋)溶液4 ℃孵育過夜。山羊抗鼠二抗孵育20 min,辣根酶標記的鏈霉卵白素孵育30 min。DAB顯色后,蘇木素復染,梯度酒精脫水,二甲苯透明后封片。根據TH染色強度,分析并統計黑質區TH陽性細胞數和紋狀體區TH陽性纖維密度。
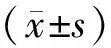
2 結果
2.1 PD大鼠模型制備成功 與對照組相比,模型組在術后第5周給予APO誘導后旋轉圈數顯著增多(P<0.05),對照組則無明顯旋轉。同時轉棒實驗顯示模型組在轉棒上的停留時間顯著短于對照組(P<0.05),表明PD大鼠模型制備成功,表1、表2。

表1 APO誘導大鼠旋轉圈數改變

表2 APO誘導大鼠轉棒停留時間改變
2.2 PD大鼠線粒體分裂融合相關分子表達 進一步實時定量PCR結果顯示,模型組大鼠腦組織中線粒體分裂關鍵調控因子DRP1的mRNA表達水平顯著高于對照組(P<0.001),而其他線粒體分裂相關分子FIS1及MFF,融合相關分子MFN1、MFN2及OPA1的表達未見明顯變化(圖1)。

圖1 實時定量PCR檢測APO誘導大鼠線粒體分裂融合相關分子表達
2.3 DRP1抑制劑Mdivi-1對PD大鼠行為學影響與模型組比較,經過Mdivi-1處理后第3周及6周,大鼠的旋轉圈均數顯著減少(P<0.05),同時,經美多巴處理后第3周及6周大鼠的旋轉圈數均較模型組顯著減少,但略高于Mdivi-1組(P<0.05,表3)。旋轉棒實驗結果顯示Mdivi-1組及美多巴組在給藥后第3周及6周停留在旋轉棒上的時間均長于模型組(P<0.05,表4)。

表3 Mdivi-1對APO誘導大鼠旋轉圈數改變
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05

表4 Mdivi-1對APO誘導大鼠轉棒停留時間改變
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
2.4 DRP1抑制劑Mdivi-1對PD大鼠腦組織內TH表達影響 與對照組相比,模型組的大鼠腦組織左右兩側黑質的TH陽性細胞數都顯著減少(P<0.05),同時左右兩側紋狀體中TH陽性纖維密度與對照組比較也都顯著降低(P<0.05)。采用Mdivi-1及美多巴處理后第3周和6周,該組大鼠左右兩側黑質TH陽性細胞數均較模型組增多(P<0.05),左右兩側紋狀體中TH陽性纖維密度均高于模型組(P<0.05)。表5、表6。

表5 Mdivi-1對大鼠黑質TH表達影響
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05

表6 Mdivi-1對大鼠紋狀體TH表達影響
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
2.5 DRP1抑制劑Mdivi-1對PD大鼠SOD,GSH-Px,CAT,NOS活性和MDA,GSH,NO含量的影響 模型組中損傷側的黑質和紋狀體中SOD、GSH-Px和CAT活性顯著低于對照組;同時NOS的表達以及MDA、GSH、NO含量顯著上升(P<0.05)。Mdivi-1組和美多巴組在處理3周后,大鼠損傷側的黑質和紋狀體中SOD、GSH-Px、GSH和CAT活性均顯著高于模型組(P<0.05),而NOS的表達均顯著下降,同時MDA、NO含量均較模型組顯著下降(P<0.05)。表7、表8。

表7 Mdivi-1對大鼠黑質中SOD、GSH-Px、CAT、NOS活性和MDA、GSH、NO含量的影響
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05

表8 Mdivi-1對大鼠紋狀體中SOD、GSH-Px、CAT、NOS活性和MDA、GSH、NO含量影響
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05
3 討論
目前研究認為氧化應激在PD發病過程中起著非常重要作用[14],而線粒體是產生氧自由基的主要細胞器,因此線粒體異常與PD發病的相關性研究已成為該領域的熱點[15-16]。線粒體分裂融合是調控線粒體結構與功能的重要方式。因此,干預線粒體分裂融合有望成為治療PD的重要手段。但到目前為止,關于線粒體分裂融合異常與PD的發生進展尚未進行系統研究。此前,Bido等[17]利用病毒,使大鼠人類A53T-α-突觸共核蛋白(human A53T-α-synuclein,hA53T-α-syn)過表達并注射Mdivi-1,結果顯示,Mdivi-1可阻止DA的減少以及hA53T-α-syn所引起的神經毒性作用,而且Mdivi-1有抑制α-syn氧化應激的作用。而本研究利用6-OHDA注射單側紋狀體方法建立PD大鼠模型。對PD大鼠模型的行為學進行觀察,并通過DA受體激動劑APO誘發的旋轉實驗和轉棒實驗作為判斷PD大鼠模型是否構建成功的標準[18]。本研究發現,PD大鼠模型組在APO誘導后出現明顯的旋轉,且該組大鼠在轉棒上停留時間顯著縮短。同時通過免疫組化實驗發現,PD大鼠黑質中TH陽性細胞比例顯著下降,在紋狀體中TH陽性表達纖維的數量顯著減少,與PD的病理特征相符。這表明我們利用6-OHDA注射單側紋狀體的方法成功構建PD大鼠模型,在此模型基礎上可進行下一步研究。
在PD大鼠模型組,利用實時定量PCR檢測線粒體分裂融合相關分子的表達變化。線粒體分裂關鍵調控分子DRP1在PD大鼠腦組織中的表達顯著高于正常對照組。本研究初步提示線粒體分裂關鍵調控分子異常增多可能在PD發生進展中扮演重要角色。本研究以DRP1為切入點,探究干預DRP1后能否改善PD大鼠多巴胺能神經元受損狀況。
Mdivi-1是一種小分子化合物,是DRP1的有效抑制劑。本研究根據上述結果,采用Mdivi-1抑制DRP1后,觀察其對6-OHDA誘導的PD大鼠模型的干預效果,并將實驗結果與已知PD治療藥物美多巴進行比對,初步探討其可能的機制。本研究發現,Mdivi-1組與美多巴組的實驗結果相似,都可顯著改善PD大鼠的行為學特征。例如PD大鼠模型組在Mdivi-1處理后,可顯著減輕APO誘發的旋轉圈數,同時大大延長PD大鼠在旋轉棒上停留的時間。此外,經過Mdivi-1干預后,PD大鼠腦組織黑質中TH陽性細胞數目和紋狀體中TH陽性染色纖維密度較未干預PD組顯著增加。本研究表明Mdivi-1可對6-OHDA注射法誘導的PD大鼠多巴胺神經元有著重要的保護作用。
線粒體是氧化應激的重要場所[19],氧化應激已是公認的PD重要病因之一[20]。本研究從氧化應激角度初步探索Mdivi-1顯著改善PD大鼠受損的多巴胺能神經元的機制。在6-OHDA引發的PD大鼠黑質及紋狀體中,抗氧化酶系統活性如SOD、GSH-Px、CAT顯著降低,同時抗氧化物質GSH含量降低,導致氧自由基如MDA和NO含量升高,且增強NOS的表達水平,表明機體抗氧化系統異常,機體處于氧化應激狀態。而對Mdivi-1處理后的PD大鼠黑質和紋狀體中的抗氧化酶系統活性以及相關物質含量檢測后發現,SOD、GSH-Px、CAT和GSH活力顯著提高,MDA和NO含量明顯降低,與美多巴實驗結果相近,同時NOS的表達降低,與美多巴組實驗結果相近。本研究表明Mdivi-1可顯著提高6-OHDA誘發的PD大鼠抗氧化能力。
綜上,DRP1抑制劑Mdivi-1可顯著修復PD大鼠受損的多巴胺能神經元,改善PD癥狀,且提高機體的抗氧化能力。這表明Mdivi-1具有保護6-OHDA誘發的PD大鼠神經元功能,且這種功能可能與增強其抗氧化能力有關。進一步研究Mdivi-1修復多巴胺能神經元和對抗氧化應激的機制,對探索治療PD的新方法具有重要意義。

