睡眠時相相關阻塞性睡眠呼吸暫停對急性腦梗死患者睡眠結構及預后的影響
陳沁,李潔,毛成潔,沈赟,傅翔,劉昱璐,劉春風,2
約72%急性卒中患者合并睡眠呼吸障礙,其中OSA與急性腦梗死(acute ischemic stroke,AIS)有密切關系[1-3]。OSA是腦梗死的一項獨立危險因素[4]。本課題組既往研究顯示,AIS患者總睡眠時間減少、睡眠效率降低,合并OSA時淺睡眠l期延長、深睡眠縮短,出院3個月mRS評分顯著高于不合并OSA的AIS患者[5]。近期一項研究發現,非快動眼睡眠(non-rapid eye movement,NREM)期相關OSA更為嚴重,其冠狀動脈疾病發病率也高于REM期相關OSA[6]。REM期相關OSA和NREM期相關OSA是否對腦梗死患者睡眠結構和預后存在不同的影響,這方面的研究較少。因此,本研究通過觀察AIS患者睡眠情況、情緒、認知、梗死部位及預后,探討REM期相關OSA和NREM期相關OSA對AIS患者睡眠結構和預后的影響。
1 研究對象與方法
1.1 研究對象 本研究為回顧性研究,收集2011年2月-2018年8月于蘇州大學附屬第二醫院就診的AIS患者。入選標準:①發病7 d以內;②年齡≥18歲;③符合《中國急性缺血性卒中診治指南2014》的診斷標準,明確診斷為AIS的患者;④病情穩定,可配合完成量表評分和PSG。排除標準:①并發肺部感染等急性疾病或生命體征不穩定、需行去骨瓣減壓術等;②有嚴重認知功能障礙無法配合檢查或拒絕配合檢查;③有OSA相關手術或呼吸機治療史;④有嚴重心、肝、腎疾患或合并其他軀體疾病(如帕金森病、肌張力障礙等);⑤關鍵數據缺失的病例。
1.2 一般資料收集 基線資料包括年齡、性別、受教育年限、高血壓、糖尿病、血脂異常、既往腦血管病史、冠狀動脈粥樣硬化性心臟病、心房顫動、吸煙、飲酒史,發病至入院的時間及靜脈溶栓或血管內治療的情況等。發病前吸煙>10支/天并持續1年以上者,認為存在吸煙史。將12.5 g酒精界定為1杯,發病前男性每周飲酒≥14杯,女性每周飲酒≥7杯,并持續1年以上者,即認為有飲酒史。
1.3 頭顱磁共振檢查 在腦梗死發病一周內完成頭顱MRI檢查,明確新發梗死病灶部位,并將其分為大腦半球、間腦、小腦和腦干等部位,由神經科專科醫師根據患者臨床表現確定責任病灶。
1.4 情緒及認知評價 患者進行PSG前應用焦慮自評量表(self-rating anxiety scale,SAS)、漢密爾頓焦慮量表(Hamilton anxiety scale,HAMA)、抑郁自評量表(self-rating depression scale,SDS)、漢密爾頓抑郁量表(Hamilton depression scale,HAMD)評估患者焦慮和抑郁情況,應用MMSE、MoCA評估患者認知功能。
1.5 睡眠量表、多導睡眠監測及患者分組 使用Epworth嗜睡量表(Epworth sleep scale,ESS)評價患者日間嗜睡情況,使用疲勞嚴重度量表(fatigue severity scale,FSS)、疲勞量表-14(fatigue scale-14,FS-14)評估患者疲勞程度,使用匹茲堡睡眠質量指數(Pittsburgh sleep quality index,PSQI)評價患者睡眠質量。應用美國偉康公司的Alice4和泰科公司Sandman Elite多導睡眠采集分析系統進行睡眠呼吸監測。監測項目包括腦電圖、下頜肌電圖、眼動電圖、熱敏及壓力式口鼻氣流、胸腹運動、血氧飽和度、心電圖、腿動、體位。所有數據均根據2007版美國睡眠醫學學會標準進行人工評判[7]。記錄AHI、氧減指數、總睡眠時間、睡眠效率、NREM時間和百分數[分為NREM1、NREM2、慢波睡眠(slow wave sleep,SWS)]、REM時間和百分數、睡眠潛伏期及REM睡眠潛伏期、夜間最低血氧飽和度、血氧飽和度<90%的比例、呼吸相關微覺醒(次/小時)、最長呼吸暫停時間等情況。監測前禁煙酒≥24 h,隔夜禁食12 h,記錄時間≥7 h。
根據患者總睡眠期、REM和NREM期睡眠AHI,將患者分為單純腦梗死組(AIS,AHI<5次/小時)、腦梗死合并REM期相關OSA組(AIS+REM相關OSA,AHI≥5次/小時且REMAHI/NREM-AHI>2)和腦梗死合并NREM期相關OSA組(AIS+NREM相關OSA,AHI≥5 次/小時且REM-AHI/NREM-AHI≤2)[8]。
1.6 腦梗死分型、神經功能缺損、治療及預后評價 根據牛津郡社區卒中計劃(Oxfordshire community stroke project,OCSP)卒中分型,將腦梗死患者分為完全前循環、部分前循環、后循環和腔隙性梗死。用NIHSS評分評價腦梗死患者入院時、入院48 h及出院時神經功能缺損程度,采用mRS評估腦梗死患者出院時及出院3個月的日常生活自理能力。
1.7 統計學方法 所得數據均使用SPSS 21.0軟件統計處理。符合正態分布的計量資料用表示,組間比較采用單因素方差分析,采用LSD檢驗進行兩兩比較,非正態分布的資料用中位數M(Q1~Q3)表示,均數比較采用非參數檢驗。分類變量資料用百分比表示,無序分類資料組間比較采用Pearson卡方檢驗或Fisher確切概率檢驗,兩組間的比較采用χ2分割檢驗。等級資料多組間比較采用非參數檢驗,兩組間比較采用Kruskal-Wallis H檢驗。采用Spearman等級相關檢驗與出院3個月mRS評分相關的臨床指標;先進行單因素分析,因變量為預后良好(出院3個月mRS評分<3分)與預后不良(出院3個月mRS評分≥3分),自變量為患者的臨床資料,篩選出有統計學意義的變量,再進行多因素Logistic回歸分析。所有檢驗均采用雙側檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 一般資料及腦梗死危險因素的比較 根據入選標準及排除標準,研究期間共有119例腦梗死患者完成PSG,其中數據缺失的有9例,最終共納入110例,其中男性92例(83.6%),女性18例(16.4%),年齡平均(59±11.9)歲,范圍29~82歲,輕型卒中(入院時NIHSS評分≤4分)有98例(89.1%),非輕型卒中(入院時NIHSS評分>4分)有12例(10.9%)。AIS組30例(27.3%),AIS+REM相關OSA組15例(13.6%),AIS+NREM相關OSA組65例(59.1%)。3組之間在性別、年齡、受教育時間、高血壓、糖尿病、既往腦血管病史、冠狀動脈粥樣硬化性心臟病、心房顫動、血脂異常、吸煙、飲酒、腦梗死發病至入院時間、入院NIHSS評分、溶栓或血管內治療、OCSP分型方面差異均無統計學意義,腦梗死合并NREM期相關OSA組BMI顯著高于單純腦梗死組(P=0.011),AIS組病灶部位多位于大腦半球,AIS+REM相關OSA組病灶依次位于腦干、大腦半球、間腦,差異具有統計學意義(P<0.001)(表1)。
2.2 睡眠質量、睡眠結構及情緒、認知的比較 在睡眠質量及情緒、認知方面,3組在PSQI、ESS、FSS、FS-14(包括軀體疲勞和腦力疲勞)、SAS、HAMA、SDS、HAMD、MMSE和MoCA分值上均無統計學差異(表2)。
在睡眠結構方面,3組的NREM1期時間及比例、SWS比例、AHI、呼吸暫停最長持續時間、氧減指數、血氧低于90%的比例、最低血氧飽和度、微覺醒指數、呼吸相關微覺醒指數、REM呼吸相關微覺醒指數、NREM呼吸相關微覺醒指數、自發相關微覺醒指數、NREM自發相關微覺醒指數整體差異均有統計學意義。
與AIS組相比,AIS+REM相關OSA組AHI(P<0.001)、氧減指數(P=0.007)、血氧低于90%的比例(P=0.001)、呼吸相關微覺醒指數(P=0.038)尤其是REM呼吸相關微覺醒指數(P=0.002)更高,呼吸暫停最長持續時間更長(P<0.001),最低血氧飽和度更低(P=0.001),差異均具有統計學意義(表3)。
與AIS組相比,AIS+NREM相關OSA組NREM1期睡眠時間(P=0.003)及比例(P=0.005)、AHI(P<0.001)、氧減指數(P<0.001)、血氧低于90%的比例(P<0.001)、微覺醒指數(P<0.001)、呼吸相關微覺醒指數(P<0.001)包括REM微覺醒指數(P<0.001)和NREM微覺醒指數(P<0.001)更高,呼吸暫停最長持續時間更長(P<0.001),SWS時間(P=0.027)及比例(P=0.008)、最低血氧飽和度(P<0.001)更低,差異均有統計學意義(表3)。
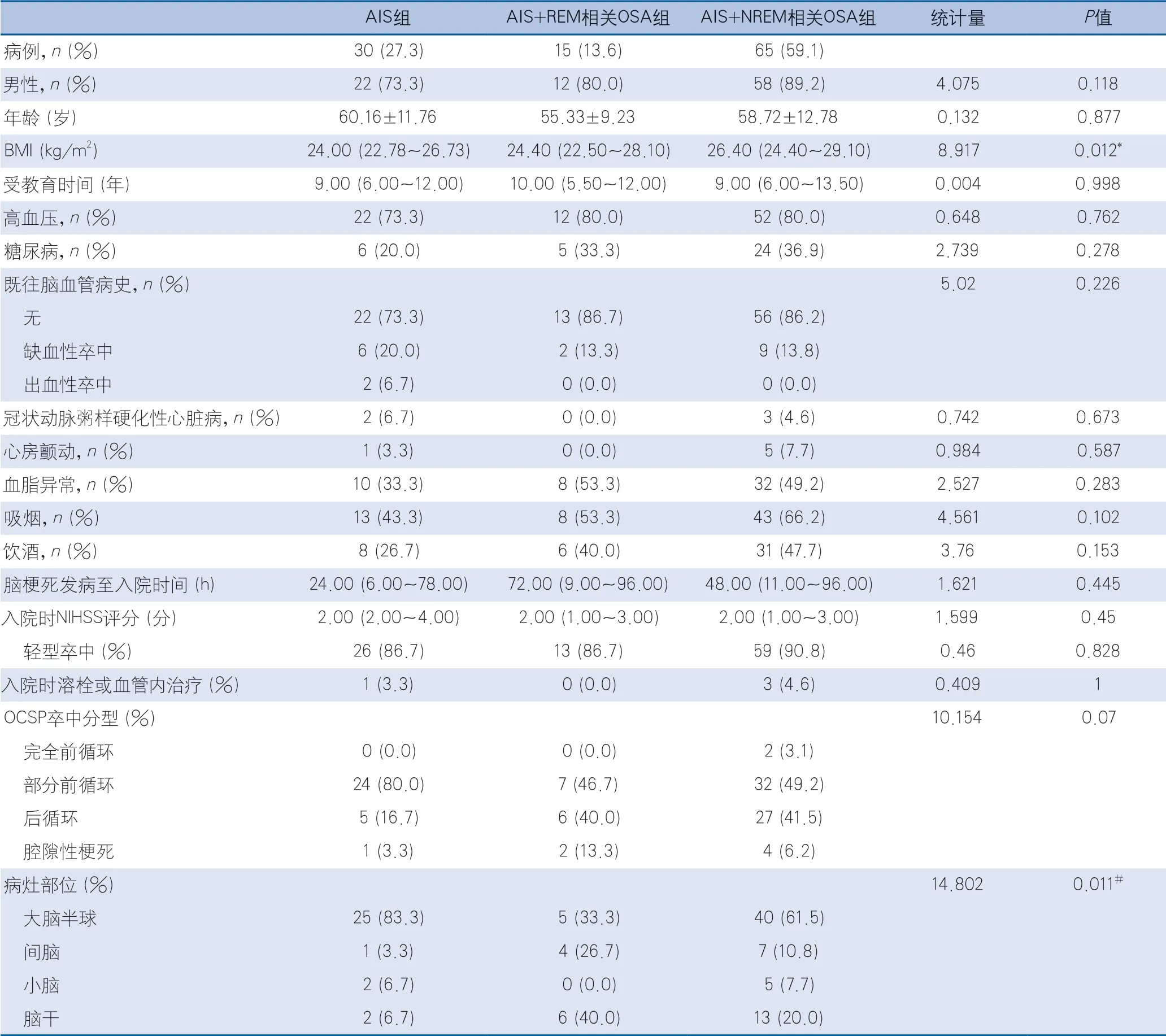
表1 3組基線資料比較
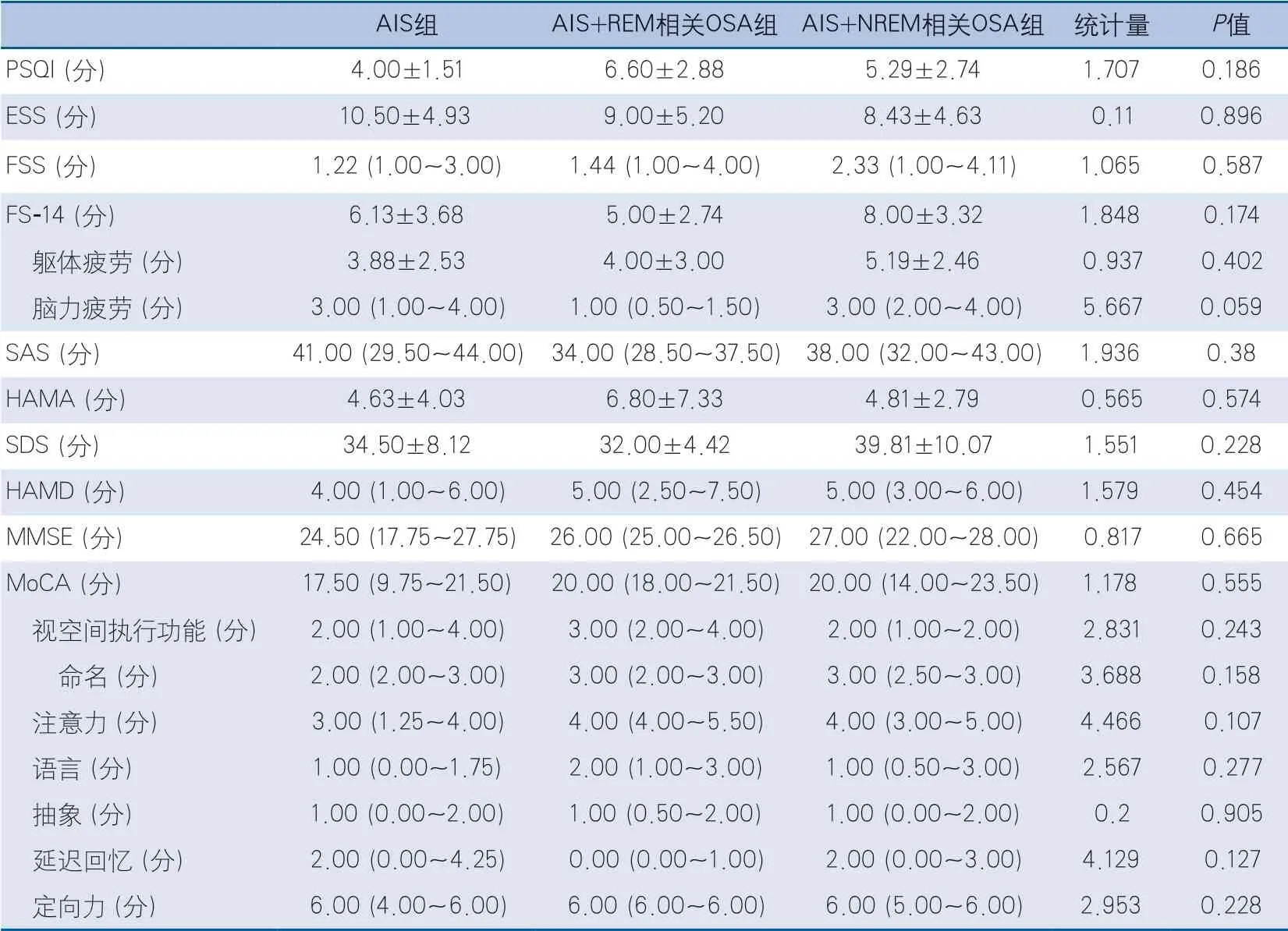
表2 3組睡眠質量、情緒及認知比較
與AIS+REM相關OSA組相比,AIS+ NREM相關OSA組微覺醒指數(P<0.001)、呼吸相關微覺醒指數(P=0.003)尤其是NREM呼吸相關微覺醒指數(P<0.001)、自發相關微覺醒指數(P=0.030)尤其是NREM自發相關微覺醒指數(P=0.014)更高,差異均具有統計學意義(表3)。
3組在總睡眠時間、睡眠潛伏期、REM潛伏期、睡眠效率、NREM2期睡眠時間及比率、REM期睡眠時間及比率、平均血氧飽和度、覺醒次數、REM自發相關微覺醒指數、腿動相關微覺醒指數和周期性腿動相關微覺醒指數方面差異均無統計學意義(表3)。
2.3 急性腦梗死預后情況 3組在入院后48 h NIHSS評分、出院NIHSS評分、出院mRS評分方面均無統計學意義。隨訪3個月預后,3組在出院3個月mRS評分差異無統計學意義(表4)。
2.4 腦梗死預后與各項臨床指標之間的相關性分析 Spearman等級相關分析提示出院3個月mRS評分與入院時溶栓或血管內治療(r=0.189,P=0.047)、入院時NIHSS評分(r=0.326,P=0.001)、AHI(r=0.324,P=0.001)、REM-AHI(r=0.262,P=0.006)、NREM-AHI(r=0.299,P=0.002)、氧減指數(r=0.237,P=0.013)、呼吸相關微覺醒指數(r=0.195,P=0.041)尤其是NREM呼吸相關微覺醒指數(r=0.196,P=0.040)、MoCA中命名分值(r=0.399,P=0.019)呈正相關。與年齡、性別、BMI、受教育時間、高血壓、糖尿病、既往腦血管病史、冠狀動脈粥樣硬化性心臟病、心房顫動、吸煙、飲酒、血脂異常、PSQI、ESS、FSS、FS-14、SAS、HAMA、SDS、HAMD、MMSE、總睡眠時間、睡眠效率、睡眠潛伏期、REM潛伏期、各期睡眠時間及比率、平均血氧飽和度、最低血氧飽和度、血氧低于90%的比例、呼吸暫停最長持續時間、覺醒次數、自發相關微覺醒、腿動相關微覺醒、周期性腿動相關微覺醒、腦梗死發病至入院時間、OCSP分型、病灶部位無顯著相關性。
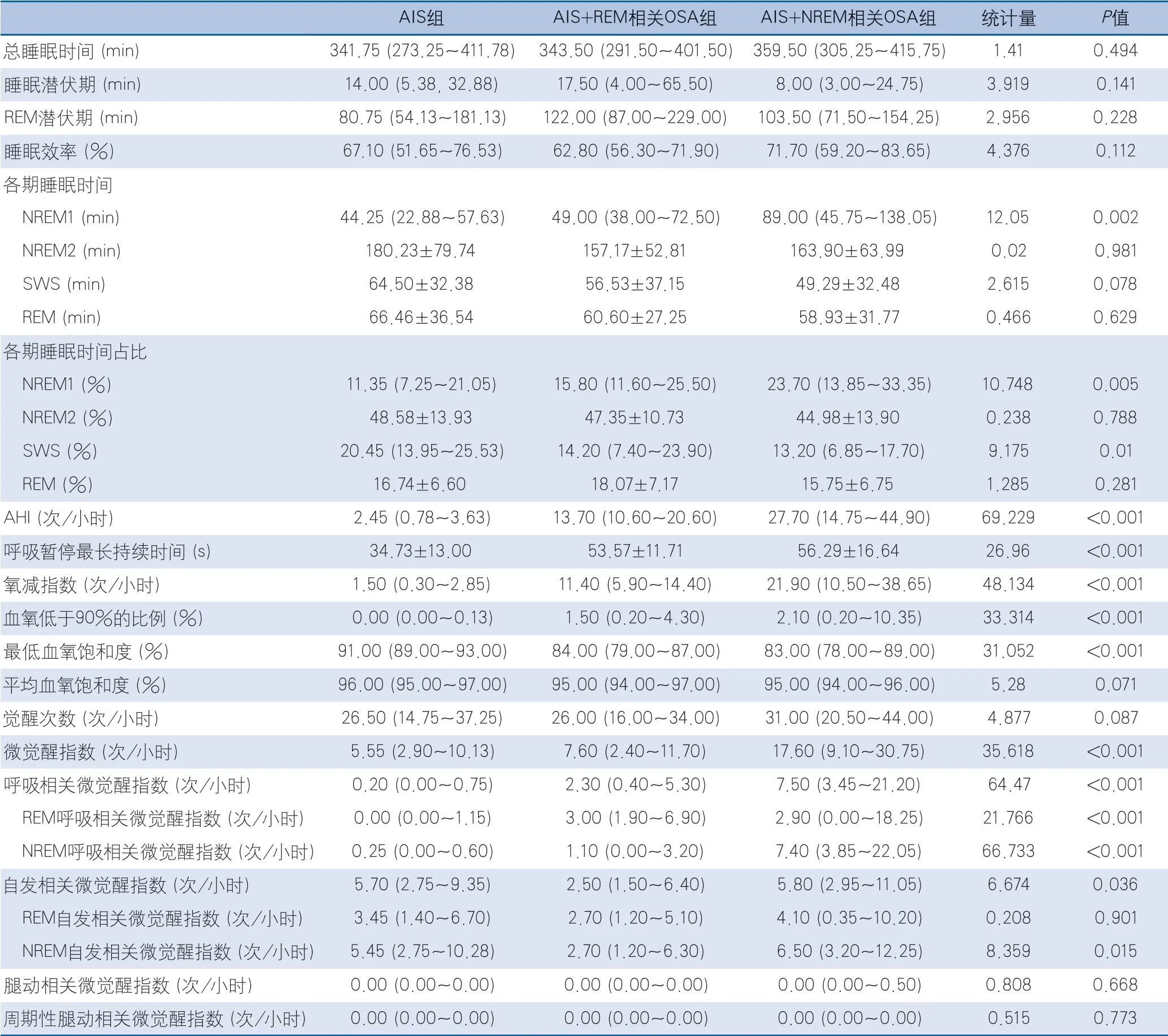
表3 3組睡眠結構比較
2.5 腦梗死預后與各項臨床指標之間的Logistic回歸分析結果 先進行單因素分析,結果顯示3個月預后良好101例(91.8%),預后不良9例(8.2%),3個月預后良好患者受教育時間[10.00(6.00~12.00)年 vs 4.50(2.25~7.50)年,P=0.017]、入院時NIHSS評分[2.00(1.00~3.00)vs 5.00(3.00~10.50),P=0.001]、BMI[25.60(23.50~27.85)kg/m2vs 28.60(26.75~30.90)kg/m2,P=0.006]、REM-AHI[10.80(0.80~34.40)vs 26.60(15.50~50.40),P=0.046]、睡眠潛伏期[10.50(4.00~30.75)min vs 1.00(0~27.25)min,P=0.023]的影響。將上述單因素分析有相關性的臨床指標納入Logistic回歸分析,結果顯示入院時NIHSS評分(OR 1.655,95%CI 1.114~2.459,P=0.013)、受教育時間(OR 0.564,95%CI 0.357~0.892,P=0.014)和BMI(OR 1.586,95%CI 1.058~2.376,P=0.025)是腦梗死患者不良預后的獨立危險因素。
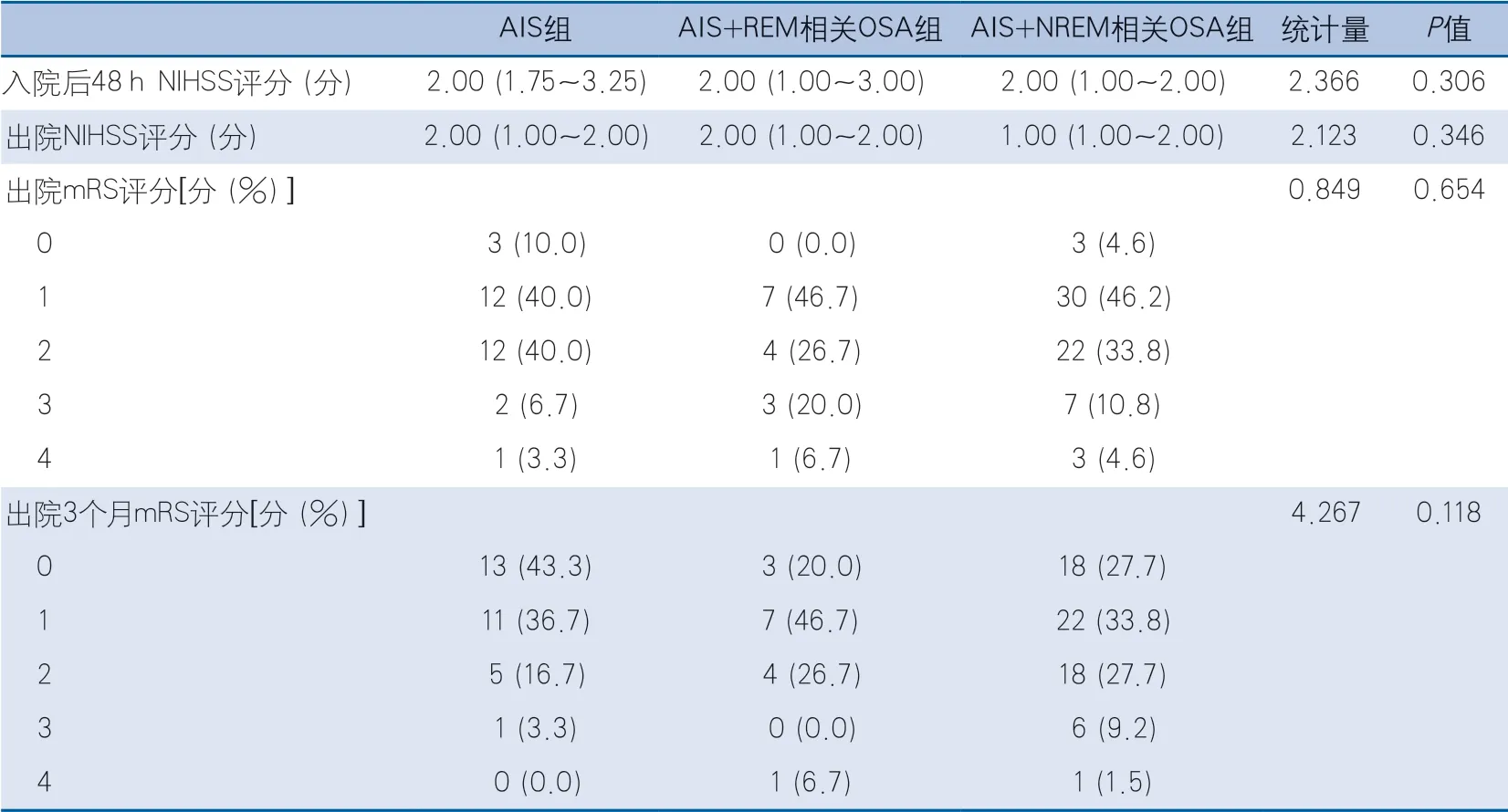
表4 3組腦梗死發病及預后情況比較
3 討論
本研究110例腦梗死患者OSA發生率為72.7%,與既往研究相符[1]。但并非所有合并OSA的腦梗死患者都有特征性的OSA臨床表現,如肥胖、日間嗜睡等,這可能導致OSA的臨床檢出率和治療率偏低[9]。
多項研究發現,腦梗死患者易出現睡眠結構紊亂、晝夜節律障礙等一系列睡眠問題。目前針對腦梗死患者睡眠結構的研究發現,額葉梗死引起深睡眠縮短,顳葉病灶主要影響NREM2期和REM期睡眠,腦橋病灶影響REM期睡眠,丘腦病灶可引起患者NREM1期延長、SWS縮短[10-12]。并有研究發現REM潛伏期與腦梗死患者預后相關[13]。合并OSA的腦梗死患者睡眠結構亦不同于單純腦梗死患者,其淺睡眠l期延長、深睡眠縮短,但較少有對合并REM期和NREM期相關OSA的腦梗死患者睡眠結構的研究[5]。本研究發現,合并REM期相關OSA的腦梗死患者與單純腦梗死患者相比,睡眠結構無明顯變化,但合并NREM期相關OSA的腦梗死患者具有更高的BMI指數,淺睡眠1期延長,深睡眠縮短,與合并OSA的腦梗死患者睡眠特點相同,提示OSA引起的腦梗死患者睡眠結構變化可能主要是由NREM期引起,而非既往研究重點關注的REM期。REM期只占總睡眠時間的一小部分,而且NREM期丘腦與皮質傳入減少可能引起覺醒閾值升高,導致患者OSA癥狀更為嚴重[14]。NREM期不僅存在呼吸暫停和低通氣,還存在長時間的呼吸道部分阻塞,雖然呼吸道部分阻塞不足以造成呼吸暫停或低通氣,但其對腦梗死患者睡眠結構和預后的影響目前還缺乏相關研究[15]。
腦梗死患者睡眠的另一特點是睡眠碎片化,PSG表現為覺醒指數增高,睡眠碎片化又與老年人動脈粥樣硬化和皮質下梗死密切相關[16-17]。本研究發現合并NREM期相關OSA的腦梗死患者睡眠碎片化比合并REM期相關OSA的腦梗死患者更嚴重,前者梗死部位集中于大腦半球,但本研究未將梗死病灶分為皮質或皮質下病灶,有待今后進一步研究。此外,在腦梗死預后的相關性分析中,呼吸相關微覺醒指數,尤其是NREM呼吸相關微覺醒指數與腦梗死患者出院3個月mRS評分正相關,這更說明了OSA對腦梗死患者預后的影響可能更多是由于NREM期所致。在大鼠的研究顯示睡眠剝奪會增加腦梗死鼠的梗死面積并加重腦梗死鼠的預后[18-19]。而腦梗死前睡眠剝奪對腦梗死是一種保護性因素,猜測可能是因為梗死前睡眠剝奪在停止后睡眠時間延長,尤其是SWS延長,有助于腦梗死的恢復所致,機制可能包括睡眠剝奪減輕炎癥反應及缺血性細胞凋亡、并促使神經膠質細胞分泌炎癥因子減少等有關[20-23]。故NREM期腦梗死患者微覺醒增多導致睡眠碎片化不利于腦梗死患者恢復,從而導致患者預后較差。
既往研究顯示腦梗死的病灶部位和OSA之間并無明顯相關性[24]。但本研究發現合并REM期相關OSA的腦梗死患者梗死病灶多位于腦干。腦干是REM期睡眠的發生部位,其中延髓腹側γ-氨基丁酸能神經元在REM期睡眠的起始和維持起重要作用,興奮性谷氨酸能神經元能抑制REM期睡眠,促進NREM期睡眠[25-26]。OSA是由氣道解剖性因素和上氣道神經肌張力異常共同造成,腦干舌下神經周圍的中間神經元可以通過調節時相依賴性去甲腎上腺素和5-羥色胺而控制舌下運動神經元的興奮性,腦干病變時可能導致REM期上氣道神經肌張力下降而促進了OSA發生,舌下神經中間神經元群體可能成為未來睡眠呼吸疾病治療的新靶點[27-29]。
本研究未觀察到REM期與NREM期相關OSA與腦梗死患者預后的差異,這可能與本研究需完成相關量表測評及PSG檢查,需要患者較高的配合度,故入組的腦梗死患者以輕型卒中(89.1%)為主有關,患者發病時NIHSS評分及mRS評分均偏低,3個月后臨床癥狀改善可能不足以引起評分改變。且本研究隨訪時間較短,仍需更長時間的隨訪以明確患者神經功能的恢復情況及有無心腦血管事件再發。此外,流行病學研究發現NREM期相關OSA患者男性占比高,本研究納入的男性患者占83.6%,REM期相關OSA患者占所有OSA患者的18.8%,低于在非腦梗死人群中報道的32.9%~36.7%[8,30-31]。但本研究未發現男性和女性在REM期相關OSA發病率的差異,與既往研究相符,也未發現性別與腦梗死預后的相關性[8]。
在Logistic回歸分析中,入院時NIHSS評分、受教育時間和BMI是影響腦梗死患者預后的獨立危險因素。入院時NIHSS評分較高的患者入院時神經功能缺損癥狀更嚴重,預后較差。既往有研究發現受教育程度低的患者腦梗死發病率高,但與其3個月后的生活質量無明顯相關性[32-33]。本研究發現,受教育程度高的腦梗死患者預后較好,可能是因為高學歷患者依從性更好,能配合進行規范卒中二級預防和康復訓練,而受教育程度較低的患者可能同時會存在理解和執行功能障礙,對其二級預防的依從性及康復訓練造成一定的影響,從而影響腦梗死患者功能預后。目前關于腦梗死與BMI的研究存在不一致的結論,BMI升高會增加腦梗死的發病率,加重缺血損傷[34-35]。但也有研究指出,腦梗死患者日常生活的獨立性與其基線活動習慣相關而并非BMI,高BMI甚至可能是腦梗死患者全因死亡和卒中再發的一項保護性因素,此種現象被稱為“肥胖悖論”,其機制目前未被完全闡明,可能的機制是肥胖患者對慢性炎性反應產生耐受,在腦梗死發生時所產生的炎性損傷較正常體重患者小[36-38]。
本研究仍有一些不足之處,除上述入組患者多是輕型卒中、性別比例不平衡和隨訪時間偏短外,樣本量也有待擴充。本研究為回顧性研究,患者進行PSG檢測時間跨度過長,混雜因素難以控制。關于合并不同睡眠時相OSA的腦梗死患者短期預后情況及預后是否獲益于睡眠干預仍需進一步研究加以明確。
【點睛】本研究對合并REM期及NREM期腦梗死患者的睡眠結構及預后進行了分析,結果顯示NREM期相關OSA會改變腦梗死患者的睡眠結構,使其淺睡眠1期延長,深睡眠縮短,睡眠片段化,此種改變可能會導致腦梗死患者預后更差。

