子宮托細胞毒性試驗兩種方法的比較
刁立琴 康莉 付釗 高保栓 韓婷 河北省醫療器械與藥品包裝材料檢驗研究院 (河北石家莊 050061)
內容提要:目的:比較兩種細胞毒性試驗方法對子宮托細胞毒性評價的差異。方法:GB/T14233.2-2005的MTT法和GB/T 16886.5-2017的MTT法。結果:RGR分別為13%和75%。結論:細胞毒性試驗方法的選擇應根據樣品的理化性質,模擬臨床的實際使用情況進行選擇。
子宮托是一種Ⅱ類醫療器械,其材質主要為聚乙烯和硅橡膠類。經臨床觀察,使用子宮托治療盆腔器官脫垂,可以明顯緩解患者脫垂和排尿相關癥狀,改善患者的生活質量。因其損傷小,操作簡單,安全有效,在盆腔器官脫垂治療中被廣泛應用,近些年又被拓展到壓力性尿失禁、宮頸功能不全和盆底功能障礙等相關疾病的治療中[1]。隨著我國人口老齡化的加速,盆底功能障礙患者逐漸增加,子宮托的應用將更為廣泛,正確評價其安全性尤為重要。
體外細胞毒性試驗具有簡便、快速、敏感性高的特點,是醫療器械生物學評價體系中常用的檢測指標之一,是一種離體狀態下模擬生物生長環境,檢測醫療器械產品接觸人體組織后生物學反應的體外試驗。本文分別用GB/T14233.2-2005和GB/T 16886.5-2017中的MTT試驗方法對子宮托的細胞毒性進行測定比較。
1.材料與方法
1.1 一般材料
試驗樣品:子宮托(來自生產企業送樣,材質為硅橡膠類)。
細胞:小鼠成纖維細胞L-929(中國科學院上海生命科學院細胞資源中心)。
主要試劑:1640培養基(北京索萊寶生物科技有限公司),MEM培養基(賽默飛世爾(蘇州)儀器有限公司),胎牛血清(Biological Industries Israel Beit Haemek Ltd,DMSO(SIGMA-ALDRICH),異丙醇(天津市百世化工有限公司),ZDBC的聚氨脂膜(Hatano Research Institute,FDSC)。
1.2 方法
1.2.1 GB/T14233.2-2005中MTT試驗方法
試驗液的制備。①樣品浸提液:取樣品,剪成約1cm×3cm小條,按0.2g/mL的比例,加入含10%血清的1640培養基,37?C浸提24h備用;②空白對照液:同批含10%血清的1640培養基,同法制備;③陰性對照液:高密度聚乙烯按0.2g/mL的比例,加入含10%血清的1640培養基,同法制備;④陽性對照:5g/L的苯酚溶液,同法制備。
試驗方法。按照GB/T14233.2-2005規定的MTT試驗方法進行[2]。將1×104/mL細胞懸液接種于96孔板,每孔100μL,置5%CO2培養箱中37?C培養24h后,棄去原培養液。分別加入樣品浸提液、空白對照液、陰性對照液和陽性對照液,每孔100μL,置CO2培養箱中37?C培養72h,然后每孔加入5g/L的MTT溶液20μL,繼續培養4h后棄去孔內溶液,加入DMSO 150μL,振蕩10min,在酶標儀570nm和630nm雙波長下測定吸光度(OD值)。按公式(1)計算細胞相對增殖率(RGR):
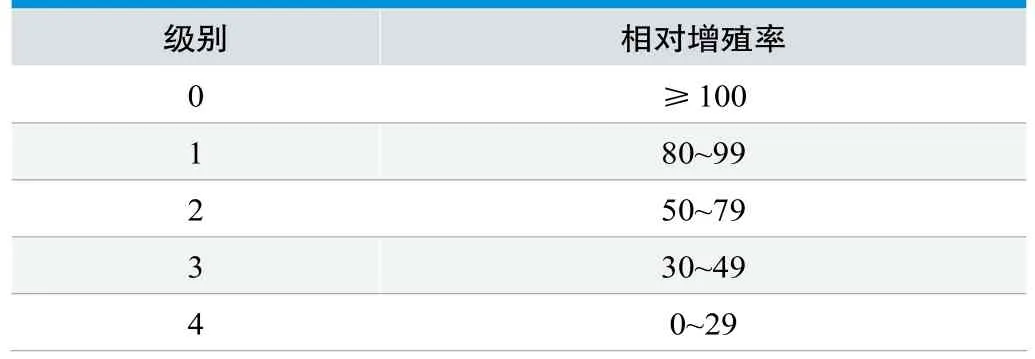
表1. MTT法細胞毒性反應分級(%)

注:RGR——相對增殖率,%;A——供試品組(陰性組、陽性組)吸光度;A0——空白對照組吸光度。(MTT濃度為5g/L,溶于PBS溶液。)
結果判定。根據RGR按表1分級標準判定。陰性對照組的反應不大于1級,陽性對照組的反應至少為3級時,判定結果可靠。
1.2.2 GB/T 16886.5-2017中MTT試驗方法
試驗液的制備。①樣品浸提液:取樣品,剪成約1cm×3cm小條,按0.2g/mL的比例加入含10%胎牛血清的MEM培養液,37?C浸提24h備用;②空白對照液:同批10%胎牛血清的MEM培養液,同法制備;③陰性對照液:取高密度聚乙烯膜按表面積3cm2/mL的比例加入含10%胎牛血清的MEM培養液,同法制備;④陽性對照液:取含ZDBC的聚氨脂膜按表面積3cm2/mL的比例加入含10%胎牛血清的MEM培養液,同法制備。
試驗方法。按照GB/T 16886.5-2017規定的MTT試驗方法進行[3]。將1×105/mL細胞懸液接種于96孔板,每孔100μL。置5%CO2培養箱中37?C培養24h后,棄去原培養液。加入樣品浸提液、空白對照液、陰性對照液和陽性對照液,每孔100μL置CO2培養箱中37?C培養24h。除去原培養液,每孔加入1g/L的MTT溶液50μL,繼續培養2h后除去孔內MTT溶液,加入100μL異丙醇,振蕩10min,在酶標儀570nm和650nm雙波長下測定吸光度(OD值)。按公式(2)計算存活率:
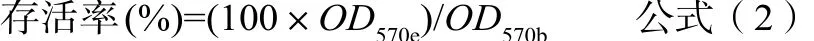
注:OD570e——試驗樣品組(陰性、陽性對照組)光密度平均值;OD570b——空白對照組光密度平均值。(MTT濃度為1g/L,新鮮溶于不含酚紅的MEM溶液。)
結果判定。當細胞存活率下降到<空白的70%,則具有潛在的細胞毒性。
2.結果
GB/T14233.2-2005MTT法的RGR為13%(見表2),GB/T16886.5-2017MTT法的RGR為75%(見表3),兩者差異明顯。
3.討論
同種樣品的細胞毒性試驗用GB/T 16886.5-2017MTT方法得出的RGR結果明顯高于GB/T14233.2-2005MTT方法的RGR結果。分析原因如下。
GB/T14233.2-2005的細胞接種密度為1×104/mL,而GB/T 16886.5-2017的細胞接種密度為1×105/mL,兩者相差10倍。同時鏡下觀察,細胞形態均正常,生長良好。前者細胞密度稍顯稀疏,后者稍顯致密,考慮接種密度為1×104/mL時,L929細胞在24h仍處于緩慢增殖狀態,會擴大細胞對待檢物的反應;而接種密度為1×105/mL時,細胞在24h后便進入了對數生長期,細胞狀態較為穩定。同時也有相關文獻試驗證明,細胞種板數目增大,細胞增殖率逐漸增高,這和本試驗得出的測試結果一致[4]。
GB/T14233.2-2005在浸提液中培養時間為72h,而GB/T 16886.5-2017在浸提液中培養時間為24h。隨著培養時間的延長,由于浸提液中硅橡膠聚合物的降解片段會進一步降解,在較小體積中逐漸累積,對細胞毒性的影響較為持續而顯著。

表2. GB/T14233.2-2005MTT法試驗結果

表3. GB/T16886.5-2017MTT法試驗結果
不同的浸提介質在浸提樣品時,在溶液條件下發生相互作用,因浸提液的成分不同可能也會導致結果差異。
GB/T14233.2-2005方法中在加入MTT前沒有去除浸提液,而GB/T 16886.5-2017方法中則全部去除浸提液后再加入MTT,考慮在浸提液環境下,樣品浸提析出的成分有可能和MTT反應,而影響結果出現差異。
總之,目前GB/T 16886.5-2017中的MTT法和GB/T14233.2-2005的MTT法作為國家標準,被多數企業直接引用到評價申報醫療器械生物安全性,但是并不代表該試驗方法適合所有醫療器械。同時,體外細胞毒性試驗條件和臨床實際使用的環境條件存在差別,尤其某些降解、溶出的材料應謹慎對待[5]。當前醫療器械產品種類繁多,發展迅速,如何客觀的評價醫療器械的細胞毒性,方法的選擇尤為重要,需要全面了解產品的理化性質,盡量模擬樣品實際使用情況或嚴于樣品實際使用條件進行試驗。建議根據產品材料的不同,選擇適宜的細胞毒性試驗方法。

