冷誘導RNA結合蛋白的調控與功能研究進展
王曉慧, 徐孝娜, 秦緒軍, 王 楓
(第四軍醫大學 軍事預防醫學系 營養與食品衛生學教研室, 西安 710032)
體溫下降對細胞的直接影響是整體蛋白質的合成受到抑制,從而使細胞轉變為維持生存的狀態。與大多數蛋白合成降低相反,一小部分蛋白,如冷誘導RNA結合蛋白[Cirbp/CIRP,異質核糖核蛋白A18(hnRNP A18)],表達增加[1-2]。Cirbp屬于富含甘氨酸蛋白(GRP)家族,N′端有一個保守的RNA識別基序(RRM),含有兩個核糖核蛋白(RNP)域:RNP1和RNP2[3],C’端包含一個富含甘氨酸(RGG)結構域。Cirbp是應激應答基因,它們的表達在多種應激情況下均可誘導,包括低溫和高溫、低氧、輻射、藥物等。
Cirbp是早期發育的關鍵因子。在兩棲類,被廣泛用于發育研究模型,Xenopuslaevis(非洲爪蟾)同源xCIRP-1在發育中的腎臟和腦中瞬時表達,對胚胎腎形成至關重要[4]。Cirbp的同系物AxRBP在墨西哥蠑螈的表達在原腸期10~12 d開始,在神經胚期15 d尤其是在神經板和神經褶達到峰值,孵化后下降到低水平[5]。在人類,Cirbp在甲狀腺和心臟呈高表達[6]。大鼠慢性間歇性冷暴露能引起代謝相關組織腦、心肌組織、骨骼肌和肝組織中Cirbp表達上調[7]。在亞細胞水平,Cirbp主要分布在細胞核中,參與調控基因的轉錄或結合mRNA進行轉錄后調控,在生理或應激的情況下,Cirbp會在細胞核和細胞質之間穿梭[8]。在哺乳動物中,細胞質應激和內質網(ER)應激時,Cirbp RGG結構域精氨酸殘基的甲基化會引起Cirbp在細胞質應激顆粒中蓄積,而同應力顆粒TIA-1的形成無關[9]。
臨床上,治療性低溫(32℃~34℃)已被證明是緩解缺氧缺血性腦病和成人急性腦損傷患兒神經功能缺損的有力工具,而Cirbp蛋白質的合成在溫和到中度低溫(32℃~34℃)時達到高峰[10],因此Cirbp是很有前途的研究方向。
1 Cirbp的分子調控
目前,盡管已經提出了一些涉及不同調控水平的模型,但低溫和其他應激調節冷誘導蛋白的轉錄和翻譯的確切機制尚不清楚。在轉錄水平上,小鼠Cirbp基因上的核心啟動子和啟動子在低溫時可被活化[11]。選擇性剪接是低溫應激應答的重要途徑之一,冬眠動物主要表達短的異構體,具有完整的開放閱讀框(ORF)[2]。人工低溫可以部分促進從長型異構體向短功能亞型的轉變[2]。在小鼠成纖維細胞,Cirbp的5′-UTR和全長ORF存在于兩個轉錄體上,這兩個轉錄體在低溫條件下均可產生,Cirbp轉錄體的5′-UTR上包含一個內部核糖體進入位點(IRES),而在熱應激條件下,亞型缺少5′-UTR和起始甲硫氨酸的編碼序列[12]。Cirbp可在DNA雙鏈斷裂(DSBs)修復早期聚集在損傷部位,同PARP-1作用從而調節DSB修復和基因組的穩定性[13]。此外,轉錄因子可能調控冷誘導基因的轉錄,同37℃相比,在32℃,大量的轉錄因子Sp1招募到Cirbp基因5′側翼區的溫和冷反應元件(MCRE),從而增加了Cirbp表達[14]。總的來說,Cirbp對多種應激應答下的表達改變存在多種機制,提示對各種外部和內部的應激存在廣泛適應。
2 Cirbp對轉錄后和翻譯的調節
正如其他的RNA結合蛋白,Cirbp能夠結合RNAs,從而調節其轉錄后水平[15-16]。在紫外光的照射下,Cirbp結合到3′-UTR兩個應激應答轉錄體上,復制蛋白A(RPA)和硫氧還蛋白(TRX),從而穩定結合的mRNA表達和促進其翻譯[17-18]。Cirbp的RRM結構域和RGG結構域通過eIF4G連接TRX轉錄體的 5′-和3′-UTRs,eIF4G是增強TRX翻譯的一個關鍵組成部分。除了3′-UTR,poly(A)尾是Cirbp介導轉錄后調節的一個重要調控元件。Cirbp富含poly(A)位點且控制許多基因的多聚腺苷酸化,如晝夜節律基因等,poly(A)尾可以加強Cirbp同TRX3′-UTR的結合并增強其穩定性[17-18]。
Cirbp在蛋白質翻譯中的功能還不清楚。有一些證據表明Cirbp可能通過靶向調控元件內部基因抑制基因轉錄和翻譯。例如,APBP-1,Cirbp雞同源體,結合到蛋白聚糖基因順式元件上并抑制其表達[19]。相反,在建系的CHO細胞系,37℃過表達Cirbp提高重組干擾素γ蛋白的生成[20]。
3 生物學功能與疾病
3.1 腦部疾病
治療性低溫不僅能有效地減輕急性缺血和脊髓損傷(SCI)的原發性損傷及防止其繼發性損傷,而且能延緩慢性神經變性疾病的進展。Cirbp在腦缺血損傷中的作用仍有爭議。大鼠海馬缺血后3~6 h,CirbpmRNA表達降低,但在大腦皮層48 h仍保持不變[21]。然而,在相同的腦缺血模型,大鼠皮層腦缺血后24 hCirbpmRNA增加了約5倍,同缺血相反,低溫顯著誘導Cirbp表達,24 h約增加30倍,低溫缺血聯合暴露沒有累加效應[22]。
ROS水平升高是腦缺血再灌注損傷中氧化應激誘導的一個重要的不利因素。在PC12細胞中,已經觀察到H2O2處理產生ROS后 Cirbp的表達下調,當內源性或人工過表達誘導Cirbp表達升高后,對H2O2誘導的神經細胞凋亡有明顯抑制,表明Cirbp具有神經保護作用[21, 23]。同胞內的有益作用相反,Cirbp釋放進入血液系統與有害的免疫應答有關。體內和體外實驗均顯示,腦缺血后小膠質細胞分泌的Cirbp同之后的Cirbp介導的TNF-α表達導致的神經炎癥反應和引起神經元損傷有關[24]。綜上所述,Cirbp在腦缺血再灌注損傷中具有雙重作用:一方面,只要Cirbp仍然在細胞內定位,它可以保護神經元免于凋亡;另一方面,一旦Cirbp釋放到胞外,會激活小膠質細胞從而引起中樞炎癥反應。
3.2 晝夜節律
Cirbp在小鼠視交叉上核(SCN)和大腦皮層的表達存在晝夜調節,Cirbp的表達6 pm達到峰值,3 am表達最低,變化具有光依賴性,且這種波動只發生在幼年和成年小鼠[25]。同哺乳動物一樣,光信號已被觀察到誘導兩棲動物腦Cirbp的表達[26]。2012年,Cirbp被確定為轉錄后修飾哺乳動物晝夜節律的基因,如 CLOCK基因[15]。
在哺乳動物中,SCN的中樞節律系統將體溫周期與環境光-暗周期和外周時鐘(如肝臟和胰腺)同步起來[27]。最近的一項研究表明Cirbp導致小鼠肝細胞對溫度敏感的振動,同哺乳動物體溫和外周組織的晝夜節律的輕微波動有關聯[28]。此外,由于肝臟和胰腺是必不可少的代謝器官,營養必然影響這些器官的外周節律,如生酮飲食和禁食,擾亂外周時鐘,誘導肝臟Cirbp表達[29]。因此,Cirbp被認為是哺乳動物晝夜節律振蕩的一個組成部分,它不僅受體溫調節和環境改變應答,如光照的細微改變,而且還控制下游節律基因的表達。
3.3 免疫應答
模式識別受體(PRRs)是識別病原相關分子模式(PAMP)和損傷相關分子模式(DAMP)的原始的關鍵部件,在植物到哺乳動物具有高保守性[30-31]。2007年,首次發現植物低溫誘導蛋白——AtGRP7參與植物免疫調節,AtGRP7顯著提高PAMP觸發的免疫應答,通過結合兩個PRRS(FLS2和EFR)的轉錄體和蛋白質[32]。哺乳動物的冷誘導蛋白也參與了天然免疫應答。2013年,Cirbp被認定為一種新的炎癥介質,在失血性休克和膿毒癥時從心臟和肝臟釋放入血,結合TLR4-MD2復合體(一類哺乳動物PRRS),刺激TNF-α和HMGB1分泌從而觸發炎癥反應[33]。相反,Cirbp的表達可被TNF-α或TGF-β抑制,提示存在負反饋調節。低溫誘導的肝Cirbp表達通過減少ROS的產生保護肝細胞[34],而當進行抗Cirbp抗體治療,可顯著降低炎癥反應,保護肝臟免于缺血再灌注損傷[35]。如今用ELISA法檢測外周血中Cirbp水平,探討Cirbp作為一種新的膿毒癥診斷標志物的可能性。胞外Cirbp通過誘發炎癥反應誘導細胞損傷,然而,在炎癥的晚期,受損的細胞被炎癥消除,再生的細胞可以替代功能失調的細胞[36],因此Cirbp介導的免疫反應可能也有有利的方面。
3.4 癌癥
Cirbp被認為是一種原癌基因,在增殖和惡性腫瘤細胞中參與細胞周期調控和細胞增殖,且在不同的癌癥中與正常組織表達有差異(表1)。在原發性肝細胞癌(HCC),Cirbp可控制ROS蓄積和癌癥干/祖細胞擴增促進癌癥發生,肝癌復發的風險與肝Cirbp表達呈正相關,抑制Cirbp可能至少在肝癌治療中具有治療價值[37]。在結直腸腫瘤,Cirbp通過刺激細胞因子TNF-α和IL-23參與腫瘤發生和慢性炎癥[38]。在垂體腺瘤,高Cirbp表達可能通過ERK1/2信號通路同腫瘤的增殖侵襲和復發密切相關[39]。在口腔鱗狀細胞癌,Cirbp與TLR4共表達且與短期生存率相關[40]。與正常子宮內膜相比,子宮內膜癌和子宮內膜增生Cirbp表達缺失或明顯下降,表明Cirbp在正常組織增殖中發揮作用[41]。Cirbp增加細胞周期調控因子CyclinE1的表達,促進乳腺癌轉化增殖和腫瘤進展[42]。總之,越來越多的臨床研究表明,Cirbp與腫瘤預后差有關。
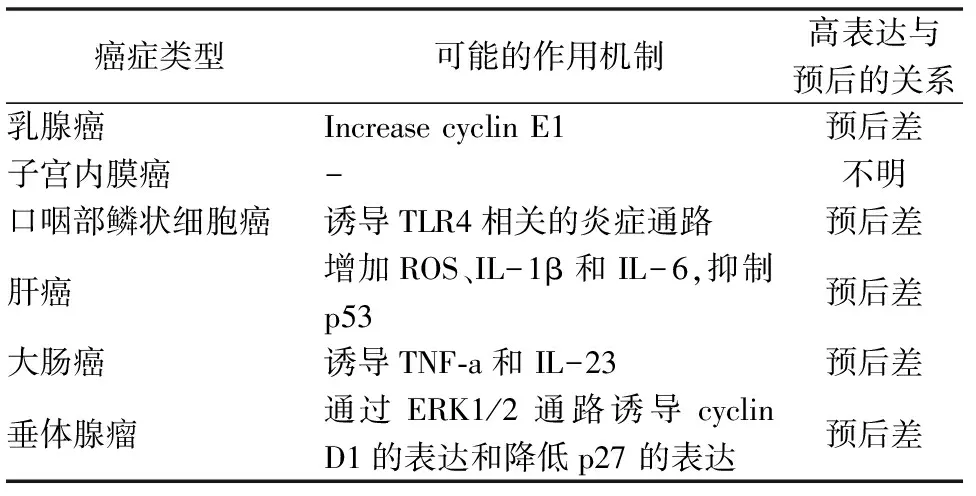
表1 Cirbp在癌癥中的作用
3.5 繁殖
1997年,Cirbp在哺乳動物的睪丸生殖細胞中首次被發現[43]。睪丸的生理溫度低于體溫,這有利于精子的發生。已經提出了幾種機制來解釋Cirbp在精子和睪丸損傷中的保護作用。在轉錄后水平,提高陰囊溫度導致睪丸和附睪減少Cirbp表達和生精細胞凋亡增加[44-45];減少生殖細胞氧化應激和細胞凋亡防止睪丸扭轉復位后睪丸損害,Cirbp表達下調后,生殖細胞的p44/p42、p38和SAPK/JNK MAPK通路活化,從而損害精子的發生[46],抑制促凋亡蛋白p53和Fas降低隱睪誘導的睪丸損傷[47];Cirbp調節細胞周期的關鍵通路或組件,如同 Dryk1b /Mirk相互作用促進未分化的精原細胞的增殖[48]。
4 結論與展望
綜上所述,Cirbp除參與冷應激時細胞的各種生理進程外,在常溫下許多內源性和環境應激條件,如滲透壓改變、輻射、毒素藥物和生長因子等,也發揮重要作用。Cirbp在多種類型的細胞中存在,可以由各種不同的細胞應激激活,在細胞中的作用取決于特定的細胞狀態,也就是其他應激應答分子的存在。本文通過闡明Cirbp的上游和下游的分子和細胞方面,全面總結了Cirbp的生物功能,并強調其同體內各種生理和病理過程的關系。作為一個新的增殖相關蛋白,可通過抑制Cirbp的表達來使細胞的增殖受損并增加細胞對化療的敏感性,因此調節Cirbp的表達可應用到多種類型癌癥的治療。人和雄性動物生殖細胞溫度升高后Cirbp表達水平降低,對睪丸Cirbp表達機理的探討將有助于闡明男性不育的分子機制。目前低溫保護已應用于心臟外科、腦外科等,對心臟驟停和腦缺血-再灌注損傷的治療及預后有重要意義。對今后Cirbp治療意義的關鍵是能夠將現有的關于Cirbp作用的知識,靶向直接其中一個或者兩個蛋白或它們參與的信號通路,從而應用到具體的治療方法。

