自組裝鐵蛋白在納米疫苗領域的應用進展
魏珍珍, 劉興健, 王 朋, 張志芳, 易詠竹
1.江蘇科技大學生物技術學院, 江蘇 鎮江 212003;2.中國農業科學院生物技術研究所, 北京 100081;3.中國農業科學院蠶業研究所, 江蘇 鎮江 212018
自組裝蛋白在真核細胞及原核細胞中是普遍存在的,蛋白質亞基間會自發組裝構成高度有序的結構,這是維持機體正常運轉的保證,也是機體進化的推動力[1]。由自組裝蛋白形成的納米材料,不僅具有生物相容性良好以及粒徑均一、穩定的特性,還在細胞成像、病灶檢測和藥物緩釋等方面具有廣闊的應用前景。
到目前為止,研究最多的自組裝蛋白納米顆粒包括病毒顆粒(virus particles)、血清白蛋白(serum albumin)、絲蛋白(silk protein)及鐵蛋白(ferritin)。其中,病毒顆粒侵染宿主細胞并在宿主細胞內的自組裝行為,是自然界中典型的生物納米材料的形成方式,主要用于特異性檢測以及病毒侵染宿主細胞的機制和路徑的研究[2,3],經基因修飾后還可用于研制借助病毒釋放基因的藥物等方面的研究[4];血清白蛋白是脊椎動物血漿中含量最高的蛋白質,其分子的彈性良好,結構改變后也極易恢復,不同來源的血清白蛋白的空間構造均十分保守[5],在藥物傳遞系統領域擁有潛在的應用前景[6];絲蛋白是一類線狀蛋白的生物高分子材料,可抗紫外線,也可抗蛋白水解酶,其柔韌性好、抗疲勞度高,有著與鋼材類似的張力強度,還具有良好的熱、酸、堿穩定性和生物相容性,在生物材料[7]和藥物載體[8]領域應用廣泛。
而鐵蛋白是存在于大多數生物體內的天然蛋白,具有獨特的理化性質:①鐵蛋白對pH不耐受,較為敏感,在酸性條件(pH 2.0)下鐵蛋白外殼會解體成亞基,而當pH回升到生理條件(pH 7.4)時,各亞基又重組形成完整的鐵蛋白[9,10];②鐵蛋白的天然高級結構不受多種變性劑的影響,一般蛋白質在1~4 mol/L的低濃度鹽酸胍或者脲溶液中就會發生變性,而鐵蛋白在6 mol/L的鹽酸胍或8 mol/L的脲溶液中才會發生蛋白質解聚,即鐵蛋白對變性劑的耐受性高[11];③鐵蛋白對高溫具有較高的耐受性,大多數蛋白質在溫度高于生理條件后極易變性,但鐵蛋白在高溫(70℃~80℃)時可維持10 min以上不會發生變性,且其高級結構維持完好[12]。基于鐵蛋白獨特的理化性質,本文主要對鐵蛋白的仿生合成及其在腫瘤的診斷成像及治療、藥物載體和納米疫苗領域的應用進展進行了綜述,闡述了天然鐵蛋白的結構及修飾、人工制備重組鐵蛋白的研究進程,分析了重組鐵蛋白在各領域中的應用,以期為研發對機體無害、適應不同生物體的新型疫苗提供參考。
1 鐵蛋白的結構及其修飾
在生命體中,天然的鐵蛋白主要由水合氧化鐵核和蛋白質外殼2個部分組成,其結構是高度對稱的,封閉的籠形結構由24個亞基組成。哺乳動物鐵蛋白外殼的分子量約為480 kDa,外直徑約為12 nm,可容納約4 500個鐵原子的內腔直徑約為8 nm。哺乳動物機體中的鐵蛋白外殼是由H亞基和L亞基組成的,但亞鐵氧化酶活性中心(ferroxidase center)只存在于H亞基上[13]。許多在機體中發揮重要作用的蛋白質和輔酶的組成成分都含有鐵元素;而廣泛存在于機體中的鐵蛋白在鐵離子代謝中起著至關重要的作用,可維持鐵的穩態,抵抗氧化應激;此外,鐵蛋白還可以捕捉游離二價鐵將其氧化并形成穩定的鐵核,從而消除過量金屬離子的其他毒性作用[14]。
自然界中的鐵蛋白都含有鐵核,其組分是水鐵礦(5Fe2O3·9H2O),也可稱之為全鐵蛋白(holoferritin),即鐵蛋白(ferritin),而不含鐵內核的鐵蛋白,稱為去鐵鐵蛋白(apoferritin)。鐵蛋白的球形中空結構有3個界面:內表面、外表面及亞基間接觸面(圖1)[15]。在對鐵蛋白進行修飾改造時,其內表面可將材料包裹于鐵蛋白內核,作為納米復合材料合成的納米反應器;外表面可連接配體,賦予鐵蛋白特殊功能;亞基間接觸面可通過調節溶液pH完成解聚與重組,開發鐵蛋白的新功能。
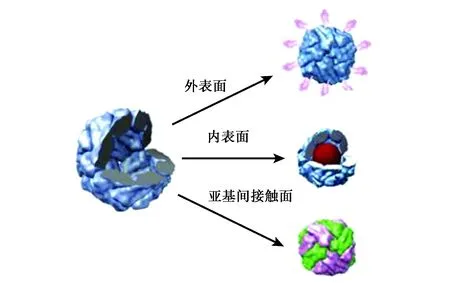
圖1 可用于修飾的鐵蛋白3個界面[16]Fig.1 Three interfaces of ferritin that can be used for modification[16].
2 重組鐵蛋白的人工制備
隨著交叉學科的快速發展、生物學與納米技術的聯用,仿生合成鐵蛋白技術也逐漸得到改善。1991年,英國巴斯大學首次合成了磁性鐵蛋白,他們以天然馬脾鐵蛋白為模板,人工除去了水鐵礦(5Fe2O3·9H2O)的天然內核,并將磁性鐵核在馬脾鐵蛋白的空腔內合成[17],這項工作開辟了一個新領域——仿生合成納米顆粒。但這同樣也存在著問題,在利用天然馬脾鐵蛋白外殼作為模板合成納米顆粒前,首先要除去蛋白質內的天然水鐵礦內核,而去核的過程需要利用可破壞蛋白質外殼的強還原劑處理鐵蛋白,以致亞鐵離子不能全部進入蛋白質外殼的內核中,而是吸附到蛋白質外殼的表面被氧化,從而導致合成的鐵蛋白聚集[18]。
天然鐵蛋白的自組裝特性,使得在大腸桿菌中批量表達重組鐵蛋白成為可能。利用大腸桿菌表達的鐵蛋白亞基可以自組裝形成24聚體的鐵蛋白外殼,與天然鐵蛋白相比,結構一致、分散性好、粒徑均一,所以在不破壞鐵蛋白外殼完整性的前提下,可將大腸桿菌作為優良的模式生物來仿生合成鐵蛋白納米顆粒。2006年,美國蒙大拿州立大學首次利用大腸桿菌成功獲得幾乎純的鐵蛋白外殼,并以這些鐵蛋白外殼為模板,仿生合成了磁性鐵蛋白[19]。這種新技術不僅極大地簡化了分離純化天然鐵蛋白外殼的過程,而且避免了強還原劑對蛋白質外殼的破壞,保持了蛋白質外殼良好的完整性,使得整個合成過程高效且快速。值得注意的是,雖然利用大腸桿菌可仿生合成與天然鐵蛋白結構相似的鐵蛋白,但是二者內核晶型不同,仿生合成鐵蛋白的內核為Fe3O4,具有超順磁性,這也是仿生合成的鐵蛋白被稱為磁性鐵蛋白的原因。
目前,已能夠成功構建基于大腸桿菌的鐵蛋白原核表達體系,利用IPTG誘導表達后,經過純化、復性等步驟,即可獲得與天然結構相同的鐵蛋白納米顆粒,其在生物醫藥領域具有廣泛的應用前景[20]。
仿生合成的鐵蛋白納米顆粒與其他納米顆粒相比,具有以下優點:①粒徑小,約為12 nm,有利于其在病灶組織(如腫瘤)的滲透和積累[21];②粒徑均一,在大腸桿菌中能仿生合成理想的粒徑均勻且分散性良好的鐵蛋白納米顆粒;③生物相容性良好,利用大腸桿菌表達的人重組鐵蛋白納米顆粒制成的生物技術藥物,應用于機體后,不易引起免疫排斥反應,對機體的毒性有較大程度的降低;④易于靶向性修飾,鐵蛋白納米顆粒在合成時可直接通過基因修飾,在外殼及亞基間接觸面上修飾所需肽段等,使其成為納米載體。
此外,仿生合成的磁性鐵蛋白納米顆粒內核為Fe3O4,具有超順磁性和過氧化物酶活性的雙功能特性。Fe3O4的內核直徑在4~7 nm,具有超順磁性,使其成為潛在的MRI造影劑[22]。而我國科學家于2007年發現,Fe3O4磁性納米顆粒還具有過氧化物酶的活性[23],即在顯色底物中含有H2O2時,Fe3O4磁性納米顆粒可以將其催化氧化發生顏色反應。已有研究表明,鐵蛋白的表達量在病變的腦組織和多種類型的腫瘤細胞中都較正常組織細胞多[24]。目前,檢測腦神經退化性疾病及各種腫瘤的無創傷性的手段即為磁共振成像(magnetic resonance imaging,MRI),可以對病變組織內的鐵含量進行定量檢測[25]。因此,仿生合成的磁性鐵蛋白納米顆粒在病灶診斷及治療中具有巨大的應用前景(圖2)。
3 鐵蛋白納米顆粒的應用
3.1 鐵蛋白納米顆粒在藥物載體領域的應用
鐵蛋白納米顆粒在藥物載體領域,不僅可作為載體,同時還可作為信號分子。基于鐵蛋白納米顆粒具有的良好的生物相容性和特殊的球形空腔結構,其可成為鐵氰化物、熒光素等各類小分子探針的理想載體。英國諾丁漢大學以無內核的鐵蛋白外殼作為納米材料的載體,系統地評估了鐵蛋白包裝對納米材料穩定性及生物相容性的影響。實驗結果表明,包裝有探針的納米顆粒不僅具有量子點優異的熒光性質,同時,還因為被鐵蛋白包裹而降低了相應的毒性;通過進一步對鐵蛋白外殼的修飾,包裹有量子點的鐵蛋白納米顆粒還可實現靶向細胞識別,并使得靶向過程可視[28],為后期的臨床診斷及病灶組織治療提供了重要的技術支持。
此外,鐵蛋白也可作為信號分子,在生物傳感器中利用其納米材料的特性,雙向放大電信號,構建一種電化學免疫檢測方法。如利用金納米顆粒與rGO-AuNPs材料修飾的玻碳電極合成AuNPs-Ab2-Ferritin復合物,通過2次免疫反應可形成AuNPs-Ab2-ferritin/Ag/Ab1/rGO-Au-chi/GC,一種特殊的夾心免疫結構,該結構能實現檢測人血漿硝化銅藍蛋白(nitrated ceruloplasmin)的目的[29]。
3.2 鐵蛋白納米顆粒在納米疫苗領域的應用
研究人員基于鐵蛋白特殊的空間結構,對其進行改造,結果表明,生物基因改造不會影響鐵蛋白亞基間的自組裝,而且24個亞基的基因均可進行改造,這一發現使得鐵蛋白納米顆粒成為一個疫苗開發和抗原遞呈的平臺[30]。2006年,美國新世紀醫藥公司首次利用鐵蛋白外殼作為呈遞抗原的疫苗研發平臺,在鐵蛋白L亞基的N端融合表達HIV-1病毒的Tat肽段,利用鐵蛋白的自組裝特性生成融合蛋白,隨后進行動物免疫實驗,實驗結果表明,該融合蛋白在動物機體內可激起免疫應答反應[30]。2013年,美國國家衛生研究所和過敏與傳染病研究所將鐵蛋白應用于流感疫苗的研發,將幽門螺桿菌鐵蛋白亞基的N端與流感病毒的血凝素蛋白(hemagglutinin,HA)基因融合,當鐵蛋白自組裝形成融合蛋白時,由蛋白核心向外伸出引入的血凝素HA,由于鐵蛋白具有三重對稱軸,因而可形成8個HA突起,與流感病毒表面的突起相似(圖3)[32]。將該融合蛋白納米顆粒作為抗原進行動物免疫實驗,在動物體內成功誘導了中和性抗體,達到了流感病毒疫苗的作用。同時,與傳統滅活病毒疫苗相比,這種流感血凝素融合蛋白納米顆粒在動物體內產生的中和性抗體水平高10倍以上,而且存在于鐵蛋白表面的HA突起能特異性識別流感病毒HA三聚體蛋白的莖部和頭部這2個高度保守的位點。此外,這種新型疫苗的免疫范圍更廣,能中和絕大多數同型病毒。通過基因修飾,鐵蛋白自組裝納米顆粒還可以融合表達其他病毒抗原作為抗原遞呈的制備疫苗平臺,為各類動物病毒病的防治提供了較好的技術支持。

圖2 可用于靶向腫瘤并使其可視化的磁性鐵蛋白納米顆粒Fig.2 Magnetic ferritin nanoparticles that can be used to target and visualize tumors.注:A:仿生合成磁性鐵蛋白[26];B:磁性鐵蛋白的雙功能特性;C:常規免疫組化方法;D:磁性鐵蛋白檢測腫瘤新技術[27]。
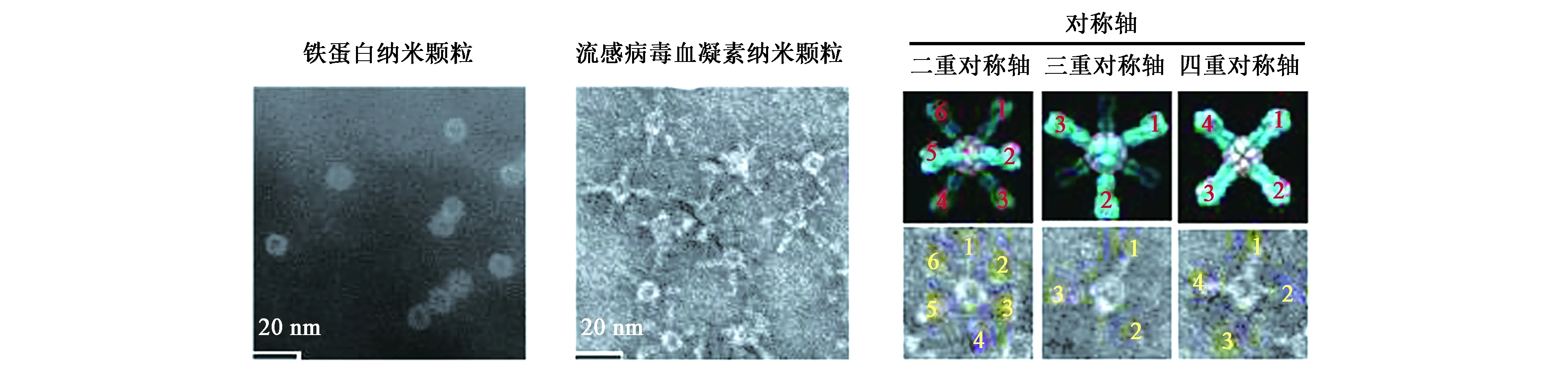
圖3 流感病毒HA的鐵蛋白納米顆粒的分子設計和表征[32]Fig.3 The molecular design and characterization of ferritin nanoparticles from influenza virus HA[32].注:納米粒子的負面染色TEM圖像。1~6代表了HA尖峰在圖像中的編號。
目前,在制備雙組分鐵蛋白納米顆粒,即同時表達多種抗原的鐵蛋白納米顆粒方面也做了嘗試(圖4),納米顆粒上的抗原多聚化可以使中和抗體響應得到改善[33]。在此研究中,設計了雙組分鐵蛋白變體,允許在1個顆粒上以確定的比例和幾何圖案黏著2種不同的抗原。雙組分鐵蛋白專門設計用于三聚體抗原,每個抗原接受每個顆粒4個三聚體,并用來自HIV-1包膜(Env)和流感血凝素(HA)的抗原進行測試。用具有不同Env、HA或2種抗原的雙組分鐵蛋白顆粒對豚鼠進行免疫,引發針對各病毒的中和抗體應答。該結果證明了鐵蛋白表面可展示不只1種抗原,也提供了雙組分納米顆粒自組裝原理的證據,將來可作為三聚體抗原的多聚體免疫原呈遞的一般技術。此研究的成功展開,為后期新型疫苗的制備開拓了新的思路。
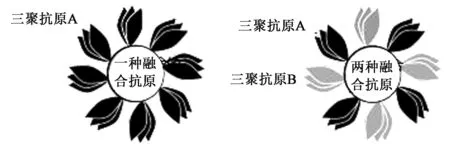
圖4 雙組分鐵蛋白納米粒子的設計,用于附著不同的三聚體抗原[33]Fig.4 Design of two-component ferritin nanoparticles for attachment of different trimeric antigens[33].注:單組分鐵蛋白的示意圖。其具有8個拷貝的三聚體抗原A(黑色)和雙組分鐵蛋白,每個三聚體抗原A具有4個拷貝(黑色)和B(灰色)。
相比于直接在鐵蛋白表面表達抗原,也可在鐵蛋白表面或者空腔內連接衍生自卵清蛋白的抗原肽OT-1(SIINFEKL)或OT-2(ISQAVHAAHAEINEAGR),然后再將重組鐵蛋白作用于樹突細胞,其可啟動和控制抗原特異性免疫應答。樹突細胞在其中起著重要作用,即將抗原內化,再加工和呈遞給原始T淋巴細胞并誘導其增殖和分化為效應細胞(圖5),導致抗原特異性靶細胞的選擇性殺傷[21],同時,IFN-γ/IL-2和IL-10/IL-13細胞因子的產生可證實鐵蛋白納米疫苗會增強機體的免疫反應。基于樹突細胞的鐵蛋白納米顆粒疫苗的開發已成為體內直接抗原特異性適應性免疫的非常有前景的一種方法。
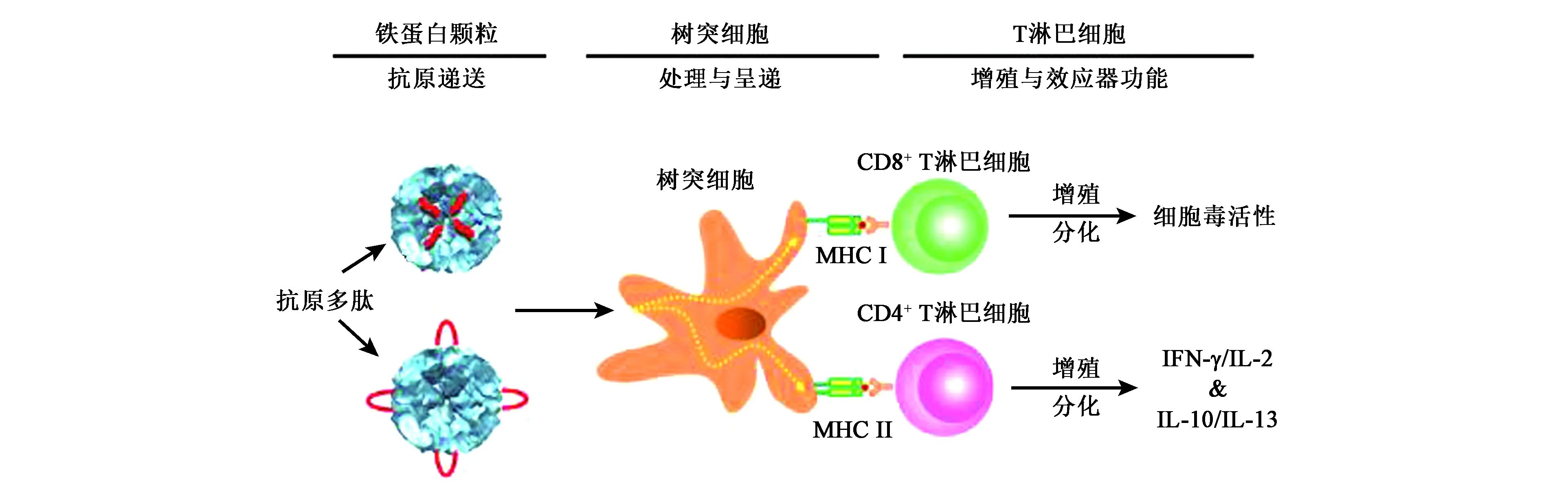
圖5 攜帶OT肽的鐵蛋白蛋白籠納米顆粒誘導的抗原特異性T細胞增殖和隨后的免疫應答[34]Fig.5 Ferroprotein protein cage nanoparticles carrying OT peptide induced antigen-specific T cell proliferation and subsequent immune response[34].
4 展望
自組裝蛋白廣泛存在于機體中,與其他自組裝蛋白相比,自組裝鐵蛋白具有獨特的解聚與重組方式,可耐受高熱和高濃度變性劑,同時其獨特的高級空間結構也便于進行基因定向修飾,可在一定程度上對修飾過程實現精準控制。通過生物手段與化學方法相結合的修飾方法,如在鐵蛋白表面共價連接各類大分子,可實現特異性修飾特定位點,還可賦予鐵蛋白更多新的性能,鐵蛋白的應用范圍也被拓寬;而通過將標記蛋白與鐵蛋白亞基融合表達,使融合蛋白有序的展示在鐵蛋白外殼的外表面,可提高抗體或藥物等目標蛋白的載量和效率,從而作為一種潛在的新型疫苗。同時,基于鐵蛋白的納米顆粒特性,其也可作為信號分子在生物傳感器中雙向放大信號,構建電化學免疫檢測方法,在疾病診治方面具有廣闊的應用前景。因而,實現鐵蛋白的改造及修飾多功能化是未來研究的重要方向。
不過,有關自組裝鐵蛋白的研究仍有以下3個方面亟待深入探究:①鐵蛋白的磁學性質及生理機制;②鐵蛋白表面展示融合蛋白后,其具體的作用機制及通路;③目前作為抗原載體的鐵蛋白多為昆蟲的鐵蛋白及馬脾鐵蛋白,其他生物體內的鐵蛋白的具體分類及差異。使用從機體提取的天然無害蛋白來生產各種疫苗是值得期待的,并且生產納米級疫苗是近期的研究重點,利用鐵蛋白表面表達單種融合抗原甚至可能是多種融合抗原來生產新型疫苗必將成為未來的研究熱點。

