新生兒重度缺氧缺血性腦病不同時間應用高壓氧艙給氧的效果比較
常 睿, 王 靜
(延安大學附屬醫院, 1. 高壓氧科; 2. 兒科三病區, 陜西 延安, 716000)
新生兒缺氧缺血性腦病是導致新生兒殘疾或死亡的常見疾病,是由圍生期窒息造成腦部缺氧缺血性損害,伴不同程度的腦部疾病及神經系統癥狀導致[1-2]。數據[3]統計表明,新生兒缺氧缺血性腦病患兒新生兒期病死率為15.00%~20.00%, 其中20.00%~30.00%存活者存在不同程度的神經系統后遺癥,影響患兒遠期生活質量。新生兒重度缺氧缺血性腦病病情危重,其預后不良率(死亡及后遺癥)高達73.60%, 故選擇一種合理、高效的治療方法顯得十分必要[4]。高壓氧是當前治療新生兒重度缺氧缺血性腦的主要方式,可增加血氧含量及血氧彌散力,提高腦組織氧張力,糾正腦缺氧狀態。本研究對新生兒重度缺氧缺血性腦高壓氧艙給氧時間進行探討,旨在確定高壓氧艙給氧合理時機,現將結果報告如下。
1 資料與方法
1.1 一般資料
選取本院2012年1月—2018年12月收治的103例新生兒重度缺氧缺血性腦病患兒為研究對象,根據隨機數字表法分為2組。對照組51例,男28例,女23例; 日齡30~42 d, 平均(38.41±2.15) d; 出生體質量2.65~3.85 kg, 平均(3.26±0.45) kg; 1 min新生兒Apgar評分(3.46±0.35)分。觀察組52例,男30例,女22例; 日齡30~43 d, 平均(38.42±2.24) d; 出生體質量2.60~3.89 kg, 平均(3.30±0.46) kg; 1 min新生兒Apgar評分(3.42±0.34)分。2組患兒基線資料比較,差異無統計學意義(P>0.05), 可進行對比。納入標準: ① 入組患兒均符合《新生兒缺氧缺血性腦病診斷依據和臨床分度》[5]中重度新生兒缺氧缺血性腦病診斷依據和臨床分度; ② 腦電圖、CT、超聲、MRI等綜合檢查,伴新生兒窒息等并發癥; ③ 患兒家長或法定監護人對研究相關事宜知情,自愿簽署同意書; ④ 該研究符合醫學倫理委員會審批標準。排除標準: ① 入組患兒伴腦代謝疾病; ② 合并先天性遺傳性心臟病等心肌損傷; ③ 合并先天性顱腦畸形或腦回電功能性損害; ④ 中途退出研究者。
1.2 方 法
2組患兒入院后即開始進行常規治療。患者均予以低流量吸氧,維持水電解質及酸堿平衡,降顱內壓,控制驚厥,消除腦干癥狀。取唾液酸四己糖神經節苷脂鈉(齊魯制藥有限公司,國藥準字H20046213) 20 mg及10%葡萄糖溶液100 mL進行靜脈滴注,每日1次。磷酸肌酸鈉(吉林英聯生物制藥股份有限公司,國藥準字H20058621)1.0 g, 靜脈滴注,每日1次。連續治療2個月。
對照組于常規治療48 h后行高壓氧艙給氧治療,觀察組于常規治療當天即開始進行高壓氧艙給氧; 取YLC 0.5/1.2型嬰幼兒氧艙(武漢船舶設計研究所制造),壓力1.3ATA, 加壓時間10 min, 減壓時間10 min, 穩壓時間40 min, 總共60 min; 每日1次,連續5 d為一個療程,停止10 d后開始下個療程,連續治療3個月。
1.3 觀察指標
① 采用新生兒行為神經評分(NBNA)[6]評估新生兒神經行為能力,總計20項條目,總分40分,若NBNA評分≤35分,則表示異常; ② 2組患兒在治療前、高壓氧治療后30 min抽取靜脈血2 mL, 3 000轉/min離心15 min。采用黃嘌呤氧化酶比色法檢測超氧化物歧化酶(SOD), 硫代巴比妥酸比色法檢測丙二醛(MDA); ③ 2組患兒行血清心肌酶(肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶)測定。
1.4 統計學方法
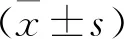
2 結 果
2.1 2組治療前后神經行為比較
治療前, 2組NBNA評分比較無顯著差異(P>0.05); 治療后, NBNA評分顯著增加,且觀察組高于對照組,差異有統計學意義(P<0.05), 見表1。
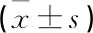
表1 2組治療前后NBNA評分比較 分
NBNA: 新生兒行為神經評分。與對照組比較, *P<0.05。
2.2 2組治療前后氧化應激反應比較
2組治療前SOD、MDA比較無顯著差異(P>0.05); 治療后, MDA較治療前降低, SOD較治療前增加,觀察組較對照組改變更為顯著,差異有統計學意義(P<0.05), 見表2。
2.3 2組治療前后血清心肌酶變化比較
2組治療前血清心肌酶比較無顯著(P>0.05); 治療后,肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶較治療前顯著下降,觀察組較對照組降低顯著,差異有統計學意義(P<0.05), 見表3。
3 討 論
新生兒缺氧缺血性腦病是新生兒圍產期窒息導致的缺氧缺血性腦病,重度新生兒缺氧缺血性腦病患兒臨床治療后遺留各種神經發育后遺癥,比如吞咽障礙、認知障礙、腦癱、癲癇、視覺損傷、智力低下等[7-8]。目前,臨床對新生兒重度缺氧缺血性腦病的治療,由于腦缺氧缺血致腦組織再灌損傷,腦細胞能量代謝障礙、氧自由基損傷及興奮氨基酸中毒等發病機制參與,故在治療時應減少神經細胞損傷,糾正機體缺氧缺血狀態[9]。
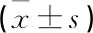
表2 2組治療前后氧化應激反應比較
SOD: 超氧化物歧化酶; MDA: 丙二醛。與治療前比較, *P<0.05; 與對照組比較, #P<0.05。
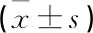
表3 2組治療前后血清心肌酶變化比較 U/mL
與治療前比較, *P<0.05; 與對照組比較, #P<0.05。
在新生兒重度缺氧缺血性腦病常規治療時,神經節苷酯為常用藥物,血腦屏障透過力高,可改變細胞膜活性,糾正腦組織缺血、缺氧狀態[10]; 對興奮性氨基酸神經毒性的選擇性抑制,清除體內氧自由基堆積,阻斷腦組織持續損傷,降低神經細胞毒性,促使受損神經細胞的修復[11-12]。同時恢復神經細胞功能,對腦組織近期及遠期功能恢復均起到顯著效果[13-14]。但單純藥物治療效果欠佳,而新生兒機體各組織器官細胞有再生能力,及時發現干預,可促使受損組織恢復正常。高壓氧艙給氧是一種物理療法,將患兒置于比大氣壓高的高壓環境下,吸入純氧或高濃度氧,以此增加血液中的溶解氧量,糾正腦組織缺血、缺氧狀態[15]。同時,高壓氧可收縮機體腦血管,減少腦血流量,減輕腦組織繼發性損害,降低顱內高壓及腦水腫[16], 可通過增加機體缺血組織氧供,恢復腦組織正常氧供,以此減輕機體組織低氧血癥,恢復血腦屏障功能,快速建立側支循環,促使細胞生理功能恢復,提高細胞能量供應,有利于患兒心肌功能改善[17]。
本組研究中,觀察組治療后NBNA評分顯著高于對照組,治療后肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶低于對照組。結果說明,新生兒重度缺氧缺血性腦病患兒經高壓氧艙給氧治療,可提高腦內血氧含量,加快血氧彌散,充分發揮血氧作用,以此糾正機體缺血缺氧狀態,恢復腦組織血供,保護損傷區域的神經細胞,利于患兒神經行為功能的恢復。同時,高壓氧可促進細胞功能恢復,增強細胞能量供應,利于患兒心肌功能改善。但在早期予以高壓氧艙給氧治療,可在短時間內糾正腦組織缺血缺氧狀態,避免長期缺氧缺血對腦組織的神經,可提高腦組織功能恢復程度,糾正心肌細胞缺血缺氧狀態。
SOD是清除氧自由基的最重要酶,能夠起到維持機體氧化及抗氧化平衡的作用。MDA是脂質過氧化反應產物,反映了機體細胞的氧化損傷程度[18]。新生兒重度缺氧缺血性腦病病情呈進行性發展,持續缺氧缺血狀態下,促使大量氧自由基產生,抑制SOD活性,致氧自由基大量產生,使腦組織血脂質過氧化反應增強,導致再灌注損傷。本組研究2組患者治療后SOD增加, MDA下降,而觀察組較對照組更為顯著。結果說明,對新生兒重度缺氧缺血性腦病行早期高壓氧艙給氧治療,及早糾正缺血缺氧狀態,提高機體血氧含量,增加血氧分壓,促進腦細胞內氧的彌散距離,糾正腦組織供應,改善腦組織功能,減輕腦組織細胞膜損傷,修復腦損傷,減輕腦水腫,以此發揮腦保護及修復作用。
綜上所述,對新生兒重度缺氧缺血性腦病采取高壓氧艙給氧治療,可促使新生兒神經行為恢復,減輕機體氧化應激反應,提高心肌功能恢復,在高壓氧艙給氧治療時,于48 h內進行早期干預治療,更有利于患兒氧化應激反應清除,臨床價值高。

