MRI不同的ROI測量法對卵巢癌表觀彌散系數(ADC)值和觀察者一致性的影響
沈敏花 謝潔林 王鳴鵬 王雪珍 張國福△
(1復旦大學附屬婦產科醫院放射科 上海 200011; 2復旦大學附屬華東醫院放射科 上海 200040)
卵巢癌是女性三大惡性腫瘤之一,發病隱匿,早期無癥狀,就診時常為晚期,病死率居婦科腫瘤首位[1],缺乏敏感而特異的診斷方法是卵巢癌預后差的原因之一。常規磁共振成像(magnetic resonance imaging,MRI)具有良好的軟組織對比及多方位成像的優勢,在評價婦科疾病方面較超聲和CT更準確和特異[2-3],但對卵巢腫瘤的定性與分級仍然存在困難[4]。采用彌散加權成像(diffusion weighted imaging,DWI)對卵巢腫瘤進行研究[5-8]顯示,DWI是常規MRI檢查的有益補充[3-6]。常規DWI通過表觀彌散系數(apparent diffusion coefficient,ADC)圖測量病灶ADC值,ADC值反映了感興趣區(region of interest,ROI)內組織的物理性質,不同的ROI有不同的ADC值。以往都是用在選定的一個病灶層面畫圓圈或橢圓的方法測量ADC值;隨著研究的深入,我們發現不同的ROI放置方法能獲得不同的ADC值,它對ADC值的準確性及重復性有一定的影響。如何找到一個最優的ROI放置方法,不論是對患者還是對醫師來說都有重大的意義。目前ROI放置方法有3種,即完全不規則形ROI測量,部分不規則ROI測量和腫瘤內小ROI取樣[9-16]。本研究采用這3種ROI放置方法,分別觀察其對卵巢癌ADC值測量的影響和不同觀察者分別使用不同測量方法所測結果間的一致性。
資料和方法
病例資料收集2013年1月至2014年12月在復旦大學附屬婦產科醫院就診的卵巢癌患者的MRI及DWI資料。納入標準:完全實性、實性為主或囊性為主的卵巢惡性腫瘤;排除標準:卵巢完全囊性的腫瘤患者,已進行過外科手術或新輔助化療患者。共納入卵巢癌腫瘤患者45例(雙側腫瘤患者均測量較大側),年齡29~73歲,平均50歲,絕經前22例,絕經后23例。Ca125均>100 U/mL,其中有3例的Ca125>5 000 U/mL,所有患者經手術(開腹或腹腔鏡)和病理證實。
檢查方法采用1.5T MRI(Avanto,德國Siemens公司),體部相控陣線圈,囑患者檢查時仰臥于掃描床上,雙上肢上舉置于線圈外面,平靜呼吸。自臍孔水平向下掃描至恥骨聯合,所有患者均行橫斷位T1WI(TR/TE,627/10 ms、視野250 mm×250 mm、矩陣320 mm×240 mm),冠狀位T2WI(TR/TE,4 290/83 ms、視野400 mm×400 mm、矩陣320 mm×320 mm),橫斷位脂肪抑制T2WI(TR/TE,8 000/83 ms、視野350 mm×350 mm、矩陣256 mm×256 mm),矢狀位脂肪抑制T2WI(TR/TE,4490/83 ms、視野270 mm×270 mm、矩陣256 mm×256 mm),層厚均為4 mm、層間距1.2 mm和橫斷位脂肪抑制T1WI(TR/TE,4.9/2.4 ms、視野380 mm×296 mm、矩陣320 mm×192 mm、層厚4 mm、層間距0.8mm)。DWI采用單次激發平面回波成像(echo planar imaging,EPI)序列,參數如下:TR/TE(3 100/81 ms),翻轉角0°,視野320 mm×270 mm,矩陣292 mm×320 mm,層厚5 mm,層間距1.5 mm,b值分別為0和800 s/mm2。增強掃描采用VIBE序列,包括矢狀位和橫斷位采集,參數如下:TR/TE(4.9/2.4 ms),翻轉角10°,視野380 mm×297 mm,矩陣320 mm×178 mm,層厚4 mm,層間距0.8 mm;對比劑為馬根維顯,采用手臂靜脈注射,人工推注模式。
圖像分析采用MR掃描儀自帶的后處理軟件分析DWI資料,2名放射科醫師各自用3種不同的ROI獲得方法測量腫瘤的ADC值,意見不一致時(選擇相同的病灶測量層面)協商解決。完全不規則形ROI測量方法是對腫瘤的最大層面進行手動勾勒腫瘤邊界,獲得所在層面的ADC值。部分不規則ROI測量方法是在腫瘤的最大層面上手動繪制ROI,避免腫瘤囊變、壞死區域等,所獲得的ADC值。腫瘤內小ROI取樣測量方法,是在腫瘤實性區信號較低的區域放置的圓形或橢圓形ROI獲得的ADC值,ROI面積一般大于3 cm2。以上3種方法均可獲得最小及平均ADC值。
統計學分析采用SPSS 17.0和MedCalc 15.2.2軟件進行統計分析。用組間相關系數(ICC:0~0.20為差,0.21~0.40為一般;0.41~0.60為中等;0.61~0.80為好;0.81~1.00為非常好)[17]和Bland-Altman方法分析3種ROI測量方法對不同觀察者所測量數值的一致性程度[18]。采用Friedman檢驗和單因素方差分析3種ROI測量方法所獲得的最小和平均ADC值之間的差異,并進行兩兩比較,P<0.05 為差異有統計學意義。經過Bonferroni校正[19]后3組對比結果設置為P<0.017(0.05/3)為差異有統計學意義。
結 果
不同觀察者對于ADC值測量的影響2個觀察者分別使用3種ROI測量ADC值的方法對卵巢癌患者的ROI測量最小和平均ADC值(表1)。
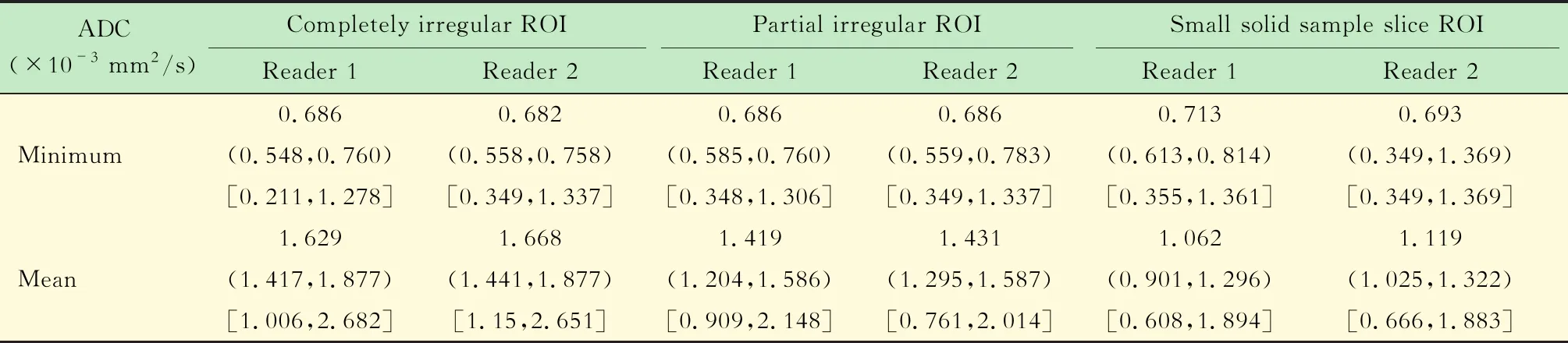
表1 3種ROI測量法獲得的ADCs結果對比Tab 1 The results of ADCs using 3 kinds of ROI measurement methods respectively
Data are expressed as medians;numbers in parentheses are first quartiles(q1)and third quartiles(q3);numbers in brackets are ranges.
2個觀察者使用3種方法對比最小ADC值,其均值差值及其差的95%CI結果:完全不規則ROI測量法為-0.001 5×10-3mm2/s [(-0.077 1~0.074 1)×10-3mm2/s,ICC=0.875 0],部分不規則ROI測量法為0.005 2×10-3mm2/s [(0.072 4~0.082 8)×10-3mm2/s,ICC=0.913 8],腫瘤內小ROI取樣法為0.018 9×10-3mm2/s [(-0.062 2~0.100 0)×10-3mm2/s,ICC=0.918 4)]。利用Bland-Altman描述3種測量方法,其中完全不規則ROI測量方法較其余2種方法的一致性差(圖1)。
2個觀察者3種方法對比平均ADC值,其均值差值及其差的95%CI結果:完全不規則ROI測量法為-0.013 9×10-3mm2/s [(-0.154 1~0.126 3)×10-3mm2/s,ICC=0.9014],部分不規則ROI測量法為-0.023 6×10-3mm2/s [(-0.139 1~0.092 0)×10-3mm2/s,ICC=0.892 5],腫瘤內小ROI取樣法為-0.045 6×10-3mm2/s [(-0.156 7~0.065 4)×10-3mm2/s,ICC=0.859 5]。同樣利用Bland-Altman法描述3種測量方法,其中部分不規則ROI測量方法較其余2種方法的一致性好(圖2)。
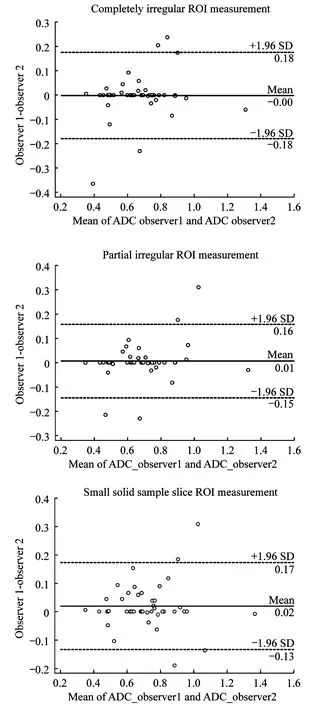
For the Bland-Altman plots:the difference of minimum ADC measurements(Y-axis)were plotted against the mean minimum ADCs(X-axis),with mean absolute difference(bias)(continuous line)and 95% CI of the mean difference(limits of agreement)(dashed lines).
圖1 2個觀察者3種ROI測量法對卵巢癌最小ADC的一致性
Fig 1 Interobserver reproducibility of the minimum ADC (×10-3mm2/s)measured by all 3 ROI methods in ovarian tumor
For the Bland-Altman plots:the difference of mean ADC measurements(y-axis)were plotted against the mean minimum ADCs(x-axis),with mean absolute difference(bias)(continuous line)and 95% confidence interval of the mean difference(limits of agreement)(dashed lines).
圖2 2個觀察者3種ROI測量法對卵巢癌平均ADC的一致性
Fig 2 Interobserver reproducibility of the mean ADC (×10-3mm2/s)measured by all 3 ROI methods in ovarian tumor
3種方法獲得的ADC值對比分析對比45例卵巢癌患者的最小和平均ADC值,分別使用完全不規則、部分不規則和腫瘤內小ROI測量法進行統計分析,分別對應方法1、2、3(表2)。方差分析證明3種方法測得的最小和平均ADC值之間差異均有統計學意義(P均<0.05)。兩兩對比分析后顯示方法1與方法2在最小ADC值測量時差異無統計學意義(P=0.12),而方法3與方法1、2比較差異均有統計學意義(P均<0.017),而在平均ADC值測量時,任意兩種方法之間差異均有統計學意義(P均<0.001)。

表2 3種方法測得的卵巢癌最小和平均ADC值兩兩對比分析結果Tab 2 The minimum and mean ADCs of ovarian tumor were compared by 3 ROI methods
Method 1:Completely irregular ROI measurement;Method 2:Partial irregular ROI measurement;Method 3:Small solid sample slice ROI measurement.
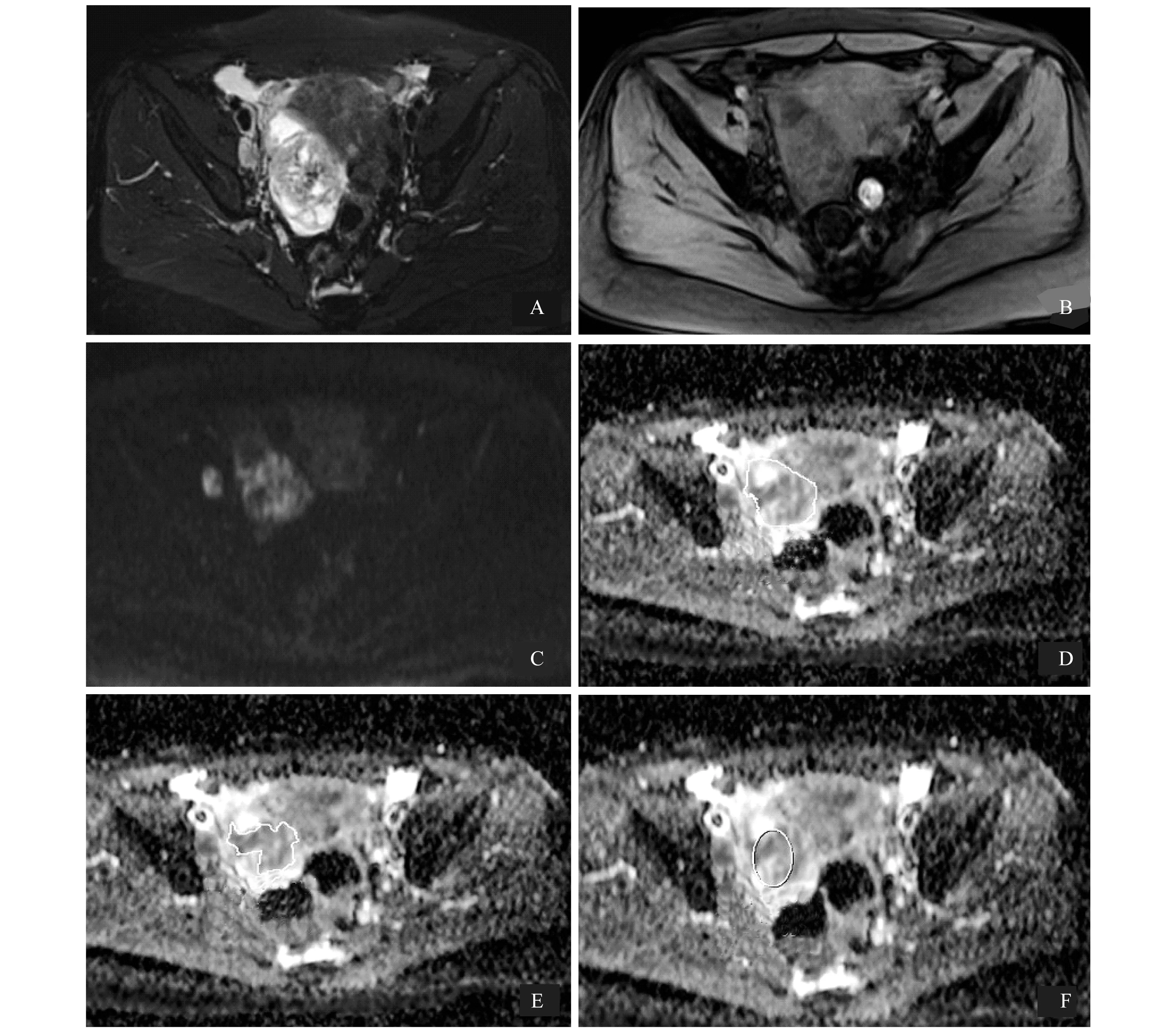
ADC measurements of the tumor were performed on an ADC map using three distinct ROI protocols:completely irregular ROI measurement(D),partial irregular ROI measurement(E),and small solid sample of tumor(F).The solid components of the tumor were identified on T2-weighted-fs(A),T1-weighted-fs(B)and DWI images(C),which were matched on ADC map.
圖3 同一患者分別使用3種ROI方法獲得的磁共振圖像
Fig 3 Magnetic resonance images of the same patient using the 3 ROI methods
討 論
卵巢腫瘤從形態上可分為囊性、囊實性和實性3類。囊性腫瘤最常見,主要包括囊腺瘤、畸胎瘤和部分轉移瘤。囊實性和實性腫瘤包括上皮-間質性腫瘤(漿液性、黏液性、子宮內膜樣、透明細胞腫瘤等)、性索-間質腫瘤(顆粒細胞瘤、纖維-卵泡膜細胞瘤、支持-間質細胞瘤等)和生殖細胞腫瘤等20多種。病理上可分為良性、交界性和惡性腫瘤,其中良性腫瘤最常見,約占57%,惡性腫瘤占33%,交界性腫瘤占10%。卵巢腫瘤的病理類型多樣、且影像學表現復雜,使術前正確定性存在較大困難。
DWI通過檢測組織中水分子的擴散反映由病理過程引起的組織細胞密度、細胞膜完整性、細胞外間隙迂曲度和液體黏度等病理改變所致的水分子運動狀態的異常[20]。組織內水分子運動的通路和距離由疏水細胞膜和大分子、主動轉運機制及微循環共同決定[21],ADC反映了上述結構及功能性因素對水擴散的實際效果。細胞密度、細胞外間隙大小、大分子物質的變化都會影響ADC值。細胞密度高的實體瘤中,細胞外間隙顯著減少,水擴散受限更為明顯,ADC值降低[22]。近年來,卵巢腫瘤的DWI研究日益增多,包括盆腔腫瘤的檢測、鑒別診斷、分類和分級、評估腫瘤侵襲及淋巴結轉移、監測腫瘤治療后的反應及有無復發等[6,23]。
本研究結果證明卵巢癌患者的最小ADC值、平均ADC值和觀察者的一致性都與ROI方法的選擇有關。對于卵巢癌患者,觀察者使用3種方法測得的平均ADC值的一致性都是可以接受的,其中不規則ROI測量方法的一致性最令人滿意。最小和平均ADC值的測量很早就被用作評價卵巢癌的指標,然而極少有研究能證明卵巢癌3種ROI測量方法的可靠性。先前評估觀察者使用3種ROI方法的一致性研究可見于局部的晚期直腸癌[24]和胰腺腺癌[25],結論指出ROI的大小和位置對平均ADC值有一定影響,特別是全容積法勾畫ROI所測得的ADC值能得出最令人滿意的結果。一項子宮內膜癌的研究調查了不同形狀的ROI對腫瘤ADC值及觀察者一致性的影響[26],結論指出由于癌灶存在于宮腔內,其形狀近似圓形或橢圓形,不同形狀的ROI測量對平均ADC值沒有明顯影響。最近的一項關于卵巢癌不同形狀的ROI對ADC值及診斷良惡性能力的研究指出,不同形狀的ROI對于兩者均有重要意義[27]。考慮到卵巢癌的復雜性,成分混雜不單一,特別是完全囊性的患者,測量結果不能準確反映病變的生物學特性,本研究采用3種方法進行對比研究。雖然在實際的應用中完全不規則ROI法和部分不規則ROI法測量ADC值的時間較腫瘤內小ROI取樣法時間稍長,但統計分析表明時間差異無統計學意義。而全容積法應該更適用于全實性或者實性含量占大部分的腫瘤患者。
對其中任意的兩種方法所測得的最小ADC值作分析,結果均有統計學意義,這與Mukuda等[27]的研究結論相一致。更有意義的是部分不規則ROI法測得的最小ADC值的平均值最小,它是沿著腫瘤實性成份最大層面DWI圖畫出病灶邊界,盡可能去除腫瘤的鈣化壞死、囊腫、出血等部分,包含成份比較全面。相對于另外兩種方法來說,腫瘤內小ROI取樣法結果顯示平均ADC值顯著降低,因為它的取樣只包含大部分有活力的實性部分。另外,小ROI取樣時已經極大可能地排除了血管、導管、壞死等成份的影響,而實際上這些因素均會導致ADC值的差異。然而,不規則ROI法及部分不規則ROI法能獲得相對高的ADC值,因為它們很可能包括實性成份、導管和纖維化等。在臨床應用中,腫瘤內小ROI取樣法被廣泛應用于卵巢癌ADC值的測量。在本研究中,2個獨立觀察者使用3種測量方法的層面在測量前已達成一致,因為卵巢癌的病灶一般都不規則,范圍較大,成份比較復雜,不同的選層標準對測量結果影響很大。本文中盡管小ROI取樣的方法顯著降低了平均ADC值,但在比較觀察者一致性時也是有統計學意義的。因此,我們認為小ROI取樣法不是最優的測量方法,而在一個病灶直徑最大的層面上去除出血鈣化、囊腫、壞死等的部分不規則ROI法更優越。事實上除了病理因素會影響ADC值的測量外,還有其他很多因素:最普遍的有磁場強度、呼吸補償采集技術、b值的選擇,還有后處理方法等從內在影響最終的ADC值[28]。本研究中,所有患者的檢查及DWI圖像采集在一家醫院的同一臺1.5T磁共振機器上完成,從而避免了客觀上存在的差異。
本研究的不足之處在于:首先,樣本數較少,很多情況下由于卵巢癌的病灶范圍較大,廣泛累及周圍器官或超出盆腔,與相鄰器官分界不清,病灶里面壞死、出血、囊腫等成份復雜,無法準確地畫出病灶的邊界。其次,我們獲得的DWI圖使用了一個相對低的b值(800 s/mm2),它減少了運動偽影的影響及升高了信號噪聲比值。相對低的b值能獲得相對高質量的圖像,但相對高的b值能更敏感地反映組織真實的擴散。為了減少患者的檢查時間本研究只使用了兩個b值(0和800 s/mm2),許多患者因為病情的原因不能耐受長時間的掃描。理論上來講采用多個b值能更精確地測量ADC值,近年來IVIM序列越來越廣泛地應用于臨床研究已經說明了其優越性。再次,我們所使用的3種ROI測量方法所測得的ADC值沒有通過不同的磁場強度或者不同的b值來進行比較分析,不同磁場強度或b值的選擇可能會帶來不同的分析結果。
綜上所述,ROI測量方法的不同對最小和平均ADC值、觀察者的一致性影響很大,本文的3種方法中部分不規則ROI法對3個指標的評估結果均較好,而完全不規則ROI法相對較差。

