EGFR 19和21外顯子突變非小細胞肺癌患者的外周血微量元素含量對比及原因分析
李文潔 李王平 金發光 褚代芳 陳艷麗
全球范圍內,腫瘤的發病率和死亡率均呈上升趨勢,有數據顯示,每年全球肺癌患者新發病例數超過100萬[1]。2015年數據顯示我國肺癌新發病例超過70萬,死亡人數達到 61 萬[2],發病率和死亡人數均居于所有腫瘤的首位,其中大部分患者病理類型為非小細胞肺癌(non-small cell lung carcinoma, NSCLC)。不難發現,NSCLC嚴重影響我國居民的身心健康,也是臨床工作的一大挑戰。微量元素不僅是人體組織的重要組成成分,而且是許多酶的組成成分或酶作用的輔助因子,過低或過高均會提示身體處于異常狀態。大量的研究證實微量元素在多種癌癥發生發展中扮演了重要角色[3-4],惡性腫瘤患者出現血清中銅、銅/鋅比值升高的現象[5],肺癌組織中部分微量元素的含量均低于癌旁組織和正常肺組織,但部分微量元素含量高于癌旁組織和正常肺組織,甚至有報道發現微量元素含量與腫瘤的病理分級有關。可見微量元素對腫瘤的發生發展均存在著影響,然而是否會影響NSCLC患者的表皮生長因子受體(epidermal growth factor receptor, EGFR)基因狀態尚無定論。本文對比分析EGFR 19和21外顯子突變NSCLC患者的外周血微量元素含量差異,旨在為肺癌的干預提供新的思路。
資料與方法
一、一般資料
選取于2017年1月至2018年6月在我院進行救治的NSCLC患者作為研究對象。納入標準:①病理診斷符合NSCLC[6];②未發現遠處轉移或者其他腫瘤者;③所有患者均在治療前檢測外周血微量元素;④所有患者均進行高通量二代測序(NGS)檢測患者EGFR基因突變狀態,檢測結果是EGFR21號外顯子或19號外顯子突變;⑤所有患者均簽署由我院倫理委員會批準同意的知情同意書。排除標準:①近期有服用微量元素相關補充劑者;②合并其他惡性腫瘤者;③嚴重的肝腎功能障礙者。符合納入標準和排除標準的患者共54例,其中男31例,女21例,最小年齡35歲,最大年齡80歲,平均年齡(49.28±6.15)歲。根據患者EGFR基因檢測結果進行分組, EGFR19號外顯子突變記為A組(n=26),其中男15例,女11例,最小年齡36歲,最大年齡79歲,平均年齡(49.21±7.24)歲;EGFR 21號外顯子突變記為B組(n=28),其中男16例,女12例,最小年齡35歲,最大年齡80歲,平均年齡(49.30±6.65)歲。同時選擇同期在我院進行健康體檢者作為對照(記為C組,n=36),其中男20例,女16例,年齡42~65歲,平均年齡(49.57±4.87)歲。三組基線資料,對比無差異(P>0.05),具有可比性。
二、研究方法
1. 肺癌患者組織病理及EGFR基因檢測: 所有入組患者均行組織穿刺活檢,穿刺組織使用10%中性緩沖福爾馬林固定液進行固定,脫水后進行石蠟包埋,部分切片進行標準的HE染色,明確肺癌病理分型。
2. EGFR突變檢測: 采集患者肺癌組織樣本,送至我院呼吸內科實驗室進行檢測,檢測采用高通量測序(next-generation sequencing, NGS)方法,測定EGFR基因狀態,該檢測技術,可用于檢測多種EGFR基因變異形式,包括點突變、小片段插入缺失、基因重排和拷貝數變異等。
3. 微量元素檢測: 采集所有入組對象的清晨空腹靜脈全血3 ml,室溫靜置30 min,進行離心處理(以離心半徑8 cm,3 000 r/min,時間10 min),取上清血清進行鐵(Fe)、鋅(Zn)、鈣(Ca)、鎂(Mg)含量檢測。所有檢測均嚴格按照相關儀器、試劑盒說明書標準進行操作,同時做好室內質量控制工作,確保檢測結果的準確性。其中微量元素正常值參考范圍鐵(Fe)為8.1~28.3 μmol/L、鋅(Zn)為9.8~16.8 μmol/L、鈣(Ca)2.02~2.6 mmol/L、鎂(Mg)0.5~1.2 mmol/L。
4. 觀察指標: 詳細記錄三組患者血清鐵(Fe)、鋅(Zn)、鈣(Ca)、鎂(Mg),對比分析兩組微量元素含量的差異。
三、統計學方法
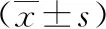
結 果
一、三組血清鐵(Fe)、鋅(Zn)、鈣(Ca)、鎂(Mg)含量的比較
A組與B組比較,兩組的血清鐵、鋅、鈣、鎂含量,差異無統計學意義(P>0.05)。A組與C組比較,兩組的血清鐵、鋅、鈣、鎂含量,差異有統計學意義(P<0.05)。B組與C組比較,兩組的血清鐵、鋅、銅、鈣、鎂含量,差異有統計學意義(P<0.05),見表1。

表2三組血清鐵、鋅、鈣、鎂含量異常率比較[n(%)]

表1三組血清鐵、鋅、鈣、鎂含量的比較
注:a代表A組與C組比較,P<0.05,b代表是B組與C組比較,P<0.05
二、三組血清鐵、鋅、鈣、鎂含量異常率比較
A、B兩組血清鐵、鋅、鈣、鎂含量異常率均顯著低于C,且差異具有統計學意義(P<0.05),見表2。
討 論
微量元素是指含量處于人體總量的萬分之一以下,且每日需攝入量低于100 Mn的元素。聯合國糧食及農業組織(FAO)/世界衛生組織(WHO)1998年將銅(Cu)、鈷(Co)、鉻(Cr)、鐵(Fe)、氟(F)、碘(I)、錳(Mn)、鉬(Mo)、硒(Se) 和鋅(Zn)等10種列為維持人體正常生命活動所不可缺少的必需微量元素[7]。本文由于本院檢測技術限制,只納入了鐵、鋅、鈣、鎂作為觀察指標。結果發現EGFR19號外顯子與21號外顯子突變的NSCLC中的微量元素血清鐵、鋅、鈣、鎂含量均較健康人群顯著降低(P<0.05),同時微量元素的異常率均高于健康人群,分析其可能原因有:①鋅(Zn)下降的原因: 鋅元素是大腦神經物質重要成分,當鋅元素缺乏時,降低腦細胞中的色素氧化酶含量,易造成神經系統失調,導致大腦功能障礙,表現出機體活力下降,記憶衰退,反應遲鈍,思維紊亂,步態不穩、運動失常等臨床癥狀。鋅元素也是體內酶的成分重要部分,對細胞合成及機體免疫系統起到調控作用。有研究發現鋅含量下降會影響CD4+/CD8+的比值[8],從而導致機體免疫功能紊亂;②鐵(Fe)下降的原因: 肺癌患者可能會發生癌性貧血,其原因可能是其可能的機制是Hepc-25的異常增多引起鐵代謝異常,通過體循環和/或內分泌機制[9-10],使鐵存儲在儲鐵細胞中。一方面減少網狀內皮系統釋放鐵及減少腸道對鐵的吸收等負性調節,平衡機體的鐵代謝,進而降低血清鐵濃度及轉鐵蛋白飽和度,由于貧血的發生可能導致乏氧出現[11],乏氧可以改變腫瘤細胞的基因表達,改變基因組,隨之使得蛋白質組發生改變,增強腫瘤侵襲性,發生腫瘤進展。乏氧對腫瘤血管形成有促進作用,激活多種促凝因子表達,加速腫瘤細胞的浸潤和轉移。乏氧增加了腫瘤組織對放化療及相關治療的抵抗力,使得治療效果大打折扣,影響腫瘤患者的預后; ③鈣和鎂含量下降原因:維生素D可通過其代謝產物1,25(OH)2D3而影響B淋巴細胞增殖分化、T淋巴細胞的增值成熟,進而影響機體免疫功能,其中Th17/Treg 細胞失衡與自身免疫性疾病有關[12]。鎂可維持神經細胞的興奮性及穩定性,通過抑制5-羥色胺再攝取進而達到抑制平滑肌收縮,目前尚不清楚是由于鐵、鋅、鈣、鎂等微量元素缺失而導致肺癌EGFR基因突變還是因為EGFR基因突變后導致患者鐵、鋅、鈣、鎂等微量元素下降,因此仍需要更多的研究來進一步證實。
綜上所述,NSCLC患者 EGFR19號外顯子與21號外顯子的外周血微量元素鐵、鋅、鈣、鎂均較健康人群普遍降低,但在19號外顯子和21號外顯子之間,微量元素含量不存在明顯差異。

