牦牛不同組織SREBP-1基因表達差異分析
袁錦瑩, 孫萬成, 羅毅皓, 謝鳳蓮
(青海大學農牧學院,青海 西寧 810016)
青海特殊的高原氣候賦予了牦牛乳高于普通牛乳的營養價值。牦牛乳的脂肪和蛋白質的含量較普通牛乳高。牦牛乳的乳脂率平均達7.5%,高于普通牛乳,蛋白質含量平均達5.2%,也高于普通牛乳,且干物質總量也高于普通牛乳[1]。牦牛乳是一種高脂高蛋白的天然濃縮乳,是乳制品加工和制作的優良原料乳[2-4]。
青海牦牛是生長在青藏高原地區的一種稀有牛種,這里海拔高,氣候寒冷,因此造就了牦牛不同于普通牛種的獨特體質,牦牛肉脂肪含量不高,并含有大量的營養成分和豐富的微量元素,特別是含有人體必需的脂肪酸,對人體的健康是非常重要的[5-8]。加之它們常年以這一地區的天然牧草為食,所產的牦牛奶具有獨特的營養[9]。
在脂肪組織中,脂肪生成相關基因的表達水平受到許多轉錄因子的調控[10]。有研究指出,甾醇類調控元件結合蛋白(SREBP)是一種核轉錄因子,在酯類合成中,尤其是在固醇類和脂肪酸合成中起到重要作用[11]。SREBP是物體內脂肪合成的一個極重要的調節因子,通過調節動物體內與脂肪生成相關的酶(生脂酶)的基因轉錄水平而調節這些酶的活性,從而控制體內脂肪合成。
已有研究證明,SREBP-1是哺乳動物肝臟脂肪生成基因的主要調節者,能調節脂肪酸、甘油三酯和膽固醇合成的30多個基因的表達[12]。也有研究證實,SREBP-1是脂肪酸合成相關酶基因的上游調節元件[13]。金世杰等[14]研究者在對黃牛中SCD1與SREBP-1的協同表達研究后發現,SREBP-1可激活SCD1脂肪酸合成酶,導致脂肪酸合成增加,造成肝臟脂質蓄積。
青海是全國五大牧區之一,是牦牛的主要產區,目前全省有牦牛約500萬頭。牦牛是青海的特色,具有其獨特的營養價值。而關于改善青海牦牛肉品質的研究鮮有報道,為此,本研究采集青海省不同地區不同季節的牦牛結腸、腎臟和肝臟3種組織的樣品,提取Total RNA,在逆轉錄聚合酶的作用下生成cDNA,以逆轉錄產物為模板,利用Real-time PCR檢測牦牛甾醇類調控元件結合蛋白1(SREBP-1)基因mRNA的表達水平,旨在為進一步改善牛肉品質提供可借鑒的理論依據。
1 材料與方法
1.1 材料與試劑
采集不同季節不同地區的牦牛肝臟、腎臟和結腸,于凍存管中投入液氮罐保存備用;RNAprep Pure Tissue Kit試劑盒,購自天根生物科技(北京)有限公司;TaKaRa PrimeScript ? RT reagent Kit試劑盒,購自寶生物工程(大連)有限公司;SYBR ?Premix Ex TaqTMⅡ,購自寶生物工程(大連)有限公司;DNA聚合酶,購自寶生物工程(大連)有限公司。
1.2 儀器與設備
低溫離心機(上海滬粵明科學儀器有限公司);AlphaTM Unit Block Assembly for DNA Engine ? System (BIO-RAD);電泳儀BG-Power 300(BAYGENE BIOTECH COMPANY LIMITED);凝膠成像分析儀WD-9413A(北京市六一儀器廠);iQTM 5 Multicolor Real-time PCR Detection system(BIO-RAD)。
1.3 方 法
1.3.1 引物設計 引物(表1)是由上海生工生物工程技術服務有限公司合成。

表1 引物序列信息
1.3.2 牦牛肝臟、腎臟及總RNA的提取 使用RNAprep Pure Tissue Kit試劑盒分別從新鮮或超低溫凍存的肝臟樣品中提取總RNA,最后進行RNA純度與濃度檢測,并用1.5%瓊脂糖凝膠電泳檢測其完整性。
1.3.3 RNA凝膠電泳 根據樣品量選擇合適大小的凝膠,表2中的配方可按相應比例擴大[15]。

表2 電泳膠配方
1.3.4 不同季節牦牛肝臟、腎臟及結腸cDNA的合成 cDNA的合成以從2015年春季祁連縣、2015年秋季大通縣、2016年春季湟中縣采集的牦牛肝臟、腎臟和結腸中提取的Total RNA為模板,按試劑盒推薦方法進行操作。
1.3.5 不同季節牦牛不同組織的實時定量PCR 以合成的cDNA為模板,按試劑盒推薦方法進行操作。
1.3.6 熒光定量PCR 按試劑盒推薦方法進行操作,按表3中的組分配制反應液(反應液配制在冰上進行),熒光定量時,β-actin作為內參進行實時定量PCR。

表3 熒光定量反應液
1.3.7 統計方法 利用SPSS 16.0軟件分析統計組的差異性,采用最小顯著差數法,計量數據用平均值±標準差,采用t檢驗,P<0.05表示脂肪酸差異有統計學意義。
2 結果與分析
2.1 提取的RNA檢測
從RNA電泳圖(圖1)可以看出,上方的28S和下方18S條帶都很清晰,且28S約為18S條帶亮度的2倍,說明提取的RNA完整性良好。
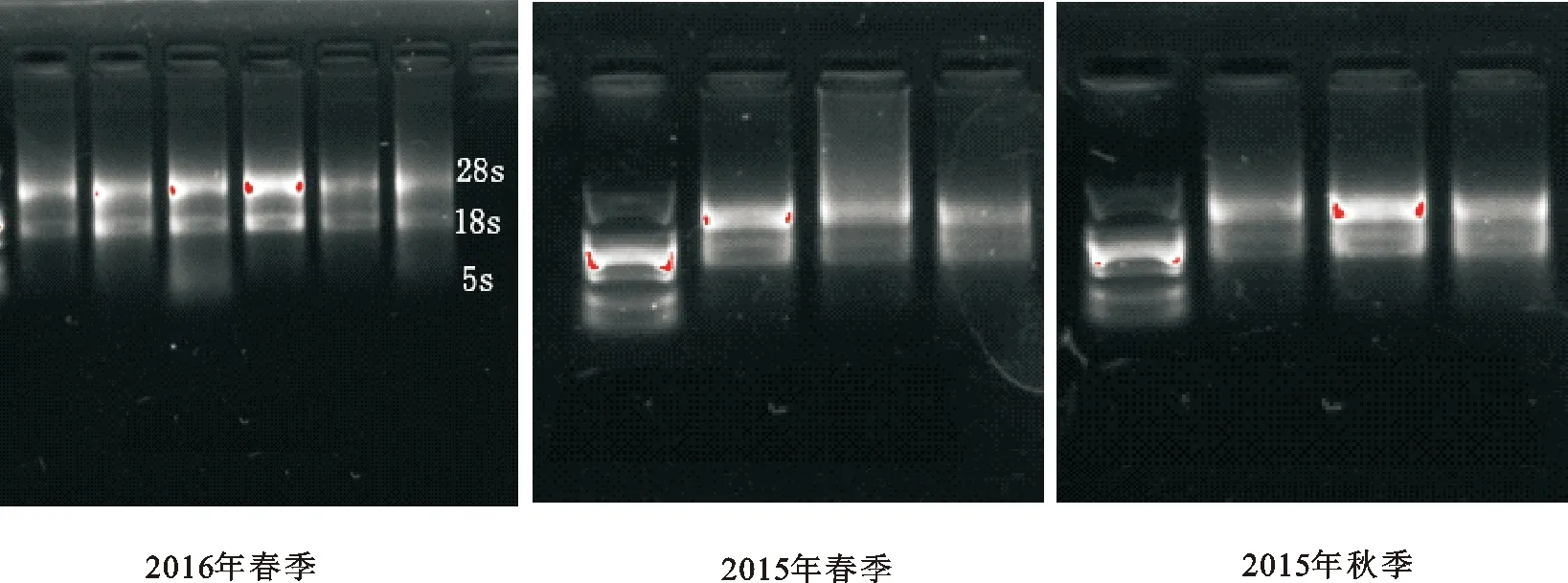
圖1 不同樣品RNA電泳圖
2.2 牦牛肝臟、腎臟及結腸SREBP-1基因cDNA的合成
圖2為由3個組織中提取的RNA反轉錄后擴增的結果圖。利用在編碼區兩側設計的牦牛SREBP-1引物擴增cDNA,獲得約150 bp的DNA片段。

圖2 樣品SREBP-1引物擴增結果
2.3 SREBP-1基因PCR熒光定量
由圖3可以看出,SREBP-1基因在2015年春季祁連縣、2015年秋季大通縣和2016年春季湟中縣的熒光定量結果,溶解曲線只有1個峰,說明其兩對引物的特異性強,沒有引物二聚體和非特異性產物,所以進行熒光定量可以真實地反映出牦牛不同組織中引物mRNA的表達。
采用相對定量[16],通過比較閾值法(2-ΔΔCt)進行相對定量[17]。
Ct值是擴增DNA的量達到閾值時候的循環次數[18]。由表4、表5和表6可以看出,Ct值與起始模板的關系研究表明,每個模板的Ct值與該模板的起始拷貝數的對數存在線性關系,起始拷貝數越多,Ct值越小。
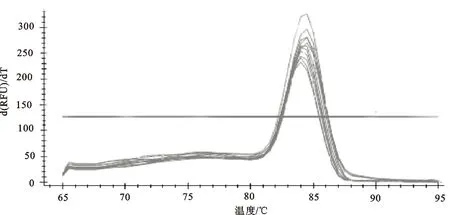
圖3 SREBP-1的溶解曲線分析
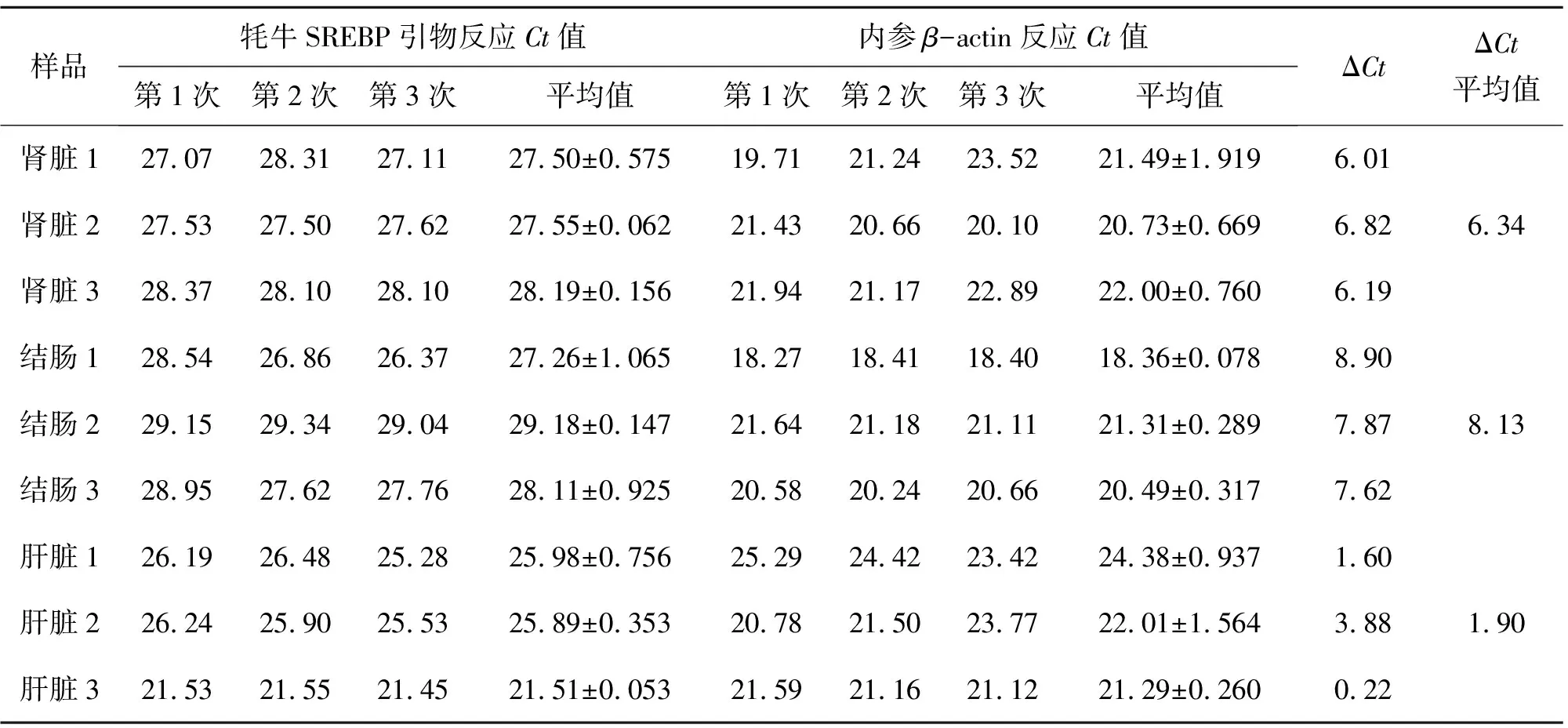
樣品牦牛SREBP引物反應Ct值內參β-actin反應Ct值第1次第2次第3次平均值第1次第2次第3次平均值ΔCtΔCt平均值腎臟127.07 28.31 27.11 27.50±0.57519.7121.24 23.52 21.49±1.9196.01 腎臟227.53 27.50 27.62 27.55±0.06221.4320.66 20.10 20.73±0.6696.82 6.34腎臟328.37 28.10 28.10 28.19±0.15621.9421.17 22.89 22.00±0.7606.19 結腸128.54 26.86 26.37 27.26±1.06518.2718.41 18.40 18.36±0.0788.90 結腸229.15 29.34 29.04 29.18±0.14721.6421.18 21.11 21.31±0.2897.87 8.13結腸328.95 27.62 27.76 28.11±0.92520.5820.24 20.66 20.49±0.3177.62 肝臟126.19 26.48 25.28 25.98±0.75625.2924.42 23.42 24.38±0.9371.60 肝臟226.24 25.90 25.53 25.89±0.35320.7821.50 23.77 22.01±1.5643.88 1.90肝臟321.53 21.55 21.45 21.51±0.05321.5921.16 21.12 21.29±0.2600.22
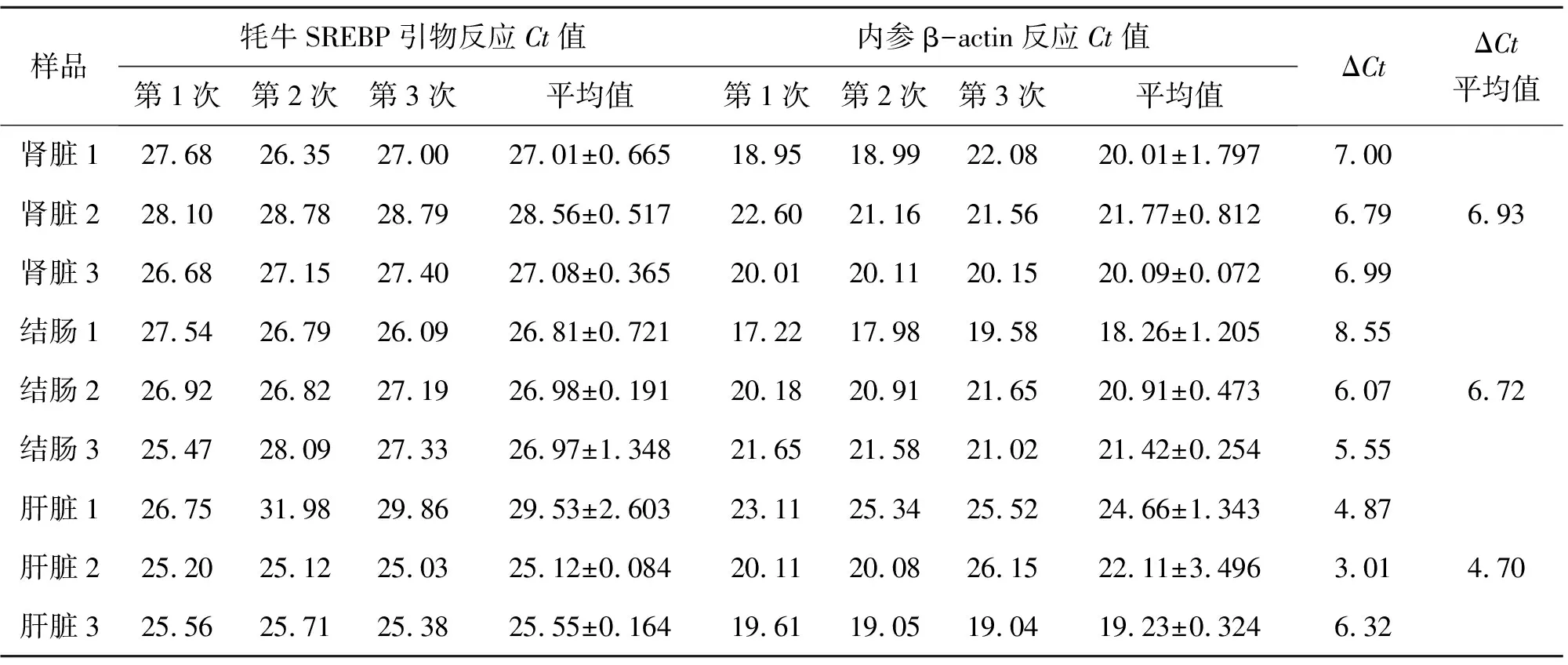
表5 2015年秋季大通縣SREBP-1基因熒光定量
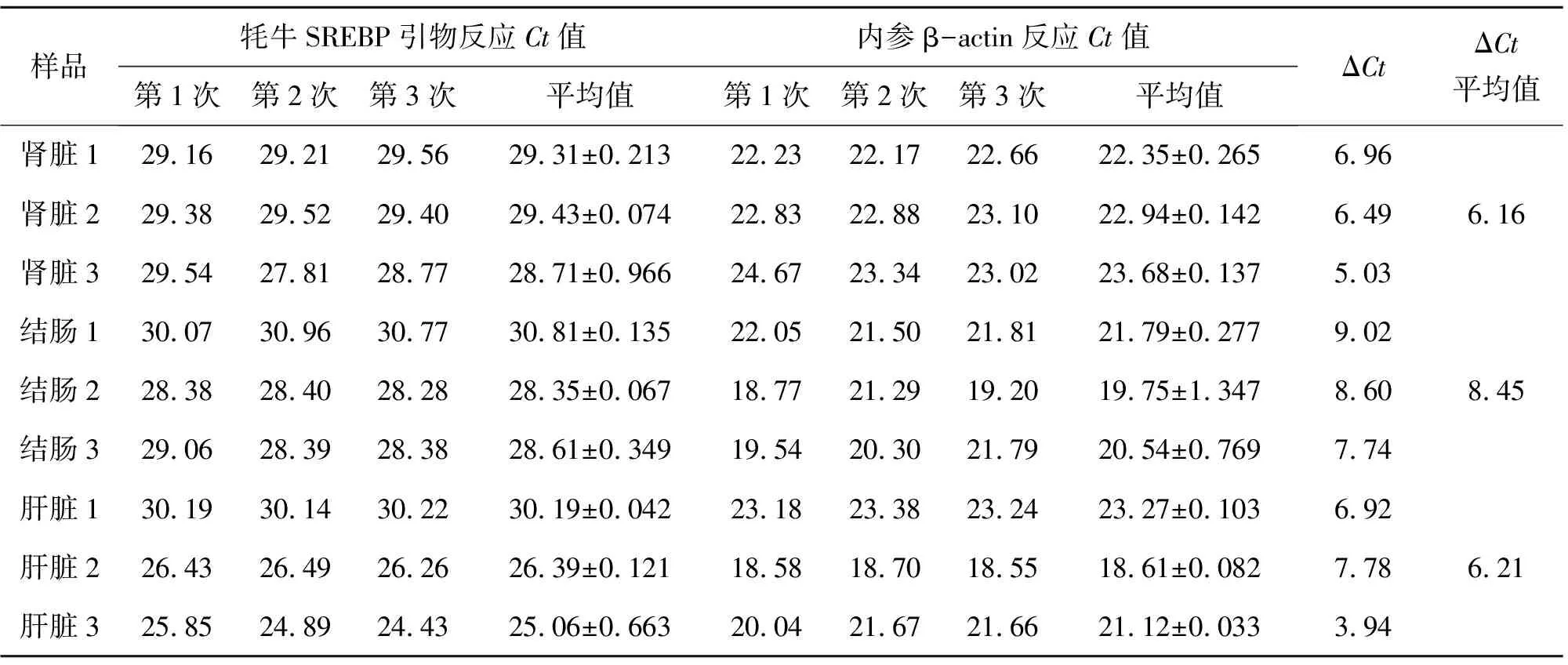
表6 2016年春季湟中縣SREBP-1基因熒光定量
將肝臟樣品作為對照樣品,將對照組的2-ΔΔCt值設為1進行閾值比較。
根據公式:
2-ΔΔCt=
2-[(實驗組SREBPCt-實驗組β-ACTIN Ct)-(對照組SREBPCt-對照組β-ACTIN Ct)]
(1)
由公式(1)計算得,
表4,2015年春季:
腎臟,2-(6.34-1.90)=0.046
結腸,2-(8.13-1.90)=0.013
表5,2015年秋季:
腎臟,2-(6.93-4.70)=0.213
結腸,2-(6.72-4.70)=0.247
表6,2016年春季:
腎臟,2-(6.16-6.21)=1.035
結腸,2-(8.45-6.21)=0.212
由上述結果可以得出,SREBP-1 mRNA相對定量的拷貝數。
通過對SREBP-1的DNA重復3次進行熒光定量PCR檢測法,測出它們的平均ΔCt值,再根據比較閾值法進行相對定量的結果。
由圖4可以看出,不同季節中除了2016年春季湟中縣的牦牛,其他的均以肝臟樣品中的SREBP-1 mRNA相對定量拷貝數最高。2015年春季祁連縣牦牛SREBP-1基因相對表達量由大到小為:肝臟、腎臟、結腸;2015年秋季大通縣牦牛SREBP-1基因相對表達量由大到小為:肝臟、結腸、腎臟;2016年春季湟中縣牦牛SREBP-1基因相對表達量由大到小為:腎臟、肝臟、結腸。
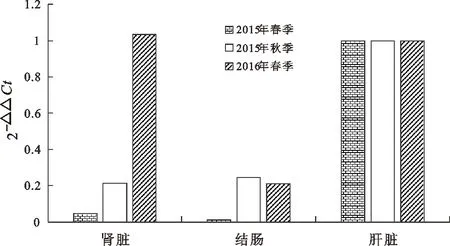
圖4 不同季節SREBP-1基因在牦牛不同組織中相對表達量
2.4 不同季節SREBP-1基因相對表達量相關性分析
從表7中可以看出,SREBP-1基因在2015年春季祁連縣和2016春季湟中縣中相對表達量差異極顯著,在2015年秋季大通縣和2016年春季湟中縣中相對表達量差異不顯著,并在2015年春季祁連縣和2015年秋季大通縣中相對表達量差異不顯著。

表7 3個季節SREBP-1相對表達量相關性分析
注:*表示差異顯著P<0.05,**表示差異極顯著P<0.01。下同。
2.5 SREBP-1基因在牦牛不同組織中的相對表達量
由圖5可以看出,牦牛不同組織中SREBP-1基因相對表達量由大到小順序為,肝臟、腎臟、結腸。
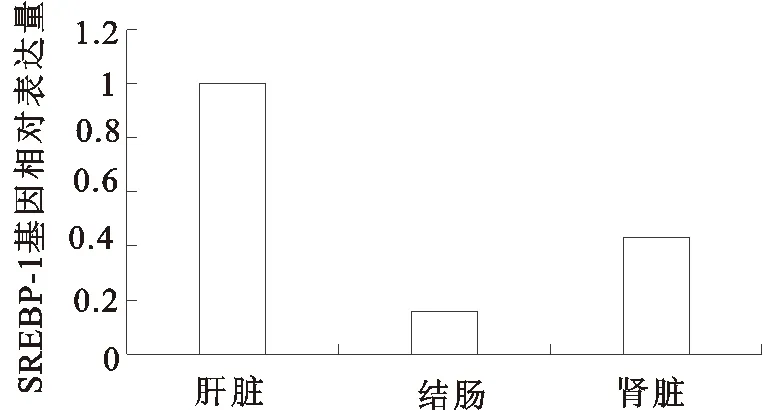
圖5 SREBP-1基因在牦牛不同組織中的相對表達量
2.6 3個組織SREBP-1基因相對表達量相關性分析
從表8中可以看出,SREBP-1基因在結腸和肝臟中相對表達量差異極顯著,在腎臟和肝臟中相對達量差異顯著,而在結腸和腎臟中相對表達量差異則不顯著。
SREBP-1的作用主要包括調控脂肪細胞的分化,以及類固醇和脂肪酸的合成過程。SREBP-1基因可以直接調節脂肪沉積,還可參與脂肪生成相關基因的表達水平的調控,間接調節脂肪的生成。目前對SREBP-1基因的研究也主要集中在豬、雞、兔上。例如,2001年,Gondret等使用Northern印跡法對SREBP-1 mRNA豬、雞、兔的組織中的表達量進行檢測分析,預測SREBP-1基因在肝臟和脂肪這兩種組織間相對表達量的高低[19]。
SREBP-1mRNA在兔的肝臟以及脂肪組織中從表達水平上看幾乎保持在一個水平,在雞的脂肪組織中SREBP-1 mRNA 的表達水平比在肝臟中低了近乎3倍左右[20]。除此之外,SREBP-1信號轉導途徑在脂肪代謝性疾病研究中起著重要的作用[21]。本研究檢測SREBP-1基因在牛的組織中的相對表達量,發現SREBP-1 基因在青海牦牛的3個組織中均有表達,但在2015年春季祁連的牦牛結腸和腎臟中的表達均不高,其中,SREBP-1基因在2016年春季湟中的牦牛腎臟中表達最高。預測不同生長環境和不同季節也會對SREBP-1基因的表達產生一定的影響。
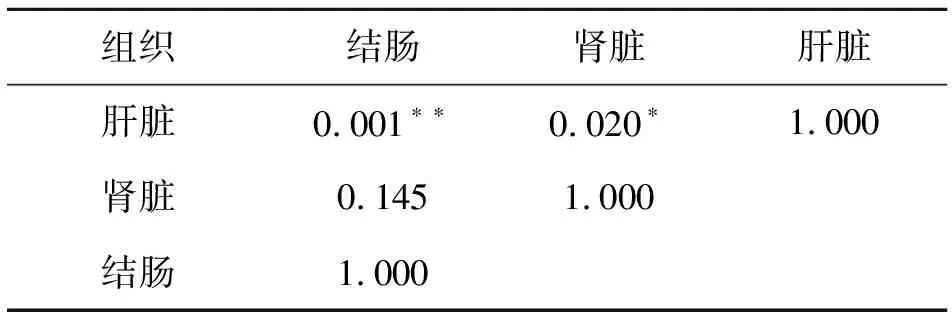
表8 3個組織SREBP-1相對表達量相關性分析
3 結 論
青海牦牛不同組織中SREBP-1基因相對表達量為:肝臟>腎臟>結腸。3個組織中SREBP-1基因在結腸和肝臟中相對表達量差異極顯著,在腎臟和肝臟中相對表達量差異顯著,而在結腸和腎臟中相對表達量差異則不顯著。不同季節中除了2016年春季湟中縣的牦牛,其他的均以肝臟樣品中的SREBP-1 mRNA相對定量拷貝數最高。2015年春季祁連縣牦牛SREBP-1基因相對表達量由大到小為,肝臟、腎臟、結腸;2015年秋季大通縣牦牛SREBP-1基因相對表達量由大到小為,肝臟、結腸、腎臟;2016年春季湟中縣牦牛SREBP-1基因相對表達量由大到小為,腎臟、肝臟、結腸。
不同季節間SREBP-1基因在2015春季祁連縣和2016春季湟中縣中相對表達量差異極顯著,在2015年秋季大通縣和2016春季湟中,2015春季祁連縣和2015秋季大通縣中相對表達量差異則不顯著。

