自噬吞噬對miR-155調控結腸癌細胞存活和凋亡的影響
李 濤,宛迎春,周長玉*,蘇子源
(1.吉林大學中日聯誼醫院,吉林 長春130033;2.長春中醫藥大學附屬醫院)
全球平均每年有100萬人被診斷出患有結直腸癌[12],結直腸癌存在的類型多樣,約40%的病例攜帶KRAS突變,10%為BRAF突變[3]。與野生型KRAS患者相比,突變的KRAS預示著不良的預后和生存,同時耐受抗表皮生長因子受體(EGFR)治療[4-6]。成熟的microRNAs (miRNAs)是內源性轉錄調節RNA分子,長度僅有18-25 bp,與目標mRNA 3’UTR相結合,負向調節其翻譯[7]。miRNAs已被廣泛證實可以調控基礎細胞過程,如增殖,分化,發育,細胞凋亡和細胞周期[8]。本課題擬通過體外實驗明確自體吞噬在miR-155誘導結腸癌細胞死亡和凋亡中的作用,為臨床治療結腸癌提供新的策略和理論依據。
1 材料與方法
1.1 細胞與試劑
人結腸癌HCT116,SW480,HT-29細胞和人結腸上皮細胞NCM460購買于中國科學院細胞庫。細胞培養用胎牛血清FBS和DMEM高糖培養液購買于美國GIBCO公司,1640培養液和細胞消化用胰酶購買于美國Hyclone 公司。miR-155 inhibitor和對照購買自上海吉瑪制藥技術有限公司,自噬抑制劑3-MA購買自美國Sigma公司,LC3和Cleaved caspase-3抗體購買自美國CST公司。
1.2 RT-qPCR
利用Trizol試劑方法提取細胞中總RNA,提取總RNA后利用TaqMan進行實時逆轉錄聚合酶反應(RT-PCR),miR-155所用引物和內源性對照U6購買自上海吉瑪制藥技術有限公司,利用ABI 7300檢測系統對結果進行檢測。
1.3 細胞轉染
利用lipofectamine3000進行細胞轉染,細胞培養至80%進行細胞轉染,將細胞培養液換成Opti-MEM培養液,利用Opti-MEM稀釋lip3000和DNA,同時在DNA溶解液中加入P3000,室溫孵育10分鐘,滴入已經換成Opti-MEM的平皿中,轉染5小時后,換成正常細胞培養液,24小時后進行相應實驗。
1.4 CCK8檢測結腸癌細胞存活率
細胞生長至對數生長期后,進行細胞傳代,計數,鋪96孔板,按照每孔5000個細胞進行鋪板,鋪板后過夜等待細胞完全貼壁后進行不同分組作用。按照不同的分組作用細胞,觀察細胞狀態完成相應的作用,待作用時間完成后,每孔加入10 μl CCK8溶液,輕輕混勻,放入浮箱內繼續培養3小時后停止作用,利用酶標儀檢測吸光度值(OD值,450 nm)。
1.5 Western Blotting檢測結腸癌細胞內蛋白表達
蛋白是細胞內發揮生物學功能的大分子物質,檢測蛋白水平的改變可以反應細胞內一些現象的發生,細胞蛋白提取和表達檢測步驟如下,將對數生長期的細胞按照分組進行分皿,待細胞完全貼壁后進行相應的處理,處理完成后進行蛋白的提取,棄除細胞正常培養液,冷卻的PBS洗細胞2次后,完全吸出PBS,加入150 μl RIPA細胞裂解液,均勻鋪開后,放置冰上作用5分鐘后,利用細胞刮將細胞完全刮除后轉至EP管中,放入4℃冰箱搖勻作用30分鐘,3 000 rpm/min離心20 min,取上清后對蛋白濃度進行定量(BCA方法)。根據蛋白濃度絕對上樣體積,蛋白中加入loading buffer,95℃煮蛋白使其變性后,進行蛋白質丙烯酰胺凝膠電泳分離不同分子量的蛋白,將膠上的蛋白通過轉模轉移至PVDF膜上, 5%脫脂奶粉中封閉2小時,根據檢測蛋白的不同加入相應的一抗,低溫孵育過夜,第二天PBST清膜3次后加入相應的二抗,室溫孵育2小時后, PBST清膜3次, ECL發光顯示,對結果進行拍照分析。
1.6 流式細胞儀檢測不同分組結腸癌細胞凋亡率
利用流式細胞術檢測不同分組下結腸癌細胞的凋亡率,利用Annexin V-FITC/PI雙染色檢測凋亡率的改變。具體步驟如下,將對數生長期的細胞按照分組進行分皿,待細胞完全貼壁后進行相應的處理,藥物作用完成后,消化收集細胞,利用冷PBS清洗細胞2次后加入染料Annexin V-FITC和PI溶液,避光作用半個小時,利用流式細胞術進行熒光強度的檢測。
1.7 統計學方法
利用SPSS 16.0統計學軟件進行分析,兩組比較采用t檢驗的方法,三組及三組以上采用方差分析的方法,P<0.05定義為具有統計學意義。
2 結果
2.1 人正常結腸上皮細胞與結腸癌細胞miR-155表達水平
為明確miR-155在人正常結腸上皮細胞(NCM460)和結腸癌細胞(SW480,HCT-116,HT-29)中表達的差異,我們首先利用了RT-qPCR的方法檢測了細胞中miR-155表達水平,結果顯示,與正常結腸上皮細胞相比,不同種類的結腸癌細胞都呈現出了miR-155表達水平的升高,差異具有統計學意義,見表1。
2.2 miR-155 inhibitor對結腸癌細胞存活率的影響
在檢測到miR-155表達水平上調的基礎上,我們進一步探討抑制miR-155對結腸癌細胞生物學行為的影響,我們首先檢測了SW480細胞存活率的改變,結果發現,轉染miR-155抑制劑可以明顯的降低SW480細胞存活率,差異具有統計學意義,見表2。

表1 RT-qPCR檢測不同細胞系中miR-155表達水平
*與NCM-460相比較有統計學差異,P<0.05

表2 miR-155 inhibitor對SW480細胞存活率的影響
*與Control組比較,P<0.05
2.3 miR-155 inhibitor對結腸癌細胞凋亡的影響
在檢測miR-155 inhibitor對結腸癌細胞存活率影響的基礎上,我們進一步檢測了其對凋亡率的影響,我們首先利用流式細胞術的方法檢測了給予miR-155 inhibitor對凋亡率的影響,結果發現,與對照組相比較,miR-155 inhibitor可以明顯的增加結腸癌細胞的凋亡率,差異具有統計學意義,結果見表3。為明確細胞中凋亡的改變,我們利用Western Blotting的方法進一步檢測了結腸癌細胞中凋亡相關蛋白的表達水平,結果發現,給予miR-155 inhibitor可以明顯的增加細胞中cleaved caspase-3表達,結果見圖1。

表3 miR-155 inhibitor對SW480細胞凋亡率的影響
*與Control組比較,P<0.05
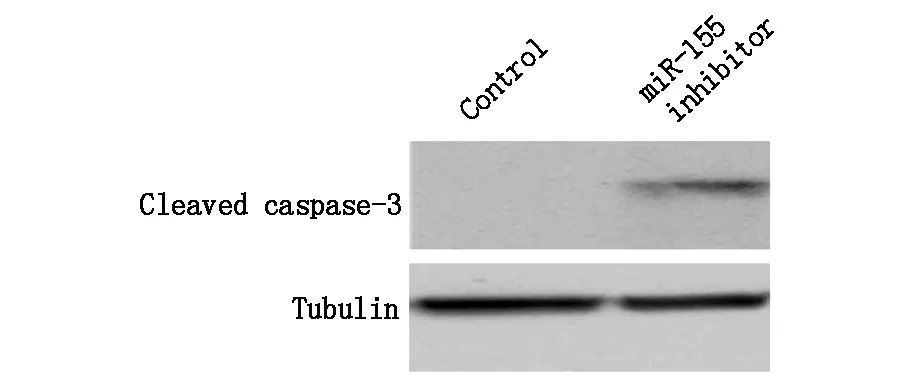
圖1 miR-155 inhibitor對SW480細胞凋亡相關蛋白表達水平的影響
2.4 miR-155 inhibitor對結腸癌細胞自噬的影響
研究顯示,自噬在mircroRNA與腫瘤之間的關系中發揮著重要的作用,因此我們進一步檢測了自噬相關蛋白的改變。Western Blotting結果發現,給予miR-155 inhibitor可以明顯的增加細胞中自噬相關蛋白LC3-II表達,結果見圖2。
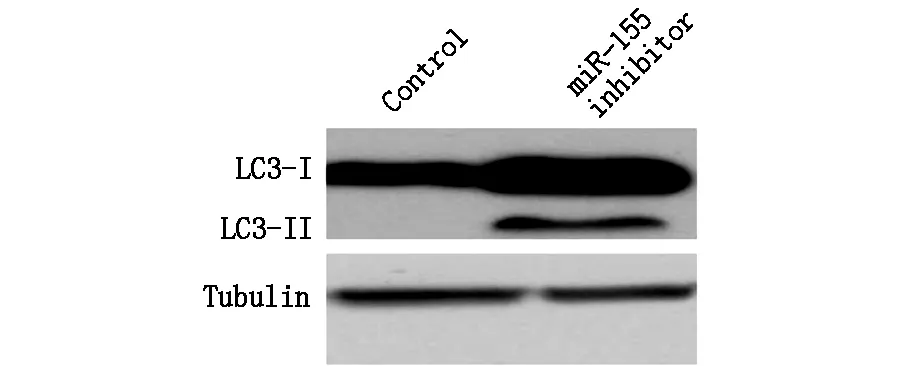
圖2 miR-155 inhibitor對SW480細胞LC3蛋白表達水平的影響
2.5 抑制自噬對miR-155 inhibitor引起的結腸癌細胞死亡的影響
為明確自噬在miR-155 inhibitor引起的結腸癌細胞死亡中的作用,我們給予細胞自噬抑制劑3-MA,結果發現,抑制自噬可以進一步增加miR-155 inhibitor引起的細胞存活率的下降,差異具有統計學意義,結果見表4。

表4 抑制自噬對miR-155 inhibitor引起的 結腸癌細胞死亡的影響
*與Control組比較,P<0.05;#與miR-155 inhibitor組,P<0.05
2.6 抑制自噬對miR-155 inhibitor引起的結腸癌細胞凋亡的影響
我們進一步檢測了抑制自噬對miR-155 inhibitor引起的結腸癌細胞凋亡的影響,Western Blotting結果發現,抑制自噬可以進一步增加miR-155 inhibitor引起的cleaved caspase-3表達的增加,結果見圖3。
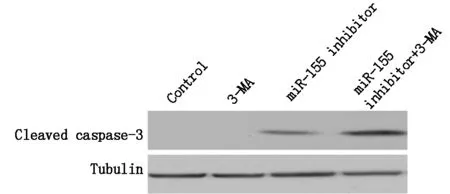
圖3 抑制自噬對miR-155 inhibitor引起的結腸癌細胞凋亡的影響
3 討論
結直腸癌是發達國家和發展中國家都非常常見的一種惡性消化系統腫瘤[9]。由于對結腸癌發病機制和分子調控認識的局限性,導致了目前治療效果的不佳[10]。因此,如何深入的了解結腸癌的發生發展的過程,明確其分子調控機制,尋找新的有效的分子治療的靶點成為結腸癌研究的熱點和難點。越來越多的證據表明小分子RNA(miRNAs)在腫瘤的發生發展中發揮了重要的作用,其通過靶向調節與腫瘤發生發展相關的基因的表達,參與腫瘤的調控[11]。研究顯示,miR-155在多種癌癥中都呈現出了高表達,其促進了多種腫瘤的發生和發展;同時,在腫瘤的診斷和預后中也發揮了重要的作用[12]。但是,miR-155與結腸癌發生發展之間的關系報道較少,其對結腸癌細胞生物學行為的調控還不是很清楚。
我們首先檢測了正常結腸上皮細胞和結腸癌細胞中miR-155表達水平,發現不同結腸癌細胞中都呈現出了明顯的miR-155表達水平的升高。我們進一步檢測了其對細胞存活和凋亡的影響,結果發現,抑制miR-155可以引起結腸癌細胞存活率的下降和凋亡率的上升。提示出,miR-155參與了結腸癌細胞生物學行為的調控。
自體吞噬是細胞內普遍的過程,通過自噬體和溶酶體的融合清除不必要的細胞內氨基酸、脂肪酸和核苷酸。多種不利的條件都可以導致自噬的發生,包括營養缺乏,缺氧,DNA損傷,或活性氧(ROS)的產生,通過自噬過程,降解不需要的細胞器以及蛋白質,脂肪酸等物質,從而維持細胞內穩態和生存[13]。自噬在腫瘤的發生發展中起著雙重作用。在腫瘤發生的早期階段,它具有很強的抑制腫瘤發生的作用。通過抑制組織損傷,炎癥和基因組不穩定來防止腫瘤的發生[14]。相比之下,一旦腫瘤在生長,自噬促進其生長、代謝,因為它能讓癌細胞克服細胞內和環境壓力[15]。
為明確miR-155對結腸癌細胞自噬的影響以及自噬在miR-155 inhibitor引起細胞毒性中的作用,我們展開了進一步研究。結果發現,miR-155 inhibitor可以促進結腸癌細胞自噬的發生,抑制自噬可以明顯的增加miR-155 inhibitor引起的細胞存活率的下降和凋亡的升高,提示自噬在miR-155 inhibitor誘導細胞毒性中起保護作用。
綜上所述,miR-155在結腸癌細胞中呈現高表達,抑制miR-155可以引起結腸癌細胞存活率的下降和凋亡的升高,聯合自噬抑制劑可以進一步增加細胞毒性。本課題為臨床治療結腸癌提供了新的靶點和聯合用藥策略。

