缺血后處理通過水通道蛋白-4對大鼠缺血再灌注損傷的腦保護作用及其機制
劉佳麗, 王 曄
腦卒中發病率高、復發率高、致死致殘率高、疾病負擔重,已躍升為我國國民死因首位。腦卒中分為缺血性腦卒中(Ischemic stroke,IS)和出血性腦卒中,其中IS患者占總發病人數的60%~80%[1]許多研究人員認為缺血性腦卒中后的腦水腫和血腦屏障(BBB)的破壞引起腦組織損傷,缺血后處理(Ischemic Postconditioning,IP)具有神經保護作用和減輕腦水腫的作用[2]。IP是指在再灌注的早期,重復予幾次短暫的非致死性的血管閉塞與再通的過程,被認為是一種缺血耐受,從而減輕腦缺血再灌注損傷和腦水腫[3]。水通道蛋(AQPs)在腦水腫的發病機制中發揮著重要作用[4]。作為水通道蛋白家族的成員,它們在腦組織中高度表達,其通常定位于星形細胞表面以及毛細血管周圍由星形膠質細胞終足包繞而成的膠質界膜。相關的動物實驗研究提示,AQP4的高表達可導致神經膠質細胞腫脹破裂,破壞血腦屏障,最終引起缺血再灌注損傷后的腦水腫,進而導致腦損傷[5],它在細胞毒性和血管源性水腫發展過程中起著重要的作用。AQP4的表達增多在神經系統疾病如神經炎癥和缺血性卒中的病理生理學中起著重要作用[6]。本研究通過建立腦缺血再灌注損傷大鼠模型,觀察其神經行為學改變、腦組織病理形態學變化及海馬區AQP4的表達,初步探討IP在大鼠局灶性腦缺血再灌注損傷中的保護作用及其機制。
1 材料和方法
1.1 材料 健康雄性SD大鼠48只,體質量250~300 g,凋亡檢測試劑盒、AQP4免疫組化試劑盒均為武漢博士得公司產品,OLYMPUS BX41顯微圖像分析系統。
1.2 方法
1.2.1 動物分組 SD大鼠48只,隨機分為3組,每組16只。假手術組:僅暴露頸總動脈及分叉處。對照組:行單純大腦中動脈缺血60 min后再灌注;缺血后處理(IP)組:于大腦中動脈線栓阻閉(middle cerebralartery occlusion,MCAO) 60 min后,拔除線栓后即刻夾閉栓塞側頸總動脈,阻斷血流30 s,恢復血流30 s,如此進行3次缺血/再灌注循環。
1.2.2 模型制作 所有實驗動物術前24 h禁食,自由飲水。水合氯醛0.35 g/kg體重,腹腔麻醉,剪去頸正中位皮毛,消毒,鋪巾,取頸正中皮膚切口,鈍性分離肌肉及皮下組織,暴露頸總動脈(CCA),分離迷走神經,切忌鉗夾,鈍性分離右側頸外動脈(ECA)和頸內動脈(ICA),結扎分支,用手術剪剪開ECA一小口將一預先用酒精燈燒成圓頭的320尼龍線置入頸內動脈14~15 mm,直到有輕微阻力感為止,對照組阻閉60 min后抽出尼龍線,恢復再灌注,24 h后處死。IP組于MCAO 60 min后,將尼龍線拔出5~8 mm,依據分組,再灌注時間30 s,再將尼龍線放入原位置,缺血時間為30 s,反復3次,恢復再灌注,24 h后處死。
1.2.3 觀測指標
1.2.3.1 神經行為學評估 麻醉蘇醒后,將動物放回鼠籠,自由飲食。腦缺血再灌注后24 h,各組隨機取8只,用雙盲法評估記錄神經功能障礙評分(NDS):0級:無功能障礙;1級:不能伸展右側前肢;2級:向右側旋轉;3級:向右側傾倒;4級:無自主活動伴有意識障礙;5級:死亡。
1.2.3.2 梗死體積率測定 所有大鼠恢復再灌注24 h后,各組隨機取4只,用10%水合氯醛(3 ml/kg)經腹腔注射深麻醉后斷頭處死,迅速取出鼠腦,置于冰鹽水中10 min,取冠狀面均勻切成2 mm厚腦片,迅速放入20 g/L的TTC溶液(37℃)中染色30 min,每隔7~8 min用眼科鑷翻轉一次,使染色充分、均勻,然后用40 g/L甲醛固定。24 h后將腦片用數碼相機拍照,輸入計算機,采用雙盲法用圖像處理軟件(ADOBE PHOTOSHOP 7.0)計算腦梗死體積(粉紅色區為正常腦組織,白色區為梗死區)百分比,即梗死灶占對側正常大腦半球的百分比。采用Swanson法的原理計算腦梗死體積百分比:腦梗死體積百分率=(正常側大腦半球體積-梗死側非梗死區腦組織體積)/正常側大腦半球體積×100%。
1.2.3.3 腦組織含水量測定 大鼠恢復再灌注24 h后,各組隨機取4只,用干濕法測腦組織含水。率迅速斷頭取腦,置于內有生理鹽水濕潤的定性濾紙的培養皿中,以防水分蒸發,同時快速去掉腦皮質表面的軟腦膜和凝血塊。用分析天秤準確稱取兩個半球的重量,然后置于100 ℃烤箱24 h,用同一天平再次稱重,以[ (濕重-干重) / 濕重] ×100 %即為相對含水量。
1.2.3.4 免疫組織化學檢測 每組剩余的8只大鼠,經10%水合氯醛腹腔麻醉,打開胸腔,先后用生理鹽水和4%多聚甲醛行心臟灌流,斷頭取腦,置于4%多聚甲醛中固定24 h。(1)脫蠟、水化組織切片、預處理組織切片;(2)蒸餾水漂洗,置于PBS中;(3)3%H2O2阻斷10 min;(4)蒸餾水漂洗,置于PBS中10 min;(5)一抗孵育過夜;(6)PBS漂洗3次/2 min;(7)IvisionTM二抗試劑Poly‐HRP羊抗鼠兔通用型;(8)PBS 漂洗3/2 min;(9)顯色,光鏡控制;(10)復染、脫水、透明、封片;(11)AQP4陽性細胞不同組別取3張切片,顯微鏡下觀察細胞漿呈棕黃色為陽性細胞,OLYMPUS BX41顯微圖像分析系統測定海馬CA1區陽性反應物的光密度值(optical density value,OD值),取平均值作為測量值。
1.2.3.5 TUNEL 染色細胞凋亡檢測 常規脫蠟,按照試劑說明書操作,DAB顯色、乙醇脫水、二甲苯透明、中性樹膠封片。顯微鏡下細胞核中出現棕黃色顆粒者為陽性細胞,即凋亡細胞。OLYMPUS BX41顯微圖像分析系統測定海馬CA1區陽性反應物的光密度值,取平均值作為測量值。
2 結 果
2.1 神經功能障礙評分比較 術后所有動物均存活。假手術組大鼠未見神經功能損害,對照組和IP組大鼠均表現出一定神經功能障礙(見圖1),部分大鼠可觀察到偏癱及霍納征。缺血再灌注24 h后,IP組NDS(1.63±0.74)與對照組(2.63±0.92)比較顯著降低,差異有統計學意義(P<0.05)(見表1)。
2.2 大鼠腦梗死體積變化 假手術組無肉眼可見的梗死灶形成,腦組織染成玫瑰紅色;缺血再灌注各組大鼠均有不同程度的梗死灶形成,腦梗死組織為白色(見圖2)。IP 減小局灶性腦缺血后的梗死體積。IP組腦梗死體積顯著低于對照組(P<0.05)。
2.3 腦組織含水量測定 我們測量了大鼠腦組織水分含量評估腦水腫。缺血再灌注后假手術組、對照組、IP組的非缺血半球側腦組織水含量在各組別中無明顯差別,患側腦組織水含量分別為(76.9±0.91)%、(84.08±2.8)%、(79.77±1.81)%。在患側組中對照組腦組織水含量明顯高于IP組(P<0.05)(見圖3),結果有統計學意義。
2.4 凋亡細胞的表達 假手術組海馬CA1區偶可見極少數陽性細胞。缺血再灌注各組大鼠海馬CA1區可見TUNEL陽性反應細胞即凋亡細胞,胞核固縮黃染,胞體縮小形狀不規則。對照組可見較多的陽性細胞,其細胞核中有大量棕黃色顆粒,細胞核周圍靠近胞膜處有數個散在深染的圓形顆粒狀結構,即凋亡小體(見圖4)。IP組較對照組陽性細胞減少,經平均光密度值測定,假手術組平均光密度值最小(0.11400±0.13832),與其它各組比較有統計學意義。對照組的OD值明顯高于IP組(P<0.05)(見表2)。
2.5 免疫組織化學結果 AQP4陽性表達主要集中在大鼠腦膜等處的膠質界膜上及毛細血管壁周圍的星形膠質細胞的胞膜上和胞漿中,呈現出黃色細顆粒,在對照組大鼠海馬區,AQP4陽性表達的黃色細顆粒明顯增多,IP組大鼠海馬區AQP4陽性表達的黃色細顆粒較對照組減少(見圖5)。圖像分析結果顯示,對照組平均光密度值明顯高于假手術組,差異具有統計學意義(P<0.01);IP組大鼠AQP4的平均光密度值低于對照組,差異具有統計學意義(P<0.05)(見表2)。

與對照組相比*P<0.05;與假手術相比#P<0.01

與假手術組相比*P<0.01;與對照組相比#P<0.05

A:假手術組; B:對照組; C:IP組

A:假手術組; B:對照組; C:IP組
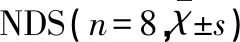
表1 各組大鼠再灌注24 h后
與假手術組相比較*P<0.01,與對照組比較#P<0.05

表2 各組大鼠海馬CA1區平均光密度值
與假手術組相比較*P<0.01,與IP組比較#P<0.05
3 討 論
本實驗采用大鼠MCAO作為有效的實驗模型誘發腦水腫和腦損傷,研究了IP對腦缺血再灌注后的腦保護作用。證實了IP可通過降低AQP4的表達減小缺血性卒中后的腦水腫,同時減輕腦損傷后的神經功能缺損。
缺血性腦卒中后患者可有不同程度的神經功能損傷。大鼠神經行為學評估提示了缺血性腦卒中后新出現的神經系統癥狀。對照組的行為學評分明顯高于IP組,可見IP可顯著改善缺血性腦卒中后的神經功能缺損。MCAO后可出現大鼠腦缺血缺氧,大量興奮性谷氨酸積累于細胞外,進一步結合谷氨酸受體后導致大量鈣離子內流,同時增強了鈣敏感酶的活性,這時大量自由基生成,損傷線粒體,最終導致細胞凋亡。海馬CA1區是中樞神經系統中的易損部位,本實驗觀察到在缺血后海馬CA1區可見明顯增加的凋亡細胞,提示細胞凋亡參與缺血后細胞死亡的機制。假手術組極少出現凋亡細胞,缺血各組海馬區CA1區均出現陽性細胞,IP組較對照組陽性細胞表達明顯減弱(P<0.05)。提示IP可通過減少細胞的凋亡,從而發揮腦保護作用。
腦水腫是腦缺血再灌注損傷的重要病理環節之一[7]。細胞毒性腦水腫常常發生在IS發生的最初24 h。而血管源性腦水腫則多見于IS的后期,由BBB結構被破壞而引起,腦水腫確切的發生機制目前尚未完全闡明[8]。本研究顯示,IP組與對照組比較明顯減少了缺血后大鼠的腦梗死體積及腦組織含水量(P<0.05),表明IP可減輕腦缺血后的腦水腫。在包括卒中,創傷性腦損傷后的腦缺血再灌注所引起的腦水腫均與AQP4的表達有密切關系[9]。AQP4屬于水特異性通道蛋白,在腦灰質、白質均有分布,主要集中在側腦室和導水管的室管膜細胞,下丘腦及海馬齒狀回,另外在軟腦膜、視上核、齒狀回的顆粒細胞層和小腦蒲肯野細胞也有明顯表達[10]。AQP4體外實驗結果發現,AQP4促進水通過BBB進入損傷的星形膠質細胞,其表達水平與細胞毒性腦水腫程度呈同向變化,二者呈正相關[11]。AQP4的過度表達是腦缺血病理過程中腦水腫的主要病理之一[12]。AQP4除了參與腦水腫的病理生理外,還有維持血腦屏障完整性、參與星形膠質細胞遷移和神經細胞信號轉導及血管再生等多種功能。許多研究已經證明MCAO誘導血腦屏障破壞,AQP4蛋白和mRNA表達均明顯上升,且在缺血中心的梗死灶周邊表達最強。之前的研究表明,腦缺血后AQP4基因敲除大鼠的細胞毒性腦水腫減輕,神經功能改善明顯[13]。本研究中腦缺血各組(IP組和對照組) 海馬CA1區AQP4表達均較假手術組明顯上升,而與對照組相比IP組AQP4的表達明顯減少(P<0.05),表明IP明顯下調MCAO后AQP4的表達,進而減少腦梗死后的腦水腫,起到腦保護作用。
綜上所述,IP可有效降低腦缺血再灌注后的腦水腫,減輕腦組織損傷和大鼠MCAO后的神經功能缺損。其機制可能與降低AQP4的表達有關。

