大鼠BMSCs與ADSCs全基因組DNA甲基化差異分析
陳旭濤 萬卓 韋夢影 楊國棟 宋應亮
骨髓間充質干細胞(BMSCs)在間充質干細胞中最早被發現,并長期應用于組織工程和干細胞研究領域中[1-2]。2001 年Zuk等[3]在脂肪組織中分離提取出了脂肪間充質干細胞(ADSCs),隨后大量研究證實了其與BMSCs有著相似的多向分化潛能[4-5]。而ADSCs相對BMSCs取材容易、創傷小、易擴增的優點也引起了各方廣泛關注,逐漸成為時下研究熱點。BMSCs與ADSCs是眾多間充質干細胞中來源最豐富的,且被廣泛應用于目前相關實驗研究與臨床運用中。但隨著對這2 種不同組織起源的間充質干細胞的深入研究,大量實驗發現,BMSCs具有更高的成骨和成軟骨傾向[6-7],而ADSCs則具有更高的成脂、成血管傾向[8-9]。后期Dmitrieva等[10]還發現,相較于BMSCs,ADSCs有著更強的增殖潛能。此外,ADSCs與BMSCs不僅在分化表型以及增殖能力上存在差異,二者之間在免疫表型上也存在著相似但不同的地方[11]。BMSCs與ADSCs均屬于間充質干細胞,在組織工程,再生與修復醫學等領域起到重要作用,但其功能及表型差異機制尚未闡明。
近年來,隨著對表觀遺傳學的研究日益深入,研究者發現表觀遺傳修飾不僅參與了細胞的生長、分化、增殖等重要細胞生物學過程,而且在生物的適應性和變異性中也起著重要的調控作用[12]。常見的表觀遺傳學修飾有DNA甲基化、組蛋白修飾、RNA干擾等,其中DNA 甲基化是目前研究最廣泛最透徹的表觀遺傳學機制之一,其通過甲基轉移酶將來源自S-腺苷甲硫氨酸的甲基轉移到胞嘧啶的第5位碳原子上,形成5-甲基胞嘧啶,隨后通過DNA的復制向下遺傳[13]。DNA甲基化能引起DNA與染色質結構的改變,影響其與蛋白質相互作用方式,進而導致基因的表達改變[12]。本研究利用 DNA 甲基化測序技術分析BMSCs與ADSCs 基因組甲基化分布差異情況,為進一步分析BMSCs與ADSCs分化和免疫表型差異提供分子依據。
1 材料與方法
1.1 主要試劑和儀器
α-MEM(Gibco,美國);胎牛血清,青鏈霉素雙抗(HyClone,美國);成骨、成脂誘導分化培養基(蘇州賽業);膠原酶I、油紅O、茜素紅S染色液(Sigma,美國);小鼠抗大鼠單克隆抗體CD29、CD90、CD34、CD45(BD Pharmingen,美國);基因組DNA提取試劑盒(北京天根);CO2培養箱(Shellab,美國);流式細胞儀(Beckman Coulter,美國);倒置相差顯微鏡(Olympus,日本);SD大鼠(8 周,SPF級),由空軍軍醫大學實驗動物中心提供。
1.2 ADSCs與BMSCs的原代培養
ADSCs提取方法:SD大鼠脫頸處死后在超凈臺中取皮下脂肪于培養皿中,將脂肪組織剪碎至糜狀后轉移至離心管中,加入等體積0.1%膠原酶Ⅰ,將離心管置于37 ℃搖床(200 r/min)中消化50 min。取等體積α-MEM終止消化后,用200目鋼篩過濾,收集過濾后的液體于離心管中離心5 min(1 000 r/min)。培養基重懸細胞沉淀并均勻鋪于培養皿中,置于37 ℃, 5% CO2孵箱中培養。
BMSCs提取方法: SD大鼠脫頸處死后于超凈臺中取大鼠股骨、脛骨于培養皿中,用注射器將骨髓沖出至骨膜發白,收集骨髓于無菌離心管中。加入2~3 ml紅細胞裂解液裂解5 min。收集裂解產物于離心管中離心5 min(1 000 r/min)。培養基重懸細胞沉淀并均勻鋪于培養皿中,置于37 ℃, 5% CO2孵箱中培養。
1.3 ADSCs與BMSCs的表面抗原檢測
利用胰酶將ADSCs與BMSCs兩組細胞分別消化后,調整細胞密度為1×106/ml。PBS離心洗滌1 次后棄上清,100 μl PBS重懸,分別加入FITC標記的IgG、CD29、CD90、CD34、CD45抗體冰上避光孵育15 min后, PBS洗滌3 次,流式細胞儀進行檢測。
1.4 ADSCs與BMSCs的成脂、成骨誘導
將第2 代ADSCs與BMSCs消化后分別制成細胞懸液,并以2×105/孔的密度接種于6孔板,待細胞擴增至80%左右時,分別加入成脂、成骨誘導液培養基進行誘導。成脂誘導14 d, 換液1 次/3 d,誘導結束后,4%多聚甲醛固定20 min,油紅O染色并拍照。成骨誘導21 d, 換液1 次/3 d,誘導結束后, 4%多聚甲醛固定20 min,行茜素紅染色并拍照。
1.5 DNA提取與樣品檢驗
胰酶消化ADSCs和BMSCs,PBS吹打洗滌2 次,10 000 r/min離心后,棄上清,加入200 μl緩沖液GA, 4 μl RnaseA震蕩混勻靜置5 min,隨后加入 20 μl Proteinase K溶液,混勻。余下具體步驟參照TIANamp Genomic DNA Kit說明書。取50 ng DNA樣品進行瓊脂糖凝膠電泳,紫外透射光下觀察,如電泳結果為規則單一條帶則為合格樣品。準備DNA樣品:總量≥3 μg,濃度≥50 ng/ul;A260/280在1.8~2.0之間、A260/230>1.4、無降解,無蛋白及RNA污染,送公司分析(成都生命基線科技有限公司)。
1.6 文庫構建及分析
①利用超聲將基因組DNA打斷為300 bp的小片段; ②用修復緩沖液進行DNA末端片段修復、A尾緩沖液進行3' 端加A堿基,連接測序接頭; ③采用ZYMO EZ DNA Methylation-Gold kit對DNA樣本進行Bisulfite處理; ④脫鹽處理后切膠回收,并選擇合適大小的文庫片段,進行PCR擴增處理后再次進行文庫片段大小選擇; ⑤選擇合格的文庫用于上機測序(華大基因科技有限公司); ⑥將測序結果與參考基因組后進行信息分析及個性化分析。
1.7 統計分析
通過卡方檢驗確定樣品間是否存在差異來進行DMR篩選,進一步采用GoMiner 數據庫行基因本體(gene ontology,GO)分析和Pathway分析。
2 結 果
2.1 ADSCs與BMSCs的細胞鑒定
將正常大鼠骨髓與脂肪來源的間充質干細胞分離培養,采用流式細胞儀檢測ADSCs與BMSCs的純度(圖1),細胞中CD29、CD90表達為陽性,CD34、CD45為陰性。然后通過成脂和成骨誘導方法來評價ADSCs與BMSCs的分化潛能(圖2),成脂誘導培養14 d后以及成骨誘導培養21 d后,對2 組不同來源的細胞進行油紅O以及茜素紅染色后發現, 2 組細胞均具有多向分化潛能。
2.2 ADSCs與BMSCs全基因組甲基化數量及水平分析
ADSCs全基因組水平中CG,CHG以及CHH甲基化位點的數量均多于BMSCs(表1);從不同區域以及功能元件C甲基化水平比較而言,ADSCs與BMSCs基因組在啟動子區均呈現低甲基化狀態,但ADSCs基因組在啟動子區以及5'UTR端CG甲基化水平高于BMSCs(圖3, 表2)。
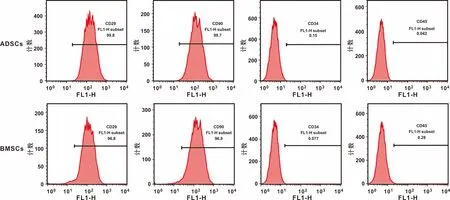
圖1 ADSCs與BMSCs的干細胞標志物流式細胞儀檢測結果(%)
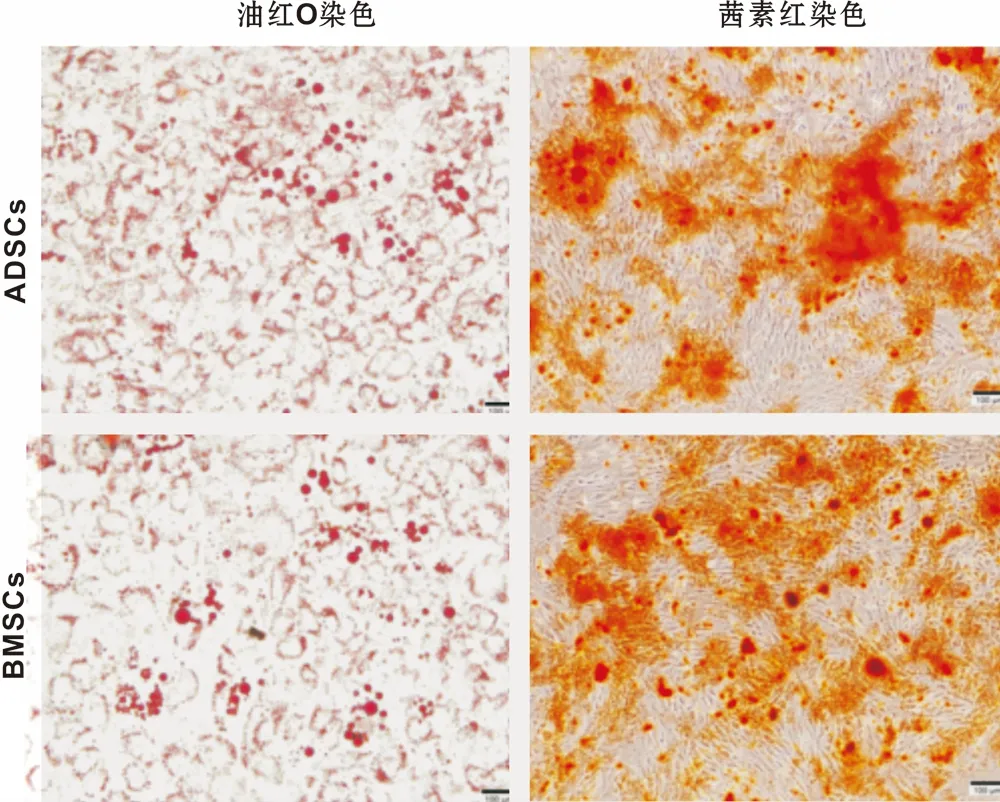
圖2 ADMSCs和BMSCs成脂成骨分化 (×100)
Fig 2 Adipogenic differentiation and osteogenic differentiation of ADSCs and BMSCs (×100)
2.3 差異性甲基化區域(DMR)分析
差異甲基化區域(differentially methylated regions,DMR)指在不同樣本中基因組表現出不同的甲基化狀態的DNA片段。其中,CG甲基化水平不同的DMR分析結果如表3所示,BMSCs與ADSCs基因組間在常染色體與性染色體基因組上存在大量DMR。
表1 ADSCs與BMSCs不同分布類型甲基化C的數量及比例
Tab 1 The number and proportion of different distribution types of methylation C of ADSCs and BMSCs
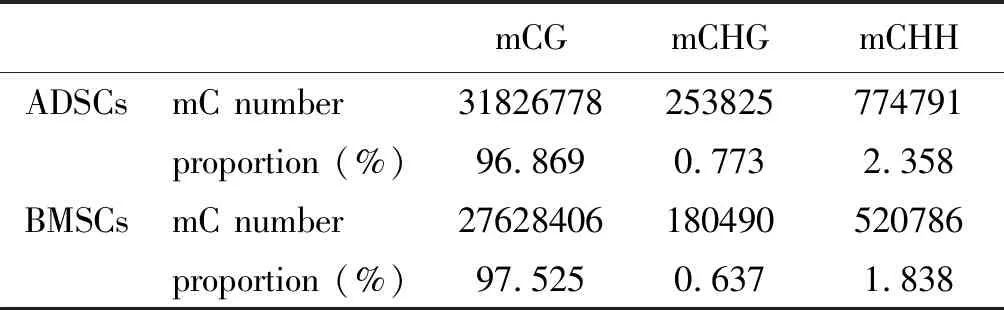
mCGmCHGmCHHADSCsmC number31826778253825774791proportion (%)96.8690.7732.358BMSCsmC number27628406180490520786proportion (%)97.5250.6371.838
2.4 DMR關聯基因分析
對所有染色體上DMR相關基因進行GO(gene ontology)和Pathway分析,共富集到4 603 條GO條目,其中610 條GO條目具有顯著差異(P<0.05)(圖4)。通過Pathway分析可以得到322 條通路,其中有98條通路顯著富集(P<0.05)(圖5, 表4)。其中,癌癥相關通路,MAPK信號通路,Ras信號通路及相關基因等在BMSCs與ADSCs基因組中甲基化水平差異顯著。
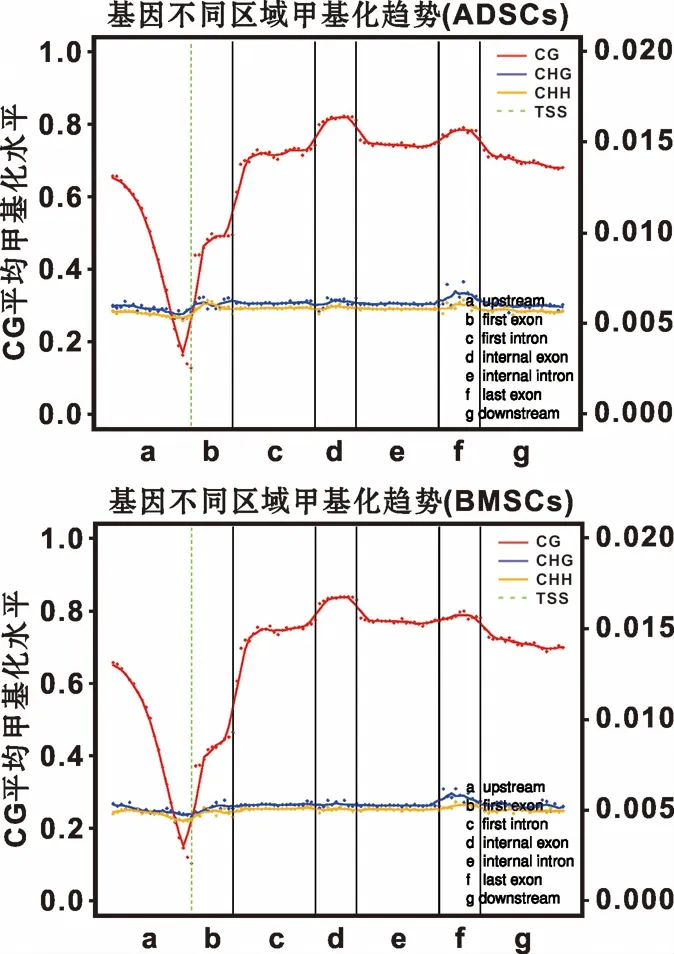
圖3 ADSCs與BMSCs全基因組不同功能元件區域的甲基化平均水平分布
Fig 3 The distribution of methylation level in different functional elements in ADSCs and BMSCs genome
3 討 論
DNA甲基化可以發生在啟動子、增強子、轉座子、沉默子等不同基因區域和功能元件上。本實驗通過對大鼠BMSCs與ADSCs的全基因組進行測序,發現BMSCs與ADSCs在全基因組甲基化上存在差異且這種差異分布于各條染色體中,同時ADSCs全基因組甲基化位點數量顯著高于BMSCs。進一步對CG甲基化水平不同的DMR進行分析,發現BMSCs與ADSCs基因組間在常染色體與性染色體基因組上存在大量CG甲基化水平不同的DMR,而這些DMR可能是導致BMSCs和ADSCs功能與表型差異的重要因素之一。有趣的是,本研究觀察到在2 種細胞中基因啟動子區雖均呈低甲基化狀態,但ADSCs啟動子區甲基化水平高于甲基化,這可能是探究BMSCs與ADSCs功能差異的重要靶點之一。本研究一共檢測到10 萬多個甲基化差異位點,其中通過GO分析和Pathway分析,富集到4 000多個GO條目和300 多個通路,這些通路和基因對本研究BMSCs與ADSCs的差異具有重要的指導意義。
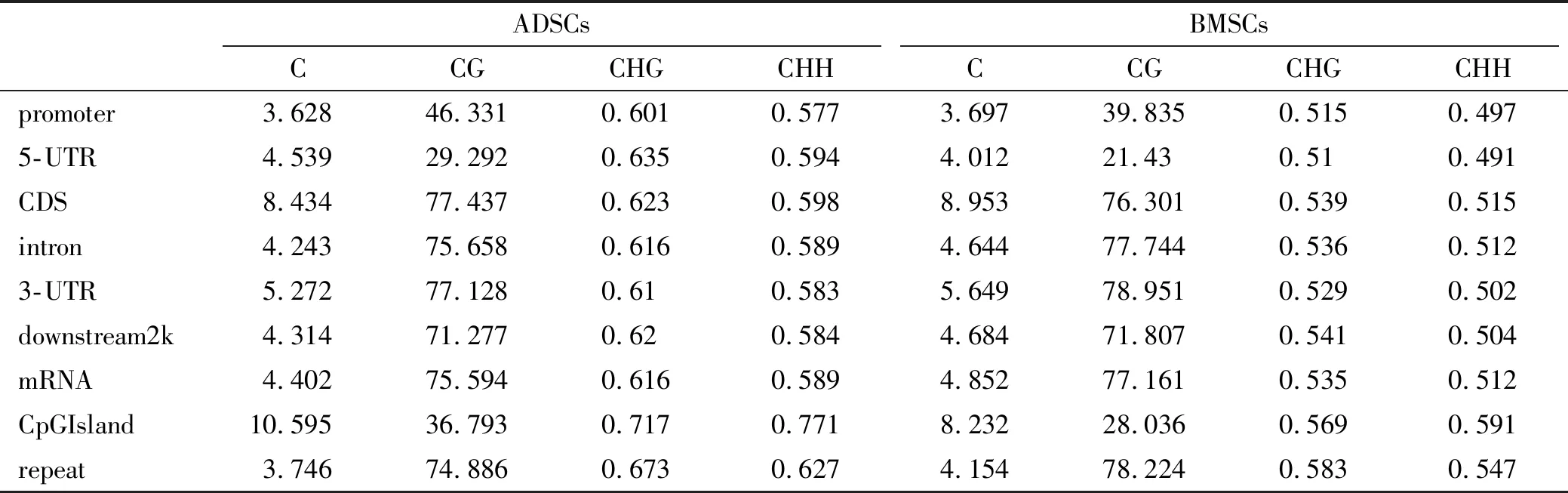
表2 ADSCs與BMSCs不同基因區域和功能元件上各類型C的甲基化水平
表觀遺傳學在胚胎發育、基因表達、細胞生長及機體免疫調節等重要生命過程中均發揮重要作用。盡管MSCs在同種異體應用(或使用HLA匹配的供體細胞)中具有很好臨床前景,但是在一些治療中仍然需要自體移植方法,例如長期植入MSCs衍生的工程化組織,這使得無法獲得足夠數量的所需細胞類型成為MSCs治療的重大挑戰。下一步通過功能及表觀編輯,闡明決定功能差異的關鍵甲基化基因,可以在此基礎上通過改變這些差異基因的甲基化狀態來改造這2 種細胞,使其更易向我們需要的方向分化發展,這對組織工程及再生醫學有著非常重要的意義。此外,越來越多的證據表明,表觀遺傳標記之間存在著相互作用,如DNA甲基化和組蛋白乙酰化之間協同參與了基因轉錄和異常基因沉默的過程[14-18]。一些研究表明,在基因沉默過程中,DNA甲基化的水平和模式指導組蛋白修飾,但另一些研究則認為,DNA甲基化的狀況受到組蛋白修飾狀態的影響。到目前為止,人們對基因激活的各種機制已經有了較為深入的了解,但在研究基因沉默時,表觀遺傳標記之間的相互作用機制以及級聯順序方面仍存在著許多的未知。即使還需要更多關于以上問題的探索,但不同類型的表觀遺傳標記之間的密切相關性是一定的,且常常以自我強化的方式在調節不同的生命活動中發揮著重要作用。因此,通過BMSCs和ADSCs全基因組DNA甲基化的差異分析,提示我們BMSCs和ADSCs在其它表觀遺傳標記上可能同樣存在差異,并與DNA甲基化協同發揮作用影響BMSCs和ADSCs在分化和免疫表型上的差異。
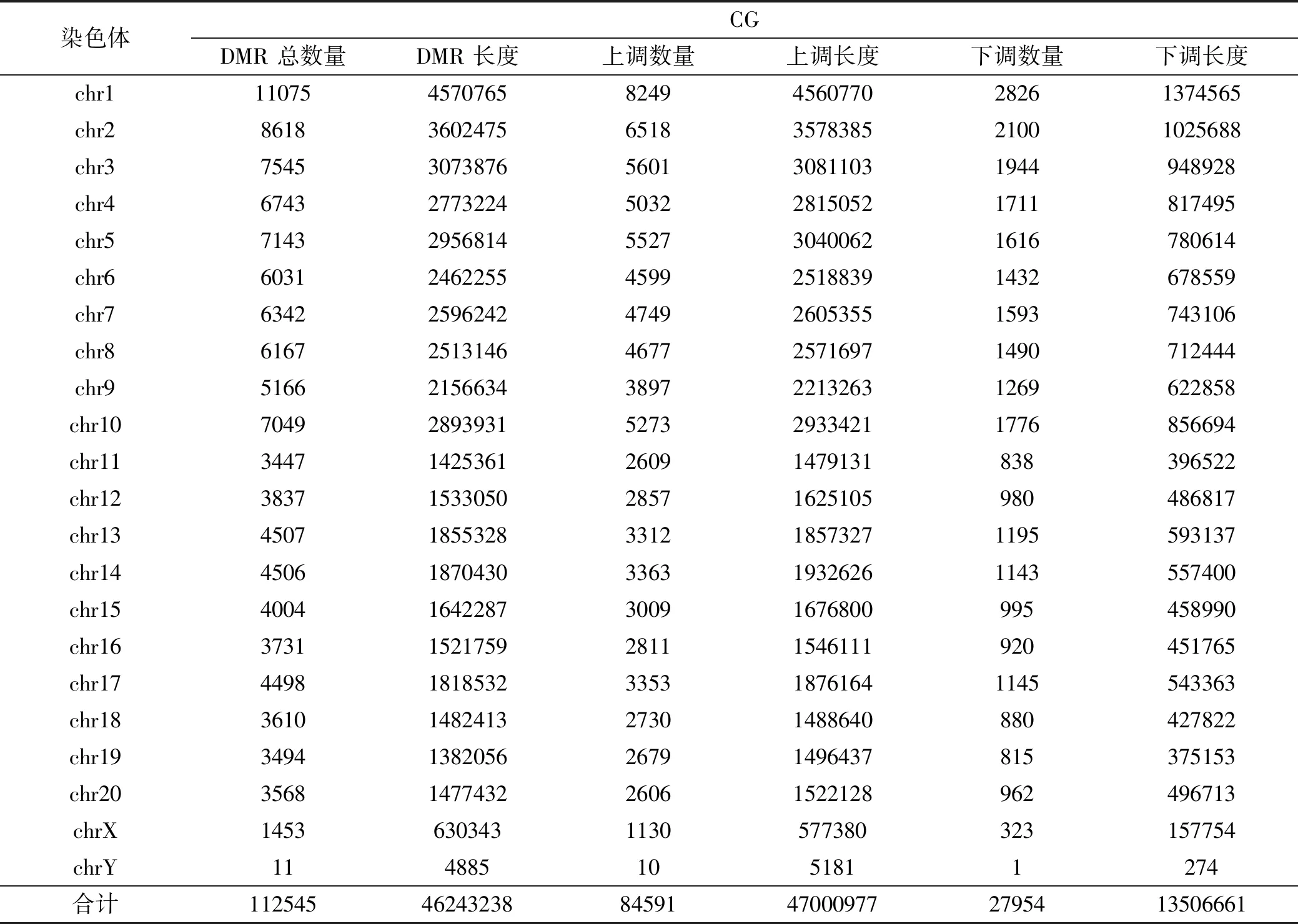
表3 ADSCs與BMSCs基因組DMR數目及長度統計
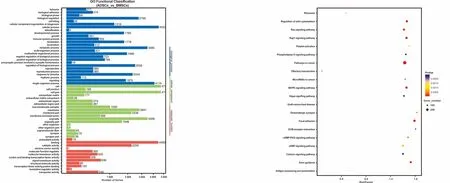
圖4 ADSCs與BMSCs的DMR GO分析結果 圖5 ADSCs與BMSCs的DMR相關基因的Pathway功能顯著性富集分析(前20)
Fig 4 The results of DMR GO analysis of ADSCs and BMSCs Fig 5 The functional enrichment analysis of the pathway of DMR-related genes of ADSCs and BMSCs (top 20)
表4 DMR相關Pathway中的差異基因數目(前10)
Tab 4 The number of differential genes in DMR-related pathways(top10)
本研究中發現的基因甲基化位點、甲基化水平與相應基因的表達情況仍需進一步驗證。深入探討它們之間的關系,及其與細胞功能表型差異的關系有望為表觀編輯ADSCs和BMSCs,增強其定向分化的潛能提供新的思路。

