核桃楸葉降血糖和抗氧化有效部位的篩選及其成分分析△
王會,劉匯,張楠茜,張輝*,高文義*,孫佳明
1.長春中醫藥大學,吉林 長春 130117;2.吉林省延邊朝鮮族自治州食品藥品檢驗所,吉林 延吉 133000
核桃楸葉是胡桃科胡桃屬植物核桃楸JuglansMandshuricaMaxim.的樹葉。原植物核桃楸,又名胡桃楸[1],落葉喬木,生長在中國東北、華北、河北等地區[2-3],其青果皮、莖、葉和樹皮均可入藥[4]。糖尿病是近年來發病率迅速增加并嚴重危害人類健康的疾病之一,糖尿病分為1型糖尿病和2型糖尿病,后者是最常見的,占糖尿病患者的90%以上[5-6]。α-葡萄糖苷酶抑制劑對餐后高血糖和高胰島素血癥有良好的防治效果,用于治療由碳水化合物代謝紊亂而引起的疾病;α-淀粉酶抑制劑對唾液淀粉酶和胰液淀粉酶活性具有良好的抑制作用,阻礙食物中碳水化合物的代謝,降低體內的血糖和血脂水平,防止餐后高血糖[7-8]。
近年來對核桃楸其他部位的研究報道較多,但是對核桃楸葉的研究報道較少。本文建立了α-葡萄糖苷酶、α-淀粉酶體外抑制和DPPH自由基清除模型[9-10],用于研究核桃楸葉乙醇提取物不同極性萃取部位對α-葡萄糖苷酶、α-淀粉酶的抑制作用和DPPH自由基清除活性,并采用紫外分光光度法測定總黃酮含量,篩選核桃楸葉降血糖和抗氧化有效部位,超高效液相色譜法(UPLC)分析確定其活性成分,為研究其藥理作用奠定基礎,對核桃楸葉的開發和應用具有指導意義[11]。
1 材料
1.1 藥材
核桃楸葉藥材采于吉林省通化市,由長春中醫藥大學張輝教授鑒定為核桃楸JuglansmandshuricaMaxim.的干燥葉。
1.2 試劑與儀器
α-葡萄糖苷酶、α-淀粉酶、維生素E、阿卡波糖(Sigma,美國),對硝基苯酚-α-D-葡萄糖苷(PNPG,Sigma,美國);1,1-二苯基-2-三硝基苯肼(DPPH,Sigma,美國);維生素C(Sigma,美國);對照品蘆丁(純度≥98%)、金絲桃苷(純度93.3%)、異槲皮素(純度≥98%)和紫云英苷(純度>99%),均購自中國食品藥品檢定研究院;其余試劑均為分析純。Agilent 1260 Infinity(美國安捷倫公司);BP211D型十萬分之一電子天平(賽多利斯儀器有限公司);酶標儀(Bio-Rad);KQ3200B型超聲波清洗器(昆山市超聲儀器有限公司);紫外-可見分光光度計(Varian公司);DSHZ-300A型旋轉式恒溫振蕩器(太倉市實驗設備廠);96孔板;各種型號移液槍及槍頭等。
2 方法與結果
2.1 核桃楸葉各部位的提取與分離
稱取適量的核桃楸葉,置于圓底燒瓶中,先用90%的乙醇水溶液回流提取1次,再用70%的乙醇水溶液回流提取2次,料液比均為1∶10,每次1 h,濾過,合并提取液。回收乙醇,減壓濃縮。取500 mL核桃楸葉乙醇提取液,揮至無醇味,剩余350 mL,取100 mL留為總提(A),剩余的250 mL依次用二氯甲烷、乙酸乙酯、水飽和正丁醇萃取,獲得不同溶劑萃取部位,依次標記為B、C、D,萃取后溶液作為水層(E),萃取方法為等體積萃取3次。收集各層萃取液,減壓濃縮、干燥至干膏,作為供試藥物[12]。
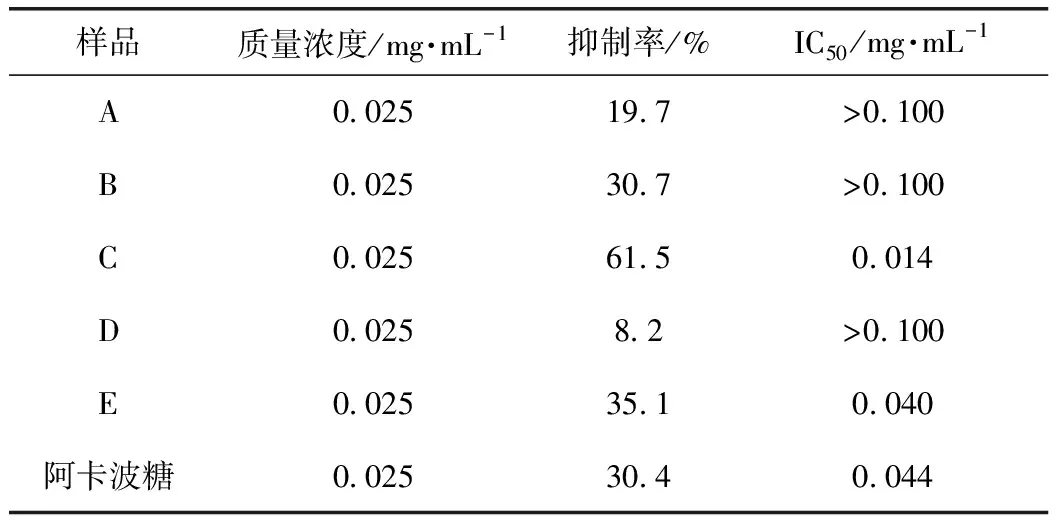
2.2 測定核桃楸葉不同萃取部位(A~E)對α-葡萄糖苷酶抑制活性
根據已有方法改進[13-14],檢測在96孔板上進行,先加入20 μL不同濃度樣品,再加入40 μL 0.5 U·mL-1的α-葡萄糖苷酶,37 ℃恒溫振蕩孵育5 min;加入20 μL 3 mmol·L-1的底物PNPG,37 ℃恒溫振蕩孵育15 min,最后加入100 μL 0.1 mol·L-1Na2CO3,立即測定405 nm處的吸光度(A)值[15]。每個濃度樣品同時進行3個平行測定并取平均值。實驗均設定空白對照、背景對照、陰性對照,按公式(1)計算抑制率,并計算相應的IC50值,A~E的α-葡萄糖苷酶抑制活性如表1所示。

(1)
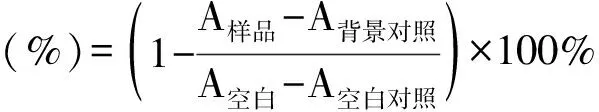
2.3 測定A~E對α-淀粉酶抑制活性
應用3,5-二硝基水楊酸(DNS)比色法測定α-淀粉酶活性[17],反應體系為0.2 mL的α-淀粉酶溶液,在37 ℃下預熱5 min后,加入0.4 mL淀粉溶液和0.2 mL檸檬酸-檸檬酸鈉緩沖液在37 ℃下反應30 min。反應完成后加入2 mL DNS,在沸水中反應10 min,取出,冷卻,取0.5 mL反應溶液置于5 mL容量瓶中,用蒸餾水定容至刻度,用紫外可見分光光度計測定540 nm處的A值,實驗均設有樣品、背景對照、空白和空白對照。按公式(2)計算抑制率,并計算相應的IC50值。反應體系見表2,抑制率結果見表3。
(2)

表2 A~E對α-淀粉酶活性反應體系
注:—表示用同體積蒸餾水代替。
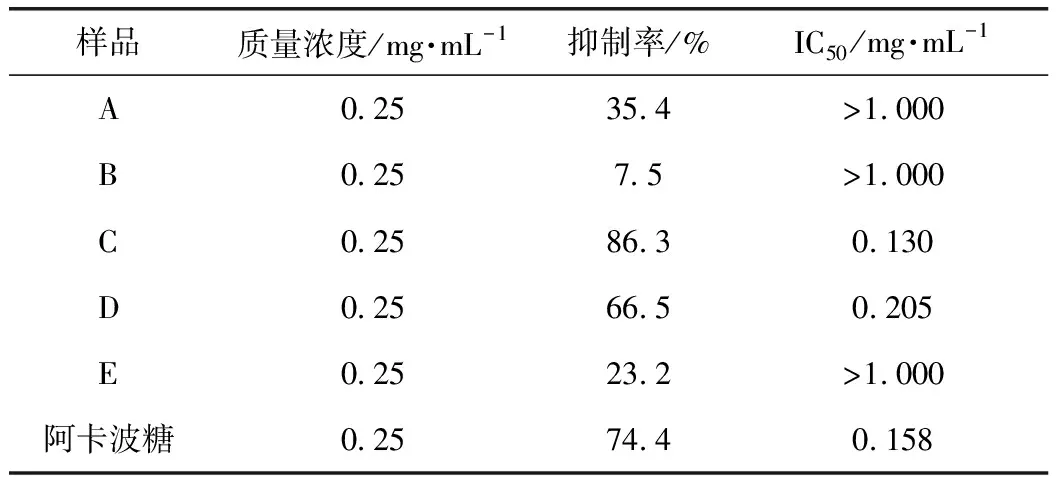
表3 A~E對α-淀粉酶抑制活性
2.4 測定A~E對DPPH自由基清除活性
采用DPPH法[17-18]對分離得到的核桃楸葉乙醇提取物進行體外抗氧化活性評價。精密量取2 mL質量濃度為26.4 mg·L-1的DPPH甲醇溶液,再分別加入2 mL不同濃度的用甲醇溶液制備的樣品液,混合均勻,避光條件下反應30 min,測定其在517 nm處的A值[15,19]。同時,用2 mL甲醇溶液代替樣品溶液作為空白對照,將2 mL樣品溶液與2 mL甲醇溶液混合作為樣品對照,將維生素E作為陽性對照,按公式(3)計算樣品液對DPPH溶液清除率。

(3)
式中:Ai為與待測溶液混合后的DPPH溶液的吸光度;Aj為與待測溶液混后的溶劑的吸光度;A0為溶劑和DPPH溶液混后的吸光度。
A~E的DPPH清除率如表4所示,結果可知,C的清除率遠高于其他4個部位,因此,C對DPPH自由基清除活性最好,表明C是核桃楸葉抗氧化的有效部位。
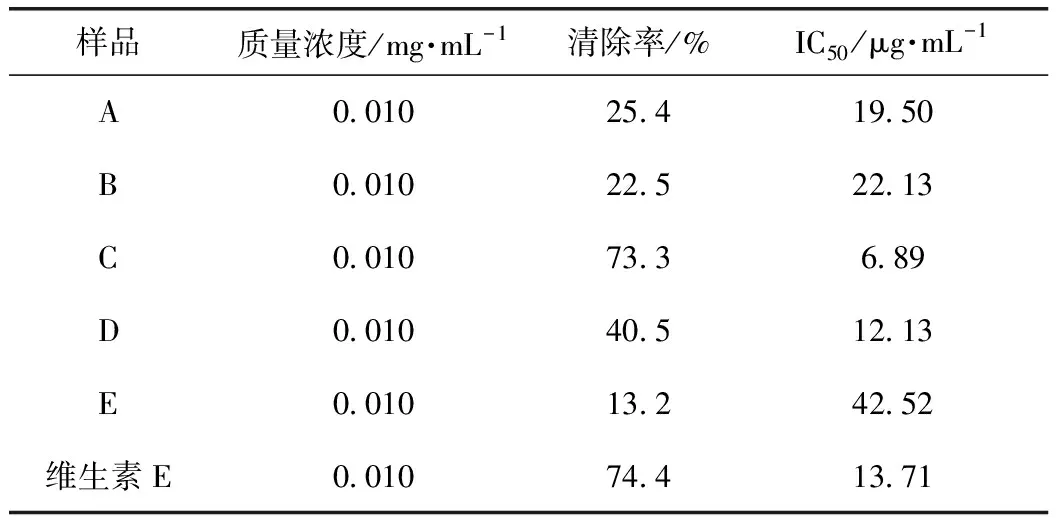
表4 A~E的DPPH自由基清除活性
2.5 A~E的總黃酮含量測定
運用紫外分光光度法[20],精密稱取11.5 mg(于105 ℃干燥至恒重的)蘆丁對照品,置于50 mL容量瓶中,先加入適量60%乙醇水溶液超聲溶解,再用適量的60%乙醇水溶液稀釋定容,制得蘆丁對照品溶液(0.20 mg·mL-1)。精密吸取上述蘆丁對照品溶液0、1.0、2.0、3.0、4.0、5.0 mL,置于25 mL容量瓶中,加入0.4 mL 5% NaNO2溶液,混合均勻,靜置6 min,加入0.4 mL 10% Al(NO3)3溶液,混合均勻,靜置6 min,加入4.0 mL 4% NaOH溶液,最后用50%乙醇水溶液稀釋至刻度,混合均勻,靜置15 min[21]。將50%乙醇水溶液作為空白對照,運用紫外分光光度法,測定512 nm處不同質量濃度蘆丁對照品溶液的A值。以A值為縱坐標(Y),以蘆丁對照品溶液的質量濃度為橫坐標(X)進行線性回歸,制備標準曲線,得回歸方程為Y=0.654 3X-0.061 1(r=0.999 5,n=3),結果表明,蘆丁質量濃度在0.23~1.15 mg·mL-1呈良好的線性關系。
吸取適量的A~E樣品液置于不同的容量瓶中,依上述方法,測定其512 nm處的A值,將不加供試品的樣品作為空白。結合標準曲線計算供試品中總黃酮的含量,結果如表5所示。
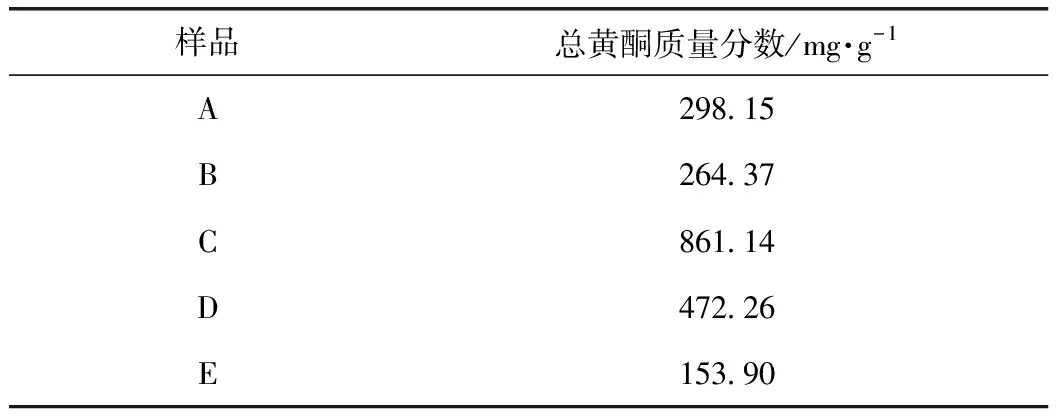
表5 A~E的總黃酮含量測定結果
2.6 UPLC分析
分析條件:Agilent SB-C18色譜柱(4.6 mm×100 mm,1.8 μm),流動相為乙腈(A)-0.1%甲酸水溶液(B),梯度洗脫(0~10 min:5%~20% A;10~40 min:20%~23% A;40~45 min:23%~25% A;45~70 min:25%~25% A;70~75 min:25%~100%A;75~95 min:100%~100% A)。流速為300 μL·min-1,檢測波長為254 nm,柱溫為25 ℃,溶液均為1 mg·mL-1。混合標準品進樣體積為5 μL,乙酸乙酯樣品進樣體積為13 μL。色譜圖顯示有3個黃酮類成分的標準品與樣品對應峰的保留時間一致,表明樣品中存在金絲桃苷、異槲皮素和紫云英苷(見圖1)。
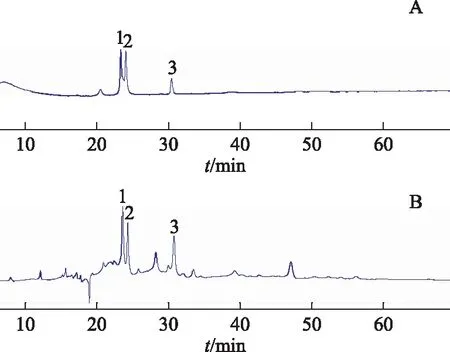
注:A.對照品;B.核桃楸葉乙酸乙酯樣品;1.金絲桃苷;2.異槲皮素;3.紫云英苷。圖1 核桃楸葉及對照品HPLC圖
3 討論
核桃楸葉乙醇提取物對α-葡萄糖苷酶和α-淀粉酶有一定的抑制作用,對DPPH具有清除作用,但沒有具體深入的研究報道。因此,通過建立α-葡萄糖苷酶和α-淀粉酶的體外抑制模型,測定DPPH自由基清除活性和總黃酮含量,進行UPLC分析,篩選核桃楸葉的降血糖和抗氧化的有效部位及活性物質。對核桃楸葉各部位進行α-葡萄糖苷酶和α-淀粉酶的體外抑制活性以及DPPH清除活性的實驗,結果表明核桃楸葉乙醇提取物的乙酸乙酯萃取部位在體外對α-葡萄糖苷酶和α-淀粉酶有明顯的抑制作用,其IC50分別為0.014、0.13 mg·mL-1,而陽性藥阿卡波糖的IC50分別為0.044、0.158 mg·mL-1,其對α-葡萄糖苷酶和α-淀粉酶的抑制作用均強于陽性藥阿卡波糖;其乙酸乙酯萃取部位比其他萃取部位具有更明顯的DPPH自由基清除能力,其IC50為6.89 mg·mL-1,應該是核桃楸葉的降血糖和抗氧化有效部位;乙酸乙酯活性部位中總黃酮質量分數為86.11%,是該部位的主要成分,其有效成分是金絲桃苷、異槲皮素和紫云英苷。通過本實驗,可以初步確定該活性部位中主要活性物質為黃酮類化合物,且主要活性成分是金絲桃苷、異槲皮素和紫云英苷。該研究為進一步研究核桃楸葉的藥理作用打下堅實基礎,也為深入研究核桃楸葉的應用價值提供理論支持。

