利塞膦酸鈉口服治療Graves病繼發骨質疏松28例
胡映玉,顏曉東,玉顏慶,林華
(廣西壯族自治區人民醫院,南寧 530021)
近年,Graves病(GD)發病率逐年升高。甲狀腺激素(TH)是骨骼生長和發育的重要因素,是成年人骨骼維持的重要調節因子。甲狀腺功能亢進可導致骨轉換加快,骨重塑率增加,骨吸收和形成率增加。因此,甲狀腺功能亢進是公認的高轉換型繼發骨質疏松的原因之一[1]。骨吸收和骨形成之間的不平衡造成骨重塑時間縮短,導致每個重塑周期凈損失大約10%的骨量[2],進一步導致脆性骨折發生風險增加。控制甲狀腺功能亢進的患者骨密度(BMD)降低有所改善[3]。但研究[4]表明,盡管有效治療甲狀腺功能亢進,但GD患者骨量減少情況仍未得到完全改善。一項隊列研究[5]結果表明,即使甲狀腺功能正常許多年之后,GD患者骨折的風險仍然高于健康人群,可能是患者骨量恢復不夠完全,且骨質量差。對GD患者進行何種治療干預來降低未來骨折的風險是目前的研究熱點。總 I 型前膠原N末端肽(PINP)、血清β-膠原C末端肽(β-CTX)、堿性磷酸酶(ALP)是臨床常用的血清骨代謝標志物。利塞膦酸鈉(Risedronate, RIS)是具有環狀側鏈的第三代抗骨質疏松藥物,可通過降低骨轉換,增加機體骨量,保護骨小梁結構,可降低椎體、非椎體和髖部骨折的風險,是治療骨質疏松的一線藥物。目前國內評估RIS在GD繼發骨質疏松/骨量減少患者中療效的相關臨床研究較少。我們采用RIS治療了28例GD繼發骨質疏松患者,取得較好效果。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2014年12月~2017年5月間在廣西壯族自治區人民醫院就診收治的53例甲狀腺功能亢進未控制的GD繼發骨質疏松患者,其中男16例、女37例,年齡(27.11±6.25)歲;病程4.12(3.94)A均符合GD的診斷標準,血清TH水平升高、甲狀腺彩超提示甲狀腺彌漫性腫大,伴或不伴血清甲狀腺刺激素受體抗體(TRAb)水平增加;至少在腰椎(LS)、股骨頸(FN)、橈骨遠端(DR)等一個部位BMD降低(Z 評分≤-2 SD)。排除標準:存在骨折和/或肝臟疾病、腎功能不全、惡性腫瘤、糖尿病、甲狀旁腺功能亢進癥、皮質激素過多或性腺功能減退癥等其他疾病史者;服用活性維生素D3、雙膦酸鹽、降鈣素、睪酮、類固醇、甲狀腺激素、利尿劑、肝素或抗驚厥藥藥物的患者;其他存在可能影響骨骼代謝的患者。53例患者隨機分成A組28例、B組25例。A組男9例、女19例,年齡(27.43±6.87)歲,GD病程4.45(3.43)A,B組男7例、女18例,年齡(26.76±5.59)歲,GD病程3.5(4.05)A,兩組年齡、性別比例、病程等具有可比性。本研究經廣西壯族自治區人民醫院倫理委員會批準同意,納入者知情同意參加本研究并簽署知情同意書。
1.2 RIS口服治療方法 兩組均采用抗甲狀腺藥物甲巰咪唑(MMI)和口服鈣劑600 mg/d基礎治療。MMI的初始劑量為30 mg/d,根據每位患者的生化血清TH水平隨時調整MMI。A組在基礎治療的基礎上加服RIS,35 mg /周。兩組均治療12個月。
1.3 兩組BMD、血清甲狀腺生化指標及骨代謝標志物檢測
1.3.1 LS、FN及DR處BMD 分別于治療前、治療6個月、治療12個月時,采用雙能X線吸收測量儀(DXA,美國好樂杰Discovery A)檢測兩組LS、FN和DR處BMD。為了消除技術上的差異,由同一個操作員進行所有的測量。LS的BMD值表示為腰1~腰4(L1~L4)椎體處的平均值。
1.3.2 血清甲狀腺生化指標 分別于治療前、治療6個月、治療12個月時,采集兩組禁食8 h小時的空腹外周血,收集血清,采用美國貝克曼UniCel DXI800微粒子酶促化學發光法測定兩組血清甲狀腺生化指標,包括游離三碘甲狀腺原氨酸(FT3)、游離甲狀腺素(FT4)、促甲狀腺激素(TSH)、甲狀旁腺激素(PTH)。
1.3.3 血清骨代謝標志物檢測 采用羅氏Cobase601電化學發光儀檢測兩組血清PINP、β-CTX,藥盒由羅氏公司提供。血清ALP采用美國貝克曼AU5800速率法測定,藥盒均由美國貝克曼公司提供,所有操作均嚴格按照使用說明書進行。
1.3.4 不良反應 觀察治療過程中兩組不良反應發生情況。
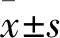
2 結果
2.1 治療前后兩組LS、FN、DR處BMD比較 治療前、治療6個月、治療12個月時兩組LS、FN、DR處BMD比較見表1。

表1 治療前、治療6個月、治療12個月時兩組LS、FN、DR處BMD比較
注:與治療前比較,*P<0.05;與B組比較,ΔP<0.05。
2.2 治療前后兩組血清 FT3、FT4、TSH、PTH水平比較 治療前、治療6個月、治療12個月時兩組血清 FT3、FT4、PTH水平比較見表2。 治療前、治療6個月、治療12個月時A組血清 TSH水平分別為<0.01、0.23(0.41)、 2.59(1.01)μIU/mL,B組分別為<0.01、0.43(1.12)、2.05(1.69)μIU/mL,與治療前比較,治療6、12個月時AB組血清 TSH水平均升高,且A組升高更明顯(P<0.05)。

表2 治療前、治療6個月、治療12個月時兩組血清FT3、FT4、TSH、PTH水平比較
注:與治療前比較,*P<0.05;與B組比較,ΔP<0.05。
2.3 治療前后兩組血清ALP、PINP、β-CTX水平比較 治療前、治療6個月、治療12個月時兩組血清ALP、PINP、β-CTX水平比較見表3。

表3 治療前、治療6個月、治療12個月時兩組血清 PINP、β-CTX、ALP水平比較
注:與治療前比較,*P<0.05;與B組比較,ΔP<0.05。
2.4 不良反應 治療中A組1例出現上腹不適,癥狀較輕,未停藥。B組1例患者出現甲巰咪唑相關性蕁麻疹,癥狀較輕,服用抗組胺藥物后皮疹消失。
3 討論
Graves病的發病機制與自身免疫異常有關,免疫炎性過程可能影響了骨細胞的代謝,其免疫異常反應可表現為甲亢時長骨骨膜反應,出現杵狀指。 Mira等[6]研究發現甲狀腺受體抗體(TRAb)可以防止絕經前和絕經后Graves病和Graves眼病婦女的骨量流失。而進一步研究[7]發現可能是TRAb中的甲狀腺阻斷型抗體(TBAb)阻止了GD患者高的骨轉換率,防止了骨流失,提示TRAb在高滴度下可能對骨骼有保護作用,但尚需要進一步的證實。
研究[4]發現,甲狀腺亢進患者血清PINP、β-CTX水平明顯升高,腰椎、股骨頸和橈骨遠端 BMD較健康對照組均減少, 尤其橈骨遠端的BMD減少最明顯。抗甲狀腺治療后的第一年,患者BMD的下降部分改善但不能完全逆轉[4]。但其他研究顯示經過幾年的持續甲狀腺功能正常后,骨量減少可以完全恢復[8]。然而,流行病學研究表明,過去有甲狀腺功能亢進病史的患者骨折風險仍然較高[5]。Esteban等[9]認為,這可能是在早年患甲亢時出現了骨結構和骨質量的缺陷,使患者在晚年患骨折的風險增加。這些觀察結果表明,即使使用抗甲狀腺治療恢復BMD,也不能充分以防止骨折風險的增加。因此,對于GD繼發骨質疏松/骨量減少的患者,需要一些能夠更好的恢復骨量和骨質量的治療干預措施。
雙膦酸鹽是目前治療骨質疏松癥的最有效的抗骨吸收劑,它可能是治療甲亢繼發骨質疏松的主要候選藥物之一。RIS可降低骨質疏松患者的骨吸收率,增加骨密度,降低骨折風險[10]。測定甲亢患者的骨形成和骨吸收標志物的水平可以了解藥物治療對骨代謝的影響。本研究顯示,使用抗甲狀腺藥物1年,兩組GD患者的PINP、β-CTX、ALP、PTH均明顯降低,但RIS組的患者PINP、β-CTX、ALP、PTH等指標較對照組下降更為顯著。雖然兩組GD患者治療6個月和12個月均增加了LS、FN和DR的骨密度,但RIS組在A治療1年后LS、FN和DR的BMD增加率分別為2.66%、3.33%和2.06%,明顯高于B組,提示在GD繼發骨質疏松/骨量減少患者中使用利塞膦酸鈉更有利于改善骨轉換,增加骨密度。馮暢等[11]觀察到使用阿侖膦酸鈉治療甲亢性骨質疏松的患者1年后,阿侖膦酸鈉組骨痛改善率為87.1%,腰椎和全髖的BMD顯著增加。Bahn等[12]研究顯示利塞膦酸鈉可顯著改善甲亢性骨松患者的腰椎、股骨頸、橈骨遠端的骨密度,較單用甲巰咪唑組有顯著增加,觀察結果與我們的一致。Esteban等[9]評估另一種抗吸收療法對甲狀腺功能亢進患者中LS、FN和Ward′s三角骨密度的影響。基礎治療組和兩個使用不同劑量的降鈣素(CT)(800 IU /月和1 400 IU /月)治療組,BMD均增加,但是在三組中BMD的改善沒有顯著差異。這些表明了雙膦酸鹽在改善甲狀腺功能亢進癥中BMD的降低方面可能優于CT。
一直以來,對于甲亢繼發骨質疏松的治療在不斷探討中。除了研究骨吸收抑制劑外,一些研究還探討了不同作用機制的藥物和方法對甲亢患者骨代謝的影響。Chaoxu等[13]的動物實驗發現電磁場可顯著抑制甲亢大鼠的骨丟失和微結構劣化,這可能是由于電磁場暴露了降低骨組織中甲狀腺激素受體(THR)的表達有關。董坤倫[14]研究探討具有促進成骨及抑制破骨雙向來調節機制的維生素K2對甲亢性骨質疏松的影響,結果表明使用維生素K2治療1年后成骨活性明顯增加,腰椎及髖部骨密度及IL-2明顯增加,且PINP、骨鈣素(BGP)、胰島素樣生長因子-1(IGF-1)及IL-6水平明顯降低,顯示維生素K2對甲亢繼發骨質疏松的患者有治療效果。Elena 等[15]發現甲亢雄性小鼠的脊柱骨小梁的體積較正常雄性小鼠降低42%。分別給予甲亢雄性小鼠使用骨硬化素抗體(Scl-Ab)增加骨形成或用唑來膦酸鈉抑制骨吸收,結果顯示甲亢雄性小鼠脊柱骨小梁體積分別增加3倍(Scl-Ab組)和2倍(唑來膦酸鈉組);甲亢雄性小鼠脊柱骨小梁硬度較正常雄性小鼠降低63%,使用Scl-Ab后脊柱骨小梁硬度可增加4倍,而唑來膦酸鈉組可增加3倍。以上的這些研究提示對于甲亢導致的骨流失還可通過作用于骨形成和骨吸收不同機制的藥物和方法來改善。
雙膦酸鹽可降低骨質疏松患者椎體、非椎體和髖部骨折的風險。雙膦酸鹽除通過增加骨量來降低骨折風險外,還可通過減少皮質孔隙度降低發生骨折的風險[16],提示雙膦酸鹽對改善骨密度和骨質量均有益,這可能對GD患者骨折風險的降低存在潛在益處。RIS的不良反應有輕微發熱、上腹不適和腹瀉,Katharin等[17]報道一例GD合并高鈣血癥的女性患者靜脈使用帕米膦酸鈉后出現高熱、僵硬、肌痛、轉氨酶升高的嚴重急性反應,這可能與GD的自身免疫異常應答有關。目前尚未有GD患者中使用口服劑型雙膦酸鹽出現嚴重不良反應的報道。本研究中RIS對GD患者耐受性良好,僅有1例患者出現輕度上腹不適,表明GD患者口服RIS具有良好的安全性和耐受性。
總之,口服RIS治療GD繼發骨質疏松效果較好。口服RIS治療可改善患者的骨轉換,增加骨密度,從而可能降低未來骨折的風險,為使用利塞膦酸鈉治療GD繼發骨質疏松提供新的文獻支持。

