改良腭咽成形術對阻塞性睡眠呼吸暫停綜合征患者凝血功能的影響
黃志強,謝宇平,何其勝,惠培林,王龍海
(1.四川省達州市中西醫結合醫院神經內科 635000;2.甘肅省人民醫院睡眠醫學中心,蘭州 730000)
阻塞性睡眠呼吸暫停綜合征(obstructive sleep apnea syndrome,OSAS)是由上氣道堵塞導致睡眠狀態下反復出現呼吸暫停和(或)低通氣,引起低氧血癥、高碳酸血癥、睡眠中斷,從而使機體發生一系列病理生理改變的臨床綜合征[1-2]。OSAS可發生在任何年齡段的人群中,男性和女性的患病率分別為24%和9%,隨著年齡的增加發生率增加,約有70%老年男性和56%的老年女性患有此病[3]。OSAS與肥胖、睡眠相關心律失常、高血壓、2型糖尿病、腦卒中、不明原因的死亡相關,從而嚴重影響患者的生活質量且加重了患者的經濟負擔[4]。OSAS引起腦血管意外的原因尚不清楚,但高凝狀態引起血栓形成可能是引起腦血管意外的原因之一[5]。回顧性研究發現,OSAS易引起高凝狀態,而經鼻持續氣道正壓通氣(continuous positive airway pressure,CPAP)會逆轉高凝狀態,從而降低腦血管意外發生[5-6]。CPAP雖已成為治療OSAS的首選方案且無創,但部分患者因上氣道解剖結構異常、CPAP不耐受、自愿選擇手術等需行改良腭咽成形術治療。本研究探討改良腭咽成形術對OSAS患者凝血功能的影響。
1 資料與方法
1.1一般資料 收集2016年8月至2017年2月在甘肅省人民醫院睡眠醫學中心通過多導睡眠圖(polysomnography,PSG)確診為OSAS患者共58例為研究對象,其中男40例,女18例,年齡35~62歲,平均(45.60±14.18)歲,BMI(30.78±2.57)kg/m2;既往有高血壓10例,2型糖尿病3例,吸煙8例。對照組選取本院體檢人員通過PSG排除OSAS者50例,其中男35例,女15例,年齡32~61歲,平均(46.66±13.89)歲,BMI(24.63±2.21)kg/m2;既往有高血壓8例,2型糖尿病2例,吸煙6例。診斷標準:符合睡眠呼吸暫停低通氣綜合征診治指南(2011年修訂版)[7],即通過PSG發現患者在夜間7 h睡眠中呼吸暫停和(或)低通氣反復發作30次以上,或呼吸暫停低通氣指數(apnea-hypopnea index,AHI)大于或等于每小時5次,且呼吸事件以阻塞性為主。排除標準:(1)嚴重心、肝、脾、腎、腦、血液等重大器質性疾病;(2)既往存在慢性支氣管炎、慢性阻塞性肺疾病、支氣管哮喘等慢性缺氧性呼吸道疾病;(3)既往診斷明確存在OSAS且已行手術或正壓通氣治療;(4)術前明確診斷存在家族性高凝狀態;(5)術后PSG證實睡眠呼吸暫停無明顯改善;(6)既往高血壓和2型糖尿病未規律服藥或控制不良;(7)其他因自身疾病而無法完成研究或拒絕參加此研究。本研究經倫理委員會批準,患者及家屬知情同意。
1.2方法 試驗組均采用改良腭咽成形術。經口內舌腭弓根部切開向上至軟腭,向內轉切至懸雍垂,向下沿咽腭弓和舌腭弓切至扁桃體匯合處黏膜,首先分離切除雙側扁桃體與松弛的咽側壁黏膜,充分止血,然后將懸雍垂向上提起,沿軟腭的口鼻腔側黏膜全層切除過長的軟腭后緣及懸雍垂,軟腭的切除可達8~10 mm,注意保留軟腭的肌肉,切除后將咽側壁創面黏膜向前牽拉縫合,軟腭創面將口腔面與鼻腔面黏膜對縫,縫合后咽部成“門”字形。
1.3觀察指標 統計兩組一般資料,包括性別、年齡、BMI、高血壓、2型糖尿病、吸煙史、血脂、血紅蛋白、血小板計數、PSG等。檢測試驗組術前、手術3個月后和對照組凝血酶時間(PT)、活化部分凝血酶時間(APTT)、凝血酶時間(TT)、國際標準化比值(INR)、纖維蛋白原(Fbg)和D-二聚體(D-D)。血常規檢測儀器為Sysmex的全自動血液分析儀(型號 XE-5000),血凝檢測儀器為Stago-evolution全自動凝血分析儀,檢測試劑為Stago 配套試劑。
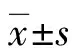
2 結 果
2.1兩組一般資料比較 兩組在性別、年齡、高血壓、2型糖尿病、吸煙史、血脂差異無統計學意義(P>0.05),在BMI、血紅蛋白、血小板計數、最低血氧飽和度(SaO2)、平均SaO2、AHI差異有統計學意義(P<0.05),見表1。

表1 試驗組和對照組一般資料比較
2.2兩組凝血功能比較 兩組APTT、TT、INR差異無統計學意義(P>0.05),在PT、Fbg、D-D差異有統計學意義(P<0.05),見表2。
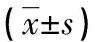
表2 兩組凝血功能比較
2.3試驗組手術前后相關指標和凝血功能情況 和術前比較,試驗組術后BMI、血紅蛋白、血小板計數、最低SaO2、平均SaO2、AHI、PT、Fbg、D-D差異有統計學意義(P<0.05),APTT、TT、INR差異無統計學意義(P>0.05),見表3。
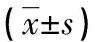
表3 試驗組手術前后相關指標和凝血功能情況
3 討 論
OSAS是一種常見的睡眠障礙性疾病,與腦血管意外密切相關。研究發現OSAS是血小板活化和血栓形成的獨立危險因素,但機制尚未明確,間斷缺氧導致交感神經興奮,引起全身炎性反應、氧化應激和促凝血活性增加,而血小板功能障礙和(或)高凝狀態在腦血管疾病的發病機制中起重要作用[8]。通過糾正缺氧狀態,改善血小板功能和高凝狀態,從而降低腦血管病發病率。
間斷缺氧誘發腎臟產生過多的促紅細胞生成素(EPO)從而刺激骨髓造血活躍,產生繼發性紅細胞增多和血紅蛋白增加,血液的濃縮,觸發血小板生成和活性增加,增加血栓風險[9]。有研究發現肥胖是OSAS最重要的可逆性危險因素,40%的肥胖人群合并OSAS,70%的OSAS合并肥胖,OSAS可能通過血脂紊亂、代謝炎癥、氧化應激增加體質量,而體質量的增加進一步堵塞上氣道加重OSAS[10]。本研究一般資料統計中發現,試驗組BMI、血紅蛋白和血小板計數明顯高于對照組,而行改良腭咽成形術后,BMI、血紅蛋白和血小板計數值均下降,進一步證實間斷缺氧增加BMI、血紅蛋白和血小板計數值,誘發高凝狀態。
OSAS引起腦血管意外可能的機制是呼吸暫停期間,血流動力學急劇變化,腦血流減少,反常栓塞,動脈硬化,低氧相關的腦缺血,以及凝血機制激活[11]。凝血能力的增強已經成為OSAS患者發生腦血管疾病可能的一種病理生理學中介[12]。研究發現OSAS的間歇性低氧,誘導血管內皮細胞損傷,可能啟動外源性凝血途徑[13]。HONG等[14]研究不同嚴重程度OSAS與凝血功能發現,PT值與AHI呈負相關(r=-0.3),中、重度OSAS與正常對照組比較PT和INR明顯減小。有學者發現OSAS患者的FXⅡa、FVⅡa、凝血酶和抗凝血酶(TAT)明顯增加,進一步證實OSAS患者外源性凝血機制可能被激活[15]。本研究發現,與對照組比較,試驗組APTT、TT、INR差異無統計學意義,但PT有變化,改良腭咽成形術能逆轉PT。
纖維蛋白原可以促進紅細胞黏著和血栓形成。研究發現,與正常對照組比較,OSAS血清Fbg明顯升高[16]。有學者還發現Fbg與OSAS合并腦卒中患者的AHI呈正相關,說明OSAS引起的Fbg升高可能參與腦卒中的發生[17]。在纖溶過程中研究者發現,和正常對照組比較,OSAS患者纖溶酶原激活物抑制劑(PAI-1)明顯升高,而CPAP治療后,PAI-1顯著下降,推測OSAS導致PAI-1的升高是可逆的,CPAP可以糾正OSAS患者的夜間間歇性缺氧從而降低腦血管意外發生[18]。本研究發現,OSAS患者Fbg明顯升高,而行改良腭咽成形術后Fbg明顯下降,說明改良腭咽成形術可以改善OSAS缺氧狀態,通過改善Fbg降低腦血管意外發生。
D-D來源于纖溶酶溶解的交聯纖維蛋白凝塊,主要反映纖維蛋白溶解功能,其升高反映體內存在凝血及纖溶活性增強的重要分子標志物。研究發現OSAS與D-D 存在明顯相關性,且與缺氧程度呈正相關[6]。本研究OSAS 患者血漿D-D水平增高,提示 OSAS 患者體內凝血系統可能被過度活化,導致繼發性纖溶亢進,而改良腭咽成形術能逆轉D-D 升高。
已經證實,CPAP可以通過改善OSAS缺氧狀態從而逆轉高凝狀態,但改良腭咽成形術對凝血功能的影響,目前國內尚未見相關研究報道。本研究說明,OSAS患者可能普遍存在高凝狀態,而改良腭咽成形術同樣可以通過改善OSAS缺氧狀態,從而逆轉高凝狀態最終降低腦血管意外的發生。但本研究也存在不足,如樣本量仍少、隨訪時間偏短(術后3個月)、缺乏凝血過程其他因子檢測等。OSAS引起高凝狀態和改良腭咽成形術逆轉高凝狀態的具體機制還需進一步研究。

