結腸癌干細胞在結腸癌組織的表達及其對腫瘤線粒體呼吸鏈的影響
余少鴻,趙永恒,朱 磊,羅 然,楊 杰,舒 杰,李建昌,宋登輝,高俊勇
(1.云南省昆明市第一人民醫院甘美國際醫院普外科 650000;2.重慶市涪陵中心醫院腫瘤內科 400800)
結腸癌是消化系統常見腫瘤之一[1],雖然有手術、化療、分子靶向治療等綜合治療手段,但療效不佳。腫瘤干細胞理論是近年來提出的新理論[2],可能更好解釋腫瘤發生、發展、復發、轉移、耐藥等過程。研究發現,腫瘤干細胞存在于白血病、乳腺癌、結直腸癌、肝癌、胃癌、胰腺癌等多種腫瘤。2007年首次報道結直腸癌干細胞的存在[3-5],其具有自我更新、多向分化、能連續傳代等特征。其鑒定的方法主要是流式細胞儀檢測表面標志物CD133、CD44、乙醛脫氫酶1(ALDH1)、上皮細胞黏附分子(epithelial cell adhension molecule,EpCAM)、CD166等。CD44是一種與細胞增殖、腫瘤侵入、血管增生相關的膜受體,動物實驗表明,拮抗CD44可抑制腫瘤細胞生長。
分離培養腫瘤干細胞是研究結腸癌干細胞的前提,國內有文獻報道,從結腸癌Lovo細胞提取CD44/EpCAM陽性細胞可以達到17.4%[6]。因此,筆者擬采用新鮮結腸癌及結腸癌細胞分離培養結腸癌干細胞,并建立穩定傳代的結腸癌干細胞珠。線粒體是細胞能量生成、儲存和供給的場所,電子在線粒體內沿電子傳遞鏈經氧化磷酸化的方式被轉化成含有高能磷酸鍵的腺苷三磷酸(ATP),線粒體呼吸鏈酶復合物Ⅰ~Ⅳ是電子傳遞鏈的組成成分,其活性變化能直接或間接地反映線粒體呼吸功能的變化。復合物Ⅰ是呼吸酶復合物中最大的一個,高能電子首先經過復合物Ⅰ,釋放能量后依次下傳。復合物Ⅲ細胞色素C氧化酶(COX)是位于線粒體內膜上呼吸鏈末端的限速酶,是唯一能將電子傳遞給氧分子的細胞色素復合物,因此復合物Ⅰ和Ⅲ在整個電子傳遞及氧化磷酸化過程中起關鍵作用。本研究探索人結腸癌干細胞COXⅠ、ND1基因mRNA的表達變化。
1 材料與方法
1.1材料 新鮮結腸癌組織選自本院37例結腸癌手術患者標本;人結腸癌HCT-116、HT-29細胞均由中國醫學科學院昆明生物研究所惠贈;CD44抗體及CD133抗體均購自德國Miltenyi Biotec公司,Actin抗體、細胞裂解液(RIPA)均購自碧云天公司(中國),10%胎牛血清購自美國Biological Industries公司,Dulbecco改良細胞培養基(DMEM培養基)購自美國Thermo Scientific公司,實時熒光定量PCR儀購自美國ABI公司,流式細胞儀Accuri C6購自美國BD公司。
1.2方法
1.2.1新鮮結腸癌細胞的分離 選取結腸癌患者新鮮病理標本,剪碎標本,離心,DTT液去除黏膜,PBS液沖洗4次,DNA裂解酶分離裂解標本,PBS液洗滌,DNA酶拮抗劑中和,磨碎標本,離心,提取結腸癌細胞。
1.2.2細胞培養與分離 將結腸癌細胞株接種于含10%胎牛血清的DMEM培養液中,在37℃、5%CO2的培養箱中培養,常規傳代。CD44磁珠與人新鮮結腸癌細胞、HT29細胞和 HCT116細胞孵育,然后用LS柱(Miltenyi Biotec,130042401)與磁珠分選起始套裝(Miltenyi Biotec,130091051)混合分離CD44+細胞;CD44+/-細胞培養于DMEM/F12 培養液(Gibico,1237830),包括cEGF、bEGF和B27等因子。而沒有分離的細胞培養于DMEM 培養液(HyClone,SH30243.01B)。每隔3 d顯微鏡下觀察細胞生長情況。
1.2.3流式細胞儀檢測其表面標記物 收集結腸癌細胞后,把每管0.5 mol/L細胞,離心,取沉淀,混勻,添加抗體IgG1-PE、IgG1-FITC、CD133-PE和CD44-FITC(各2 μL/0.5 mol/L)在2~8 ℃孵育。CD133或CD44陽性細胞由流式細胞儀Accuri C6篩選。重懸細胞于培養液中繼續培養。
1.2.4細胞總RNA的提取和鑒定 結腸癌干細胞繼續培養8 h,以同期培養的結腸癌細胞株為對照,提取細胞總RNA。首先用PBS緩沖液將細胞清洗3遍,而后按照TRIzol試劑說明書的步驟進行操作,最終提取的RNA以DEPC水溶解后加入DNase酶消化去除DNA,并利用紫外分光光度計測定RNA的濃度與純度,瓊脂糖凝膠電泳檢測RNA的完整性。
1.2.5引物合成 ND1、COXⅠ、t3-actin引物由上海生工生物工程有限公司合成。根據人線粒體基因組序列(www.mitomap.org),應用Primer Premier 5.0設計mtDNA上的3對引物,且以看家基因t3-aetin作為內參照,并在BLAST上進行同源性分析,引物核苷酸序列如下:ND1上游引物5′-AATCGCAATGGCATTCCTAA-3′,下游引物5′-GTAGAGGGTGATGGTAGATGTG-3′,長度229 bp;COXⅠ上游引物5′-TACCCATCATAATC GG A G GC-3′,下游引物5′-ATAGCAGATGCGAGCAGGAG-3′,長度223 bp;t3-actin上游引物5′-ACTTAGTT GCGAC ACC CrnC-3′,下游引物5′-GACTGCTGTCACCTTCACCG-3′,長度162 bp。
1.2.6實時熒光定量PCR(Real-time PCR)法檢測ND1及COXⅠ mRNA的表達 定量檢測線粒體基因表達。反應體系25 mol/L:2×SYBR green 12.5 μL,cDNA模板2 μL,上下游引物各0.2 μL,補雙蒸水至25 μL,每個樣品設置3個平行樣。反應條件:95 ℃預變性10 min后進行下述40個循環,95 ℃變性15 s,60 ℃退火和延伸1 min。由于本研究使用的是相對定量方法,所以必須觀察融解曲線來優化引物含量。
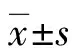
2 結 果
2.1細胞形態 分選新鮮結腸癌細胞、HT-29細胞、HCT-116細胞中CD44+分別為2.1%、4.0%及4.6%,后繼實驗證明細胞生長良好,見圖1。
2.2流式細胞儀檢測其生物學特征 結腸癌細胞、HCT-116細胞、HT-29細胞中CD44及CD133表達同時陽性細胞百分率僅為0%、1.8%及2.1%,見圖2。
2.3各組ND1 mRNA的表達情況 與CD44-比較, CD44+的結腸癌細胞ND1 mRNA的表達水平升高了300%,HCT-116細胞升高了400%,差異均有統計學意義(P<0.05);而HT-29細胞只升高了5%,差異無統計學意義(P>0.05),見圖3、4。

圖1 各組CD44+細胞形態

圖2 流式細胞技術檢測各組CD133/CD44陽性表達情況

圖3 各組ND1 mRNA PCR電泳情況

*:P<0.05,與CD44-細胞比較
圖4各組ND1 mRNA的表達情況
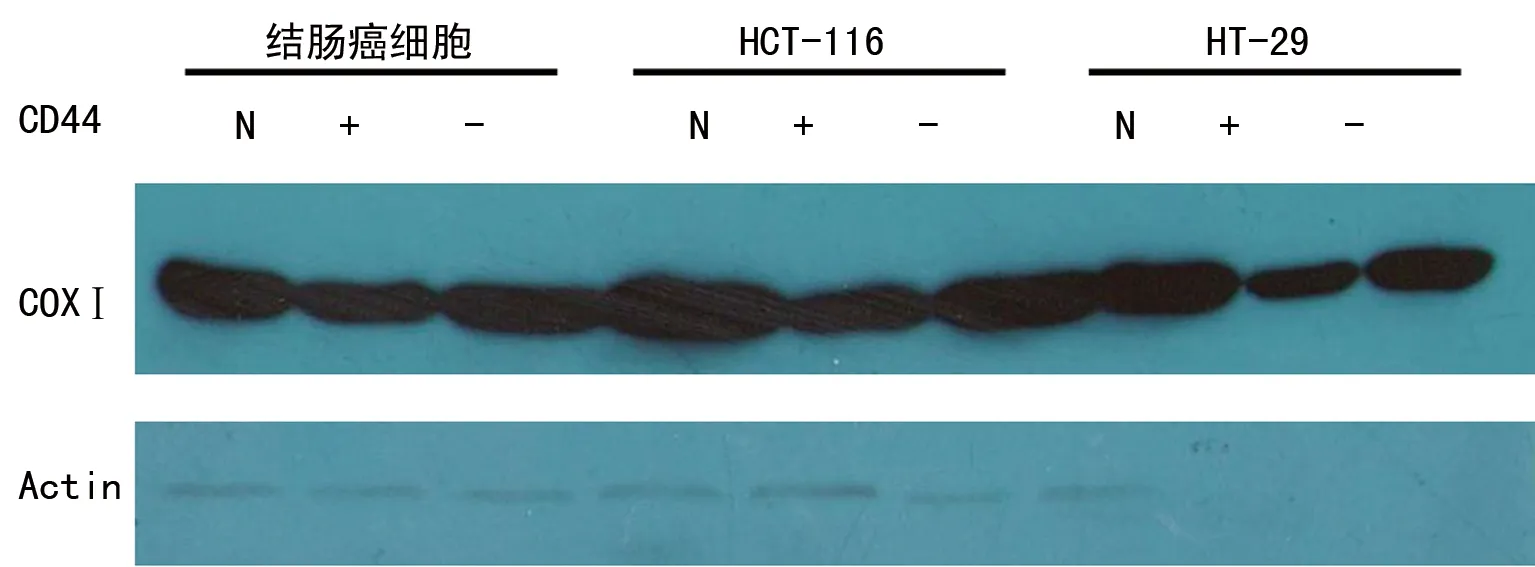
圖5 各組COXⅠ mRNA PCR電泳情況
2.4各組COXⅠ mRNA的表達情況 與CD44-比較, CD44+的結腸癌細胞COXⅠ mRNA的表達水平升高了350%,HT-116細胞升高了300%,差異均有統計學意義(P<0.05);而HT-29細胞無明顯變化,差異無統計學意義(P>0.05),見圖5、6。

*:P<0.05,與CD44-比較
圖6各組COXⅠ mRNA的表達情況
3 討 論
腫瘤干細胞學說認為[7-9]:腫瘤細胞存在異質性,其中一小群具有自我更新、無限增殖能力和不定分化潛能的腫瘤細胞即為腫瘤干細胞,是腫瘤形成的起始細胞,并維持腫瘤的生長;腫瘤干細胞對放療及化療藥物不敏感[10-11],可能是腫瘤轉移、復發的根源。目前絕大多數常見惡性腫瘤的腫瘤干細胞分離已取得成功,本實驗選取37例新鮮結腸癌患者病理標本及兩種人結腸癌細胞系。HT-29是人高分化結腸癌細胞,易形成球形,用于觀察腫瘤細胞間細胞連接與免疫細胞作用;HCT-116是人來源結腸癌細胞,處于結腸癌分化早期階段,更接近于干細胞特性;以CD44表面抗原為基礎,聯合CD133表面抗原,以腫瘤干細胞特有和必需的生物學特性,證實腫瘤干細胞具有自我更新、增殖分化能力、強致瘤性及遺傳穩定性,分離、鑒定了結腸癌干細胞,為下一步分子生物學研究提供基礎。
人們對線粒體的認識已不再停留在“細胞能量工廠”的最初階段,目前的研究認為線粒體還參與氧化損傷、細胞凋亡和人類進化,甚至與一些慢性退行性疾病和多種腫瘤的發生相關。近年來,越來越多的關于線粒體的研究已深入到線粒體膜通透性轉變孔道、線粒體膜點位、Ca2+負荷、氧化損傷、凋亡前體分子、線粒體基因組穩定性、線粒體DNA缺失及拷貝數變化等方面[12],但有關線粒體基因表達方面的研究較少。研究表明,放射可誘導人線粒體COXⅠ、ND1和ND6表達升高[13]。結腸癌發生與線粒體細胞色素氧化酶COXⅠ缺乏與突變有關[14-15]。本研究結腸癌干細胞線粒體呼吸氧化系統酶指標明顯升高,代謝更加活躍,干細胞需要能量及需氧量更加旺盛,阻斷ND1或COXⅠ的表達有可能會抑制腫瘤細胞的生長。因此,抑制線粒體呼吸系統酶活性有望成為治療腫瘤的又一潛在指標。

