培門冬酰胺酶治療結(jié)外NK/T細(xì)胞淋巴瘤的效果和安全性
金莉 李朝輝 徐寧 宋楠
[摘要]目的 探討培門冬酰胺酶治療結(jié)外NK/T細(xì)胞淋巴瘤的效果和安全性。方法 選取鞍山市腫瘤醫(yī)院2014年1月~2017年12月收治的60例結(jié)外NK/T細(xì)胞淋巴瘤患者作為研究對(duì)象,以隨機(jī)數(shù)字表法分為對(duì)照組及觀察組,每組各30例。對(duì)照組采用吉西他濱、奧沙利鉑、地塞米松與左旋門冬酰胺酶治療,觀察組采用吉西他濱、奧沙利鉑、地塞米松與培門冬酰胺酶治療,比較兩組患者的近期療效及藥物毒副反應(yīng)。結(jié)果 觀察組的總有效率為93.33%,對(duì)照組的總有效率為90.00%,兩組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。觀察組的消化道反應(yīng)、高血糖及變態(tài)反應(yīng)發(fā)生率明顯低于對(duì)照組(P<0.05)。兩組患者的粒細(xì)胞減少、血小板減少、肝功能損害發(fā)生率比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。結(jié)論 培門冬酰胺酶治療結(jié)外NK/T細(xì)胞淋巴瘤近期效果確切,毒副反應(yīng)較小,安全性高,值得臨床推廣。
[關(guān)鍵詞]培門冬酰胺酶;NK/T細(xì)胞淋巴瘤;近期效果;安全性
[中圖分類號(hào)] R733.4 ? ? ? ? ?[文獻(xiàn)標(biāo)識(shí)碼] A ? ? ? ? ?[文章編號(hào)] 1674-4721(2019)1(b)-0074-03
[Abstract] Objective To investigate the effect and safety of Pegaspargase in the treatment of extranodal NK/T cell lymphoma. Methods A total of 60 patients admitted from January 2014 to December 2017 in Anshan Tumor Hospital were selected as the research objects. Patients were divided into the control group and the observation group by the random table method, 30 cases in each group. The control group was treated with Gemcitabine, Oxaliplatin, Dexamethasone and L-asparaginase, while the observation group was treated with Gemcitabine, Oxaliplatin, Dexamethasone and Pegaspargase. The short-term curative efficacy and drug toxicity side effect were compared between the two groups. Results The total effective rate was 93.33% in the observation group and 90.00% in the control group, the difference was not statistically significant (P>0.05). The incidence of digestive tract reaction, hyperglycemia and allergic reaction in the observation group was significantly lower than that in the control group (P<0.05). There was no significant difference in the incidence of neutropenia, thrombocytopenia and hepatic dysfunction between the two groups (P>0.05). Conclusion Pegaspargase in the treatment of extranodal NK/T cell lymphoma is effective in the short term, with less side effect and high safety. It is worthy of clinical promotion.
[Key words] Pegaspargase; NK/T cell lymphoma; Short-term effect; Safety
結(jié)外NK/T細(xì)胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTL)是一種特殊病理類型的淋巴腫瘤[1-2]。ENKTL在亞洲和拉丁美洲較為常見,占中國(guó)所有惡性淋巴瘤的5%~10%,是一種高度侵襲性腫瘤,進(jìn)展快且預(yù)后不良[3]。L-門冬酰胺酶具有獨(dú)特的抗腫瘤機(jī)制,當(dāng)L-門冬酰胺被L-門冬酰胺酶耗盡時(shí),腫瘤細(xì)胞因不能合成L-門冬酰胺導(dǎo)致DNA和RNA合成障礙而受到抑制[4]。培門冬酰胺酶是一種與聚乙二醇共價(jià)連接的大腸桿菌L-門冬酰胺酶,對(duì)急性淋巴細(xì)胞白血病有效,且無(wú)明顯毒副反應(yīng)[5]。目前,臨床對(duì)于培門冬酰胺酶治療ENKTL報(bào)道較少,本研究旨在探討ENKTL患者應(yīng)用培門冬酰胺酶的臨床效果,現(xiàn)報(bào)道如下。
1資料與方法
1.1一般資料
選擇鞍山市腫瘤醫(yī)院2014年1月~2017年12月收治的60例ENKTL患者作為研究對(duì)象,以隨機(jī)數(shù)字表法分為對(duì)照組及觀察組,每組各30例。納入標(biāo)準(zhǔn):患者均經(jīng)病理學(xué)檢查及免疫組化分型診斷為ENKTL;無(wú)化療禁忌;體力ECOG評(píng)估分值<2分。排除標(biāo)準(zhǔn):合并嚴(yán)重臟器功能不全患者;腫瘤侵犯腦部患者;罹患精神疾病難以配合患者。對(duì)照組中,男16例,女14例;年齡25~67歲,平均(55.6±7.9)歲;病程11~46 d,平均(28.1±5.3)d;分期:Ⅰ~Ⅱ期14例,Ⅲ~Ⅳ期16例。觀察組中,男15例,女15例;年齡24~66歲,平均(56.1±8.2)歲;病程13~46 d,平均(27.6±5.0)d;分期:Ⅰ~Ⅱ期16例,Ⅲ~Ⅳ期14例。兩組患者的性別、年齡等一般資料比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),具有可比性。本研究所有患者均簽署知情同意書,由醫(yī)院醫(yī)學(xué)倫理委員會(huì)批準(zhǔn)實(shí)施。
1.2治療方法
對(duì)照組第1、8天靜脈滴注吉西他濱(上海創(chuàng)諾制藥有限公司,國(guó)藥準(zhǔn)字 H20113194)1000 mg/m2,第1天靜脈滴注130 mg/m2奧沙利鉑(南京制藥廠有限公司,國(guó)藥準(zhǔn)字 H20000686);第1~7天靜脈滴注地塞米松(上海北杰集團(tuán)關(guān)東藥業(yè)有限公司,國(guó)藥準(zhǔn)字 H220 22648)10 mg;第1~7天靜脈滴注5000 U/m2左旋門冬酰胺酶(協(xié)和發(fā)酵麒麟制藥有限公司,國(guó)藥準(zhǔn)字 J20100138)。 研究組第1、8天靜脈滴注1000 mg/m2吉西他濱;第1天靜脈滴注130 mg/m2奧沙利鉑;第1~7天靜脈滴注10 mg地塞米松;第1天靜脈滴注培門冬酰胺酶2500 U/m2(江都恒瑞醫(yī)藥股份有限公司,國(guó)藥準(zhǔn)字 H20090015)代替左旋門冬酰胺酶。以3周為1個(gè)療程,一般進(jìn)行2~3個(gè)療程。同時(shí)兩組患者均接受適型調(diào)強(qiáng)放療,療程結(jié)束時(shí)進(jìn)行療效評(píng)價(jià)。
1.3觀察指標(biāo)及評(píng)價(jià)標(biāo)準(zhǔn)
采用國(guó)際淋巴瘤工作組制定的非霍奇金淋巴瘤治療反應(yīng)標(biāo)準(zhǔn)[6]進(jìn)行療效判定,具體如下。完全緩解(complete response,CR):腫瘤完全消失達(dá)1個(gè)月以上;不確定的完全緩解(complete remission unconfirmed,CRu):腫瘤未達(dá)到CR但是超過(guò)部分緩解(partial response,PR)的情況;PR:腫瘤兩個(gè)淋巴結(jié)最大直徑的乘積縮小≥50%,其他病灶無(wú)增大,并且維持1個(gè)月以上;穩(wěn)定(stable disease,SD):腫瘤兩個(gè)淋巴結(jié)最大直徑的乘積縮小<50%,或大小無(wú)明顯變化;進(jìn)展(progressive disease,PD):腫瘤增大超過(guò)或有新的轉(zhuǎn)移灶出現(xiàn)。總有效=CR+CRu+PR。毒副反應(yīng)評(píng)價(jià)采用WHO抗腫瘤藥物毒副反應(yīng)分度標(biāo)準(zhǔn)[7],包括消化道反應(yīng)、粒細(xì)胞減少、血小板減少、肝功能損害、高血糖、變態(tài)反應(yīng)。
1.4統(tǒng)計(jì)學(xué)方法
采用SPSS 20.0統(tǒng)計(jì)軟件對(duì)數(shù)據(jù)進(jìn)行分析,計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,采用t檢驗(yàn),計(jì)數(shù)資料以百分率表示,采用χ2檢驗(yàn),以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2結(jié)果
2.1兩組患者近期療效的比較
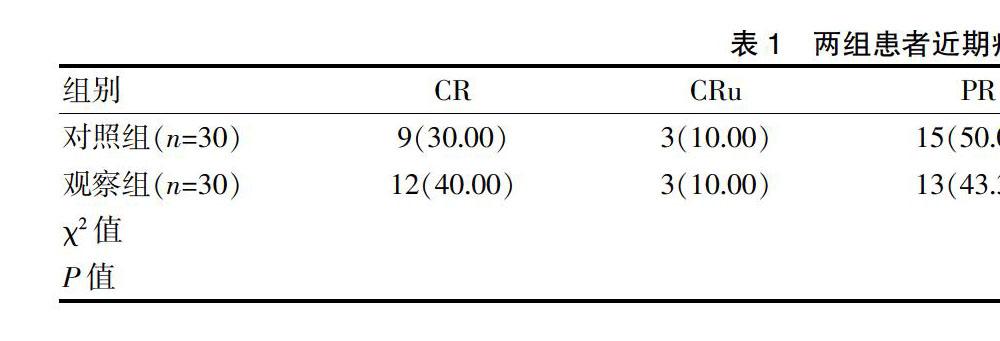
觀察組的總有效率為93.33%,對(duì)照組的總有效率為90.00%,兩組比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)(表1)。
2.2 兩組患者治療期間毒副反應(yīng)的比較
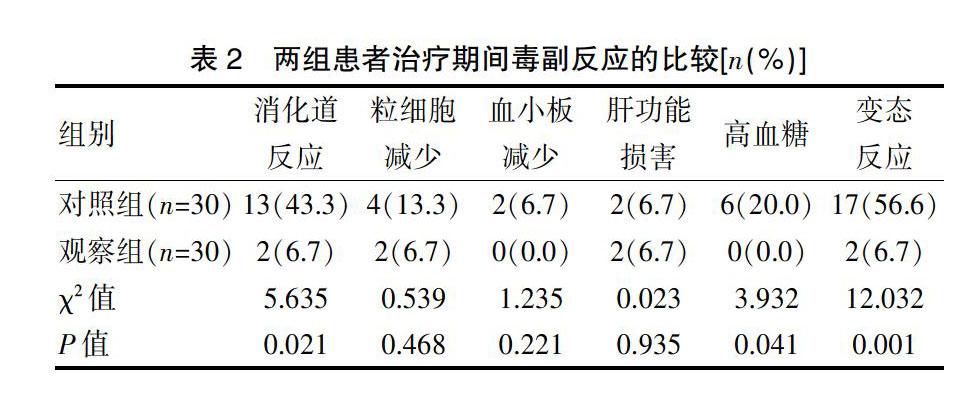
觀察組的消化道反應(yīng)、高血糖及變態(tài)反應(yīng)發(fā)生率明顯低于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。兩組的粒細(xì)胞減少、血小板減少、肝功能損害發(fā)生率比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)(表2)。
3討論
ENTKL被認(rèn)為是最嚴(yán)重的淋巴瘤之一,但是目前化療效果欠佳,治療失敗的部分原因在于調(diào)控P-糖蛋白等的耐藥相關(guān)基因的過(guò)度激活,導(dǎo)致藥物外排[8]。L-門冬酰胺酶可消耗門冬酰胺蛋白質(zhì),抑制腫瘤細(xì)胞中的DNA和RNA合成,其抗腫瘤機(jī)制不受P-糖蛋白的影響,在急性淋巴細(xì)胞白血病和淋巴瘤中抗腫瘤效果確切。目前,L-門冬酰胺酶對(duì)ENTKL的療效和安全性相關(guān)報(bào)道仍較少,而且,與高度免疫原性有關(guān)的嚴(yán)重毒性顯著限制著L-門冬酰胺酶的通用性[9]。培門冬酰胺酶作為新一代的L-門冬酰胺酶,在急性白細(xì)胞白血病中療效明確而且患者耐受性更佳[10]。在對(duì)ENKTL有限的病例報(bào)道和臨床研究中,培門冬酰胺酶已經(jīng)呈現(xiàn)出潛在的療效,但是,這些證據(jù)對(duì)于確保在ENKTL中普及培門冬酰胺酶還遠(yuǎn)遠(yuǎn)不足。
在本研究中,培門冬酰胺酶呈現(xiàn)出較高的治療有效率,觀察組的總有效率達(dá)到93.33%,這一結(jié)果與其他幾個(gè)研究相類似[11-12],再一次確定了培門冬酰胺酶治療ENKTL的可行性。較L-門冬酰胺酶,培門冬酰胺酶顯示出了較可接受的毒副反應(yīng),主要集中于粒細(xì)胞減少、血小板減少和肝功能損害,而消化道反應(yīng)、高血糖、變態(tài)反應(yīng)發(fā)生率則明顯降低(P<0.05)。其中粒細(xì)胞減少和血小板減小可能是由骨髓抑制作用引起,而高血糖則被認(rèn)為與L-門冬酰胺酶可誘發(fā)胰腺炎有關(guān)。另外,培門冬酰胺酶暫未發(fā)現(xiàn)變態(tài)反應(yīng)等嚴(yán)重的可能致死的毒副反應(yīng)。培門冬酰胺酶血漿半衰期約5.5 d,較L-門冬酰胺酶(大約20 h)大大延長(zhǎng),不需要皮試,臨床使用較為方便[13]。
包含培門冬酰胺酶、吉西他濱的化學(xué)療法在ENKTL治療中顯示出確切的效果,目前的研究對(duì)于門冬酰胺酶相關(guān)的療效和安全性評(píng)價(jià)指標(biāo)仍然較少,患者培門冬酰胺酶治療的反應(yīng)性被發(fā)現(xiàn)與血清骨髓相關(guān)蛋白-14(myeloid-related protein 14,MRP14)和血清類粘蛋白1(orosomucoid 1,ORM1)蛋白有關(guān)[2]。S100A9蛋白和ORM1蛋白在門冬酰胺酶、吉西他濱相關(guān)治療方案不敏感的患者中常出現(xiàn)明顯的升高。S100A9蛋白是衡量ENTKL惡性程度的重要指標(biāo)[14],急性期蛋白ORM1則作為炎癥因子在ENKTL患者血清中上調(diào)[15],目前這兩種蛋白被認(rèn)為對(duì)培門冬酰胺酶的療效和毒副反應(yīng)有一定的提示效果,是ENKTL預(yù)后的獨(dú)立預(yù)測(cè)因子,但是其具體機(jī)制還不明確,其中ORM1蛋白升高所提示的炎癥與ENKTL的關(guān)系更需進(jìn)一步地探究。
綜上所述,門冬酰胺酶治療ENKTL近期效果確切,可有效緩解疾病進(jìn)展,毒副反應(yīng)小,消化道與變態(tài)反應(yīng)發(fā)生率較低。想要對(duì)門冬酰胺酶的療效和安全性進(jìn)行更確切的評(píng)價(jià),還需更側(cè)重于尋找相關(guān)的分子標(biāo)志物。
[參考文獻(xiàn)]
[1]Reyes VE,Al-Saleem T,Robu VG,et al.Extra nodal NK/T-Cell lymphoma nasal type:efficacy of pegaspargase report of two patients from the united sates and review of literature[J].Leuk Res,2010,34(1):50-52.
[2]Zhou Z,Li Z,Sun Z,et al.S100A9 and ORM1 serve as predictors of therapeutic response and prognostic factors in advanced extranodal NK/T cell lymphoma patients treated with pegaspargase/gemcitabine[J].Sci Rep,2016,6(29):23-25.
[3]Tse E,Kwong YL.The diagnosis and management of NK/T-cell lymphomas[J].J Hematol Oncol,2017,4(14):85-88.
[4]Wang J,Wang L,Liu C,et al.Efficacy of combined gemcitabine,oxaliplatin and pegaspargase (P-gemox regimen) in patients with newly diagnosed advanced-stage or relapsed/refractory extranodal NK/T-cell lymphoma[J].Oncotarget,2016,7(20):29 092-29 101.
[5]Wang J,Wang H,Wang Y,et al.Analysis of the efficacy and safety of a combined gemcitabine,oxaliplatin and pegaspargase regimen for NK/T-cell lymphoma[J].Oncotarget,2016,7(23):35 412-35 422.
[6]Lahoud OB.High-dose chemotherapy and autologous stem cell transplant in older patients with lymphoma[J].Am J Hematol,2018,6(1):40-46.
[7]Sun Y,Narayan VA,Wittenberg GM.Side effect profile similarities shared between antidepressants and immune-modulators reveal potential novel targets for treating major depressive disorders[J].BMC Pharmacol Toxicol,2016,10(21):47-49.
[8]Zhang L,Jia S,Ma Y,et al.Efficacy and safety of cisplatin,dexamethasone,gemcitabine and pegaspargase (DDGP) regimen in newly diagnosed,advanced-stage extranodal natural killer/T-cell lymphoma:interim analysis of a phase 4 study NCT01501149[J].Oncotarget,2016,7(34):55 721-55 731.
[9]Zhang L,Li S,Jia S,et al.The DDGP (cisplatin,dexamethasone,gemcitabine,and pegaspargase) regimen for treatment of extranodal natural killer (NK)/T-cell lymphoma,nasal type[J].Oncotarget,2016,7(36):58 396-58 404.
[10]Xu PP,Xiong J,Cheng S,et al.A phase Ⅱ study of Methotrexate,Etoposide,Dexamethasone and Pegaspargase sandwiched with radiotherapy in the treatment of newly diagnosed,stage ⅠE to ⅡE extranodal natural-killer/T-cell lymphoma,nasal-type[J].EBioMedicine,2017,25(1):41-49.
[11]Chang Y,F(xiàn)u X,Sun Z,et al.Utility of baseline,interim and end-of-treatment (18)F-FDG PET/CT in extranodal natural killer/T-cell lymphoma patients treated with L-asparaginase/pegaspargase[J].Sci Rep,2017,7(24):41 057-41 059.
[12]Liang J,Wang L,Peter Gale R,et al.Efficacy of pegaspargase,etoposide,methotrexate and dexamethasone in newly diag-nosed advanced-stage extra-nodal natural killer/T-cell lymphoma with the analysis of the prognosis of whole blood EBV-DNA[J].Blood Cancer J,2017,7(9):60-63.
[13]Bu S,Yuan F,Wei X,et al.L-asparaginase-based regimen as a first-line treatment for newly diagnosed nasal type extranodal natural killer cell/T-cell lymphoma[J].Exp Ther Med,2016,11(6):2437-2445.
[14]Kallberg E,Vogl T,Liberg D,et al.S100A9 interaction with TLR4 promotes tumor growth[J].PLoS One,2012,7(3):34 207-34 208.
[15]Gery S,Gombart AF,Yi WS,et al.Transcription profiling of C/EBP targets identifies Per2 as a gene implicated in myeloid leukemia[J].Blood,2005,106(8):2827-2836.
(收稿日期:2018-03-19 ?本文編輯:祁海文)

