胰腺實性假乳頭狀瘤45例臨床分析
張俊昶 胡矩強 顧小暉 劉新江 龐志剛
胰腺實性假乳頭狀瘤(SPN)是一種罕見的胰腺外分泌腫瘤,曾經使用過多個名稱,包括實性-假乳頭狀腫瘤、實性-囊性腫瘤、囊性上皮腫瘤和乳頭狀-囊性腫瘤,直到世界衛生組織(WHO)在2010年指定并重新分類為SPN。Frantz 于1959年首先報道,因此也稱Frantz 瘤[1]。自從被WHO 的分級文獻中引入以來,胰腺實性假乳頭狀瘤的發病率逐漸上升,本研究收集45 例病理學確診為SPN的病例,并結合近期文獻來討論其病理形態特點、免疫表型、鑒別診斷及預后等,以期提高對本類病變的認識水平。
1 材料與方法
1.1 材料來源 收集我院2015~2017年診斷的胰腺實性假乳頭狀瘤共45 例,患者多因體檢發現胰腺占位就診,少數患者出現腹部包塊、腹痛等癥狀。其中男8 例,女37 例,男女比例約為1∶4.6,年齡8~60 歲,平均33.4 歲,中位年齡32 歲。15 例腫瘤見于胰頭部或胰頭體部,1 例見于胰腺鉤突部,其他29 例腫瘤見于胰腺體尾部。所有病例均行手術切除或姑息性減瘤手術,隨訪8~43 個月,無失訪病例,均具備完整的臨床及病理資料,均行免疫組化染色確診為SPN,所有病例均行手術切除或姑息性減瘤手術,其中2 例出現腫瘤復發并帶瘤生存,其余病例未見明顯復發及轉移。
1.2 方法 所有標本經常規HE 染色并選擇形態規則蠟塊,全部或部分行免疫組化染色檢查(β-Catenin、Vimentin、Syn、insulin、ACT、AAT、CD10、PR、CD56、CgA、CK),一抗以及二抗均購自北京中杉金橋生物技術有限公司。實驗用已知陽性片作陽性對照,用PBS 代替一抗作陰性對照,應用枸櫞酸緩沖液高溫高壓修復切片抗原性;染色按說明書進行。
2 結果
2.1 大體檢查 腫瘤多為單發的巨大、圓形腫物,直徑0.4~15.0cm,平均5.56cm,多數有包膜包被,與周圍組織分界清楚。本研究中43 例腫瘤根治性切除病例,男8 例,女35 例,男性的瘤體大小較女性的差異無統計學意義(P=0.535)
2.2 鏡下檢查及病理診斷 切面可見淡棕色或黃色的實性區及出血,見圖1a,壞死的囊性區、實性區和囊性區比例差異較大,部分病例幾乎全部表現為出血囊性變。腫瘤質地較軟,腫瘤壁可見鈣化。SPN生長方式較為多樣,以實性區、假乳頭狀區及假囊狀結構為特征性表現,三種結構比例不同。實性區由形態一致的粘附性差的腫瘤細胞組成,無明顯異性,呈圓形或卵圓形,其間質常有不同程度的透明變、粘液變,可見小團泡沫樣胞質的腫瘤細胞。假乳頭狀區是特征性的組織學結構,見圖1b,遠離血管的粘附性差的腫瘤細胞蛻變脫落,使得小血管周圍的細胞圍繞小血管形成假乳頭狀排列,細胞形態單一,呈復層或單層排列,具有嗜酸性或透明的空泡狀胞質。囊性區常為灶狀壞死、小灶鈣化以及纖維化伴玻璃樣變,見圖1a,并可見異物巨細胞反應和膽固醇樣結晶,腫瘤間質的出血壞死及黏液樣變性同樣是其特征性改變。其中7 例可見胰腺實質浸潤,2 例可見神經侵犯。
2.3 免疫表型 免疫組化結果顯示β-連環蛋白(β-Catenin)、波形蛋白(Vimentin)均為陽性(45/45,42/42),突觸素(Syn)陽性率81.0%(34/42)、神經特異性烯醇化酶(NSE)陽性率83.3%(10/12)、胰島素受體(insulin)和抗糜蛋白酶(ACT)均為陽性(4/4)、抗胰蛋白酶(AAT)陽性率90.9%(10/11)、白細胞分化抗原10(CD10)陽性率81.8%(36/44)、孕激素受體(PR)陽性率84.6%(22/26)、白細胞分化抗原56(CD56)陽性率92.0%(23/25)、嗜鉻素A(CgA)陽性率10.0%(4/40)、細胞角蛋白(CK)陽性率55.2%(16/29)。
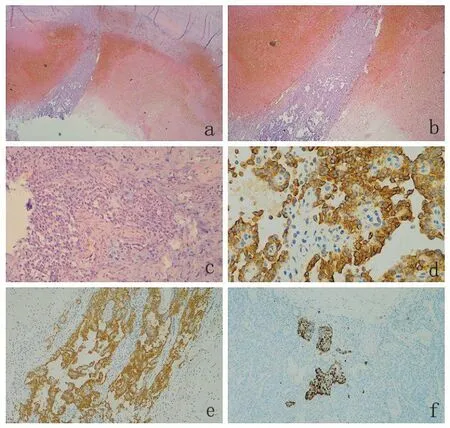
圖1 鏡下表現及免疫表型
3 討論
SPN 是一種少見的具有惡性潛能的胰腺外分泌腫瘤,由Frantz 于1959年首先報道,曾使用過多個名稱,WHO 在2010年指定并重新分類為SPN。SPN 占所有原發性胰腺腫瘤的1%,占所有胰腺囊性腫瘤的3%,臨床超過1/3 的患者無癥狀,最常見的臨床特征是可觸及的腹部包塊,腫瘤較大者可出現腹痛、腹脹等癥狀[2,3]。大部分病例見于年輕女性,有學者報道男性患者腫瘤具有瘤體較小、實性多見、出血少的特點。本研究中男性患者瘤體大小與女性患者的差異無統計學意義(P=0.535)。WHO推薦以核β-Catenin、Vimentin、CD10、CgA 等作為SPN 的核心免疫組化抗體,本研究發現SPN 組織中Vimentin、β-Catenin 和ACT 幾乎100%陽性,AAT、CD56 和角蛋白(AE1/AE3)部分陽性,Syn 陽性率為81.0%,CgA 陽性率較低,PR 常為陽性或局灶性陽性。如腫瘤CD10 表達陽性,胞質和胞核β-Catenin陽性以及胞膜上E-cadherin 表達缺失而在胞核內持續表達,則可能就是SPN。SPN 通過100%靈敏度和100%特異性鑒定存在CTNNB1 突變和不存在KRAS,GNAS 或RNF43 突變或18 號染色體雜合性缺失,當診斷困難時,可以作為診斷思路的參考。
SPN 多表現為囊實性,診斷不難,但需要與其他囊性或囊實性腫瘤相鑒別。現歸納診斷流程如下:①根據流行病學特點進行診斷:SPN 多發于年輕女性,較少見,預后良好,是一種低度惡性腫瘤,臨床超過1/3 的患者無癥狀,腫瘤較大者可出現腹痛、腹脹等癥狀[3]。②根據影像學表現來進行診斷:超聲、CT 及MRI 可見囊實性腫塊,囊性或實性為主,也可兩者相仿,少數瘤體內有出血灶,也可見鈣化灶。增強CT 掃描可見實性結構呈漸進性的輕度強化,較正常胰腺實質密度低,囊性部分無強化[4,5]。③根據病理學結果進行診斷:病理檢查可見典型的假乳頭狀結構,免疫組化可見核β-Catenin、Vimentin、AAT、ACT、CD10 陽性率高。與其他胰腺囊性腫物鑒別:①胰腺神經內分泌腫瘤:二者鏡下表現相似,多依賴免疫組化鑒別,多表達CgA,Vimentin、核β-Catenin 多陰性;②胰腺漿液性囊腺瘤:為漿液性腫瘤,僅具有微小惡性潛能,鏡下可有蜂窩狀外觀,表現為許多小的、分裂的囊腫,也可表現為大囊性的腫瘤,來源于上皮,多CK 陽性而Vimentin 陰性;③胰腺腺泡細胞癌:SPN 可有類似此病變的腺泡樣的鏡下表現,可通過免疫組化鑒別,此類疾病多CK陽性而Vimentin 陰性;④其他良性囊性病變及淋巴上皮囊腫:此類病變臨床更加少見,多來源于發育不全的內襯的鱗狀上皮細胞與淋巴細胞,無發育異常及惡性潛能。
目前,無論兒童還是成人SPN 患者,首選治療方法是手術切除[6],由于這些是低度惡性腫瘤,特別是被纖維囊所包圍,故有學者主張對病變進行簡單的去核[4]。盡管如此,腹腔鏡胰十二指腸切除術和遠端胰腺切除術仍是最常用的手術[7]。具體術式、切除范圍主要根據腫瘤的生長部位、大小、手術次數及術中對良、惡性的判斷(有無浸潤生長、包膜是否完整、有無遠處轉移)而定。有文獻報道術中冷凍病理檢查誤診率約為12.2%,但無誤診為胰腺癌的病例,所以病理可作為術中鑒別SPN 與胰腺癌并確定手術方式的常規手段[8]。本研究45 例行手術治療的患者經過8~43 個月隨訪,2 例腫瘤復發帶瘤生存,余患者均未見復發。
目前的研究證實了SPN 在女性人群中高發,同時盡管SPN 很少見,但它是目前40 歲以下女性胰腺切除患者中最常見的病理學表現,有特殊的免疫組化表型。絕大多數患者經手術治療后均有更好的預后,同時手術前已有轉移、鄰近器官或血管的侵襲、大塊腫塊(直徑≥13cm)、年輕患者、腫瘤破裂和切除不足都是腫瘤的復發因素。但是,由于復發很少,因此無法確定與復發相關的風險因素。因此,有惡性潛能的患者需要密切隨訪,復發患者需要積極管理,如果進行積極的手術切除或介入治療(如肝臟轉移灶射頻消融手術),即使復發,患者也能獲得較好的預后。

