環狀RNA在胃癌中的研究進展
曹博,丁麗華,衛勃
1.解放軍總醫院第一醫學中心 普通外科,北京100853;2.軍事科學院 軍事醫學研究院 生物工程研究所,北京100850
胃癌是世界范圍內最常見的惡性腫瘤之一,發病率居世界第四,腫瘤相關死亡率位居世界第五[1]。我國是胃癌的“重災區”,發病率、死亡率居高不下[2]。由于我國醫療資源分布不均衡,胃癌早期篩查普及率低,多數患者就診時已處于進展期,手術治療難以實現根治,轉移率高,預后差。特別是由于飲食結構改變及社會壓力增加,近年來胃癌發病呈現出年輕化的傾向,并且青年患者腫瘤具有侵襲性強、體積大、分化程度低等惡性生物學特點[3]。胃癌作為具有鮮明地域特色的惡性腫瘤,給患者帶來極大的精神和身體負擔,嚴重制約我國經濟和社會發展。因此,挖掘具有高度臨床價值的早期診斷標志物、預后判斷參考值和個體化治療靶點迫在眉睫。
環狀RNA(circular RNA,circRNA)是非編碼RNA 家族的重要成員。與傳統線性RNA的5'、3'端結構不同,circRNA 呈現連續的共價閉合環狀。1976年,Kolakofsky 首次在植物病毒內探測到circRNA[4],1979年Hsu 等在真核細胞中也發現了circRNA[5],其后相當長的時間,circRNA 一直被認為是基因表達的“噪音”,不具備生理功能[6-7]。隨著分子生物學技術的快速發展,circRNA的調控能力被逐漸揭示,對其產生機制的探索也有長足進步。Jeck 等利用高通量測序、生物信息學分析等技術,提出了circRNA 產生的2種方式,即套索驅動的環化模型和內含子配對驅動的環化模型[8]。這一報道為剖析circRNA的來源與功能研究奠定了堅實的基礎。研究證明,多系統疾病的發生和進展與circRNA 異常表達密不可分[9-11]。胃癌與circRNA的關系研究作為新興的熱點,近年來出現“井噴式”增長,臨床轉化潛力不可估量。
1 circRNA 簡介
1.1 circRNA的生物學功能
circRNA的生物學調節功能可歸為4 類:作為“分子海綿”與microRNA(miRNA)互補結合,抑制其生物學功能[12-13];與RNA 結合蛋白(RNA bind?ing protein,RBP)相互作用,影響RBP的相關信號通路[14];在細胞核內與RNA 聚合酶結合,順式調控親本基因轉錄[15];作為模板直接編碼蛋白[16]。目前主要的研究熱點集中于circRNA的“分子海綿”吸附功能,極大地豐富了RNA 調控網絡。除單個circRNA的機制研究以外,基于生物信息技術的疾病circRNA-miRNA調控網絡也在如火如荼地構建中[17-19],為后續關鍵性circRNA的篩選提供理論支撐。編碼功能的發現顛覆了科學界對于非編碼RNA的傳統認知。新近發現,胃癌細胞系內circFNDC3B 存在開放讀框,表達25kD的肽鏈[20],這提示circRNA的生物學調節方式不僅局限于轉錄后水平調節,大量未知功能有待探索。
1.2 circRNA的特點
circRNA的生物學特性如下:①穩定性。反向拼接而成的連續、閉合環狀結構使circRNA 對RNA 核酸外切酶的降解不敏感[21]。circRNA 穩定存在于多種極端環境,如尿液、胃液中,是臨床非侵襲性診斷方式的適宜標志物。②半衰期長。circRNA的半衰期通常大于48 h[6,8],探測結果穩定,具有參考性。③保守性。真核細胞circRNA具有高度保守的位點[22],極大提升了穩定干擾疾病相關circRNA表達水平的可行性。所以,憑借結構和功能的獨特優勢,circRNA在胃癌的臨床診治中具有極大的潛力。
2 circRNA與胃癌診斷
circRNA在胃癌細胞和正常細胞內的含量均相對較高,某些circRNA與線性RNA 亞型水平相當,甚至與其線性mRNA 相比可升高10倍以上。所以,circRNA在病理組織內的表達差異具有可探測性,尤其是隨著微滴式數字PCR 等新式技術的出現,某些極端環境下的痕量circRNA 也能實現精準探測。性狀的穩定性、表達的差異性、探測的可行性均賦予circRNA 高度的臨床診斷潛力。近年來,許多課題組對胃癌及癌旁組織的表達譜進行了比對分析,篩選出一批差異顯著的circRNA,如circ_101504、circ_0026 等[23-24],為后續推動臨床診斷應用提供了理論依據。一項Meta分析匯總了11 項有關胃癌組織和血液circRNA的診斷研究,綜合曲線下面積(area under curve,AUC)達0.81,綜合靈敏度和特異度均大于0.7[25],提示circRNA 具有出色的胃癌診斷轉化潛力。
2.1 胃癌組織的circRNA
大部分研究集中于胃癌組織內circRNA表達水平的探測及其臨床診斷意義的解析,效能判斷仍然沿用經典的靈敏度、特異度及AUC 比較。表達差異較大的circRNA 集中位于chr1、chr2、chr3、chr9和chr17[26],提示此類染色體相關基因可能在胃癌的發生和進展中存在機制關聯。目前胃癌組織內診斷價值最高的circRNA 為circ_0001017,其在胃癌組織內的表達明顯下調。對于區分不典型增生和正常組織方面,circ_0001017的靈敏度和特異度可達79.4%和81.1%,AUC值為0.871[27],是診斷癌前病變的潛在標志物,為胃癌的早期篩查提供了新的思路。Li 等[28]分析了circ_002059的診斷價值,在區分胃癌和正常組織方面,其靈敏度、特異度和AUC值分別為0.81、0.62和0.73。該團隊進一步探測了不同溫度對應不同儲存時間下circ_002059的水平,結果顯示無明顯差異,進一步佐證了circRNA的高度穩定性,可作為理想的胃癌診斷標志物。此外,circ_0003159、circ_0000190 等也被證明是潛在的胃癌診斷靶點[29-30]。
除鑒別異常組織外,許多circRNA與胃癌患者的臨床病理特征具有顯著相關性,可協助臨床醫師正確判斷病情和制定治療方案。胃癌組織內circ_0074362 低表達與淋巴結轉移存在關聯[31],可為術中冰凍病理判斷患者淋巴結受累程度、確定下一步手術方案提供參考。Shao 等[26]發現circ_0014717與多種臨床病理特征顯著相關,包括腫瘤分期、遠處轉移、經典腫瘤標志物表達水平等,提示circ_0014717 具有評估患者病情、提升經典腫瘤標志物診斷效能的潛力。
2.2 血液circRNA
依靠血液腫瘤標志物診斷癌癥是研究熱點之一。采集血液樣本的方式溫和,屬于非侵襲性手段,患者接受度較高,適宜用于癌癥的早期診斷和術后病情監測。目前臨床常見的血液腫瘤標志物包括CEA、CA19-9、CA12-5 等[32],但是其種類冗雜,靈敏度和特異度均不理想,當各項指標變化趨勢不一致時,臨床醫師很難根據結果進行正確判讀,無法滿足胃癌早期診斷和病情檢測的臨床需求,故亟待探索新型腫瘤標志物。
circRNA 作為一種穩定性高、半衰期長的明星分子,有望成為未來具有高度診斷價值的胃癌標志物。文獻表明,血液circRNA的臨床診斷價值高于經典血液腫瘤標志物,甚至優于同類組織circRNA。Sun 等[33]分析了circ_0000520在血液中的診斷價值。結果顯示,其靈敏度、特異度、AUC為0.8967、0.8235、0.8444,顯著高于CEA、CA19-9等標志物。Huang 等[34]報道血液circ_0000745 探測靈敏度達0.855,但特異度相對較差,這可能是由于circRNA在人體各組織內廣泛表達,circRNA的高水平背景干擾了對于胃癌特異性circ_0000745的探測。構建circRNA 分子診斷組也是研究方向之一,Li 等[27]將組織和血液內的circ_0001017和circ_0061276 作為診斷組,靈敏度、特異度高達0.955和0.957,明顯高于各自分子的診斷效能,有效彌補了單一circRNA的診斷劣勢。
2.3 胃液circRNA
由于其時空特異性,胃液成分分析在理論上具有非常高的臨床轉化價值,但極端pH值的外環境致使大部分腫瘤標志物無法穩定存在,不具備充分探測條件。隨著新式分子生物學技術的發展,circRNA 憑借獨特的生物學性質在胃液診斷中嶄露頭角。慢性萎縮性胃炎是癌前病變之一,由于其癥狀和病理的不典型,是臨床鑒別的難點。Shao 等[26]發現胃液circ_0014717在鑒別慢性萎縮性胃炎和胃潰瘍、正常組織方面具有顯著意義,這提示積極推進胃液circRNA的臨床診斷轉化有助于提高胃癌的早期診斷和預防干預。
3 circRNA與胃癌預后判斷
胃癌患者預后判斷是臨床診治的重要一環,對預測生存時間、規避過度醫療、緩解醫患糾紛意義重大。臨床采用的預后判斷方式主要是病理分期和患者生存質量,無法實現精準預測。預后判斷效果主要依靠生存分析(Kaplan-Meier 法)進行評價,并利用單因素和多因素分析法剖析某項因素對生存期的影響。新近研究證明,多種circRNA 可作為胃癌患者的獨立預后因子,與患者生存時間具有密切聯系,如circ_100269、circ_0001017和circ_0061276[27,35]。Zhang 等[36]報道circ_101057表達水平對早期胃癌患者的預后具有顯著指示意義。高水平circ_101057的早期胃癌患者總生存期(overall survival,OS)更長,對奧沙利鉑和5-氟尿嘧啶的化療更敏感,顯示circRNA在胃癌患者生存預測和化療方案指導方面有重要作用。Chen 等[37]發現聯合檢測circPVT1和PVT1 mRNA的表達可提升單一標志物的預測效能。與胃癌診斷相同,circRNA 分子也是未來預后判斷的發展方向。但需要注意的是,盲目累加cir?cRNA 僅會提高臨床醫師的判斷難度,增加醫療成本。如何挑選具有高判讀價值的circRNA 并將其有機組合,也是轉化過程中的難點之一。
4 circRNA與胃癌治療
研究顯示,circRNA 是胃癌發生發展和命運轉歸的重要調節者,干擾circRNA在胃癌細胞中的表達,可有效抑制和逆轉各種惡性生物學行為,證明circRNA在胃癌治療中同樣具有出色的轉化潛力。目前的研究集中于circRNA 作為“分子海綿”吸附下游miRNA調控胃癌的機制拓展。
circNRIP1在胃癌細胞內高表達,后續實驗發現circNRIP1/miR-149-5p/AKT1/mTOR 通路在胃癌的生長和侵襲中具有重要作用。文獻證明,AKT1/mTOR與胃癌細胞的上皮間質轉化(epitheli?al-mesenchymal transition,EMT)、抗凋亡和多藥耐藥存在機制關聯[38]。敲低circNRIP1 可以在體內、外水平抑制腫瘤的生長、增殖和轉移,是良好的臨床治療靶點[39-40]。FOXO3 是叉頭框轉錄因子家族的重要成員,在多種腫瘤中扮演著抑癌因子的角色[41]。Lu 等證明circ_0001368 可以互補吸附miR-6506e5p,解除miR-6506e5p 對FOXO3的抑制作用,遏制胃癌細胞的惡性增殖和轉移能力[42]。除直接調控腫瘤細胞表型外,circRNA 也參與調控腫瘤性惡病質。 ciRS-133 通過miR-133/PRDM16 通路促進胃癌患者白色脂肪向棕色脂肪轉化,提高患者代謝效率和氧耗量,最終導致惡病質。相反,敲低ciRS-133 可以有效降低小鼠胃癌模型的氧耗量和產熱能力[43]。ciRS-133 抑制劑有望成為胃癌晚期患者治療的輔助用藥,延長患者生存期,改善生存質量。
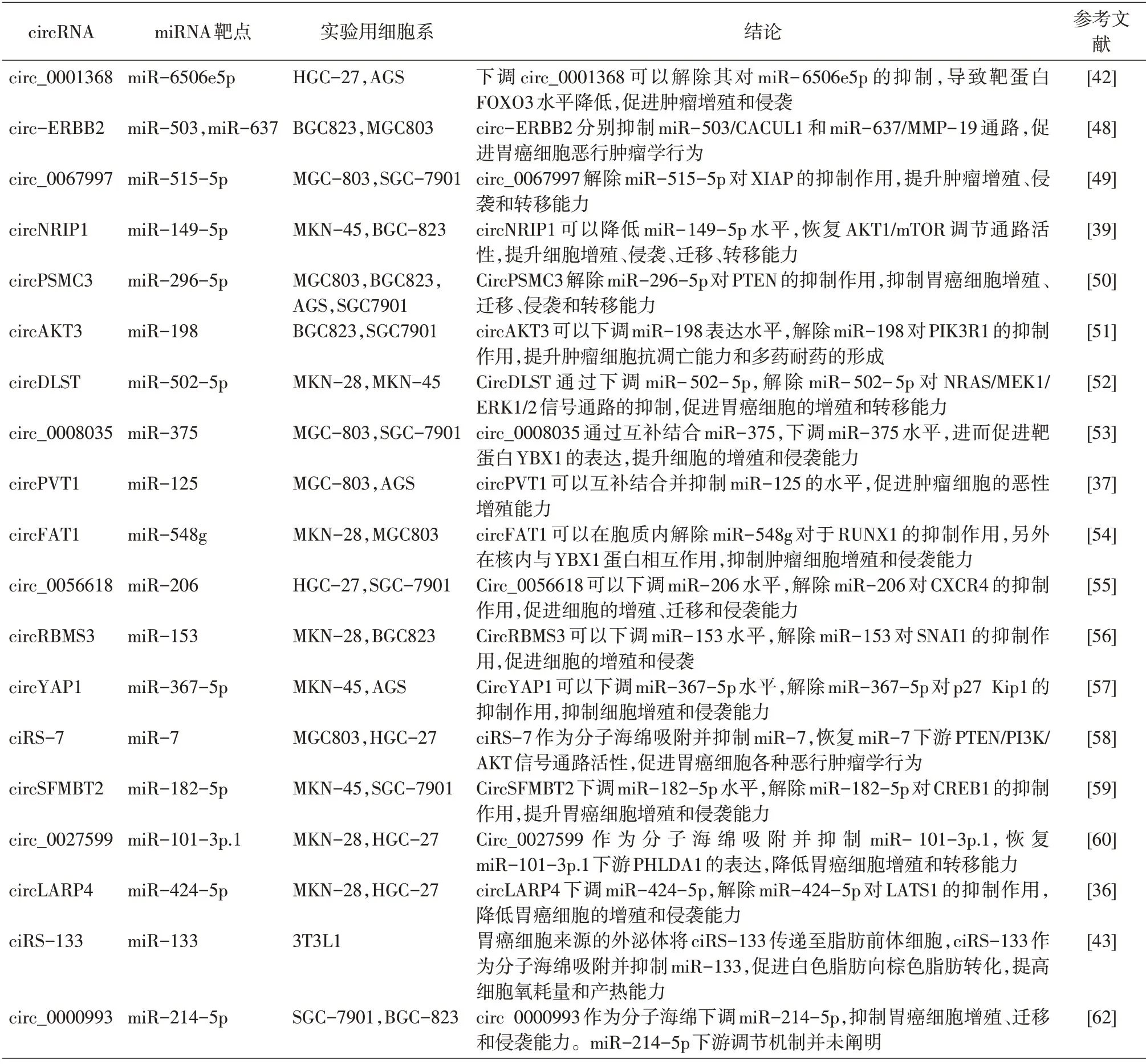
表1 胃癌circRNA作為microRNA“分子海綿”的機制總結
Liu 等[44]創新了以人造小分子干擾方式調節circRNA表達水平的思路。大量研究證明,miR-21 是胃癌惡性進展的參與者之一[45-47]。該團隊利用分子生物學手段構建了含有5個miR-21 吸附位點的人造circRNA(scRNA21)。具體方式如下:利用重疊PCR 擴增miR-21 互補結合位點,形成scRNA21的基本功能單位;擴增產物連接至含有T7 啟動子的環狀質粒;單酶切質粒,變為線性結構;利用T7 RNA 聚合酶大量擴增功能單位;磷酸酶去除5'端磷酸化;T4 多核苷酸激酶使RNA 分子具備穩定連接能力;T4 連接酶使線性RNA 成環。scRNA21 通過抑制miR-21 降低細胞增殖,誘導細胞凋亡,Western 印跡顯示其下游抑癌蛋白DAXX表達上調,以上結果證明基于circRNA 結構的miR-21 抑制劑構建成功。人造circRNA 可以靈活調節miRNA抑制效率,精準性高,兼顧安全性和有效性,與RNA 干擾一同作為胃癌相關miRNA的干預方式,也是未來胃癌治療的發展方向之一。
5 結語
circRNA 具有穩定性、特異性、保守性等優勢,是近年基礎和臨床研究的明星分子之一,促進了胃癌早期診斷、病情監測、預后判斷、個體化治療的發展步伐。尤其是胃液circRNA的發現和人造circRNA的構建,極大地拓展了胃癌診治的新思維。但是circRNA與胃癌的關系探索仍處于初級階段,尚無法達到臨床應用的基本要求。相信隨著生物探測技術的逐步優化,胃癌發生發展和惡性轉歸的機制將逐漸闡明,circRNA 將成為胃癌臨床診治中的重要一環。

