沙門菌實時熒光定量PCR快速檢測方法的建立
田賽,郭衛光,包仁龍,向瑩,張浩然,楊超杰,謝靖,劉鴻博,宋宏彬,邱少富,杜昕穎
中國人民解放軍疾病預防控制中心,北京100071
沙門菌是一種革蘭陰性菌,屬腸桿菌科,是常見的食源性腸道致病菌[1]。食用受污染的生肉、家禽、蛋類、乳制品等可使人發生食物中毒,由致病性沙門菌引起的人類疾病通常被稱為沙門菌病[2]。沙門菌病對全球特別是發展中國家的公共衛生構成嚴重威脅,在中國沙門菌病占食源性疾病的40%~60%[3]。因此,快速、準確地檢測沙門菌對沙門菌病的有效防治是十分必要的。沙門菌鑒定的傳統方法主要根據形態學特征、培養特征、生理生化特征、抗原特征、噬菌體特征等。細菌培養是鑒定腸道致病菌的金標準,但這一過程耗時較長,需3~5 d[4-5]。基于抗原和噬菌體檢測法只能針對活細菌,敏感性較低,容易出現假陰性情況,特異性差[6]。與傳統方法相比,基于核酸特異性序列分子方法的實時熒光定量PCR 具有快速、敏感、特異且穩定的優點。我們根據沙門菌特異的外膜孔蛋白F基因(ompF)[7]的特異性序列設計合成引物及TaqMan 探針,建立了可快速檢測沙門菌的實時熒光定量PCR 法。
1 材料與方法
1.1 材料
甲型副傷寒沙門菌,乙型副傷寒沙門菌,丙型副傷寒沙門菌,豬霍亂沙門菌,鼠傷寒沙門菌,腸炎沙門菌,旺茲沃思沙門菌,亞利桑納沙門菌,湯卜遜沙門菌,痢疾志賀菌,弗氏志賀菌,宋內志賀菌,鮑氏志賀菌,副溶血弧菌,霍亂弧菌,大腸埃希菌EAEC、EPEC、ETEC、STEC,均為解放軍疾病預防控制中心實驗室保存。
基因組DNA 提取試劑盒和質粒提取試劑盒購自天根生化科技有限公司;2×GoldStar Best MasterMix和ddH2O 購自康為世紀生物科技有限公司;沙門菌檢測試劑盒(探針法)購自卓誠惠生生物科技股份有限公司(XABT);Eppendorf 5424 離心機;BAIYANG 400C 離心機;DeNovix DS-11 FX超微量紫外熒光分光光度計;Molecular Devices SpectraMax i3x酶標儀;BIO-RAD CFX96熒光定量PCR儀。
1.2 引物與TaqMan 探針的設計與合成
根據GenBank 中沙門菌ompF基因的保守序列,用Primer Express 3.0 軟件設計引物和探針。上游引物為5'-CCTGGCAGCGGTGATCC-3',下游引物為5'-AAATTTCTGCTGCGTTTGCG-3',探針為FAM-TGCCCTGCTGGCTGCTGCA-BHQ1,由上海生工生物工程股份有限公司合成。
1.3 模板的制備
采用DNA 提取試劑盒提取和熱變性法2種方法制備DNA 模板。用天根生物公司的DNA 提取試劑盒提取細菌的基因組DNA,提取方法參照說明書,用DeNovix 超微量紫外熒光分光光度計測定DNA的濃度和純度。熱變性制備DNA 模板的方法參照文獻[8]。
1.4 質粒標準品的制備
以沙門菌基因組DNA 為模板,用ompF基因的上下游引物Blast 相應基因序列,采用生工生物公司基因合成技術連接到pUC57 載體上,合成對應甘油菌。菌液用含氨芐青霉素的培養基于37℃過夜培養,用天根生物公司的質粒提取試劑盒提取重組質粒。用DeNovix 超微量紫外熒光分光光度計測定質粒濃度后用ddH2O 對質粒進行1/10 梯度稀釋,濃度為1.0×100~1.0×10-8ng/μL。
1.5 熒光定量PCR 反應體系的建立
熒光定量PCR 反應體系為25 μL,包括2×GoldStar Best MasterMix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,探針(10 μmol/L)1 μL,模板2 μL,ddH2O 7.5 μL。用BIO-RAD CFX96 熒光定量PCR 儀按如下程序進行擴增:95℃預變性10 min;95℃15 s,60℃40 s,擴增40個循環,每個循環延伸結束時(60℃)進行熒光信號檢測。熒光通道選擇FAM。
1.6 熒光定量PCR檢測方法的特異性
以前述9種不同血清型沙門菌和10種其他腸道致病菌的基因組DNA 為模板,用上述熒光定量PCR 反應體系進行擴增,驗證方法的特異性。
1.7 熒光定量PCR檢測方法的敏感性
以2 μL 梯度稀釋的質粒為模板進行熒光定量PCR 擴增,用Excel 軟件分析模板濃度與Ct值之間的關系,以質粒濃度的對數值為橫坐標、Ct值為縱坐標繪制標準曲線,通過趨勢線和相關系數對實時熒光TaqMan PCR檢測體系的檢測敏感性進行評價。
以甲型副傷寒沙門菌為陽性對照,制備菌懸液,用SpectraMax i3x 酶標儀測定D600nm值,取培養好的沙門菌菌液100 μL 用PBS 對菌液進行1/10梯度稀釋,將稀釋液涂布在培養基上,37℃培養24 h后進行菌落計數,計算菌液濃度,選擇濃度100~106CFU/mL的菌液,用天根生物公司的DNA提取試劑盒提取細菌基因組DNA,以2 μL 梯度提取的基因組DNA 為模板進行熒光定量PCR 擴增,根據檢出Ct值和基因組DNA 對應菌量濃度的對數值用Excel 軟件繪制標準曲線,得到趨勢線和相關系數,判斷實時熒光TaqMan PCR檢測體系的檢測敏感性。
1.8 熒光定量PCR檢測方法的重復性
以濃度分別為1.0×10-1、1.0×10-2、1.0×10-3、1.0×10-4、1.0×10-5ng/μL的質粒為模板,進行上述熒光定量PCR 擴增,重復5 次。通過統計學方法分析各組Ct值之間的變異系數(CV),評價實時熒光TaqMan PCR檢測體系的檢測重復性。
提取濃度分別為105、104、103、102CFU/mL的菌液基因組DNA,以此為模板進行熒光定量PCR擴增,重復5 次。記錄各組Ct值并進行統計學分析得到CV,評價實時熒光TaqMan PCR檢測體系的檢測重復性。
1.9 熒光定量PCR檢測方法的臨床應用

圖1 特異性實驗結果
采用天根生物公司的DNA 提取試劑盒提取實驗室采集的海鮮樣本消化腺基因組DNA,分別利用建立的沙門菌TaqMan 實時熒光定量PCR 法及卓誠惠生沙門菌檢測試劑盒(探針法)對基因組DNA 進行檢測,統計比較二者最終沙門菌陽性檢出率。
2 結果
2.1 反應特異性
采用熒光定量PCR 方法擴增陽性對照質粒、沙門菌及10種相關腸道病原菌的基因組DNA,結果見圖1。陽性質粒和沙門菌基因組DNA 擴增后呈S 型擴增曲線,其他病原基因組DNA 及陰性對照均沒有擴增,說明建立的熒光定量PCR檢測方法具有非常高的特異性。
2.2 反應敏感性
將陽性質粒1/10 梯度稀釋至濃度依次為1.0×100~1.0×10-8ng/μL,用稀釋后的質粒作為模板進行熒光定量PCR 擴增,結果見圖2。當質粒濃度為1.0×100~1.0×10-7ng/μL 時,Ct值隨濃度降低而增大,表明在該范圍內能準確定量,最低檢出限為0.1 ng/L。根據反應體系中的質粒濃度和擴增的Ct值,計算得到標準曲線y=-3.43x+14.135,相關系數為0.9978(圖3),表明沙門菌基因組DNA的濃度與Ct值相關。
以100~106CFU/mL菌液所提基因組DNA為模板進行熒光定量PCR 擴增,結果見圖4,除100CFU/mL 無擴增曲線外,其他濃度均有擴增曲線,表明反應敏感性為10 CFU/mL。根據反應體系中基因組DNA 對應的菌量濃度和擴增的Ct值,計算得到標準曲線y=-3.2923x+41.425,相關系數為0.987(圖5),表明沙門菌基因組DNA的濃度與Ct值相關。
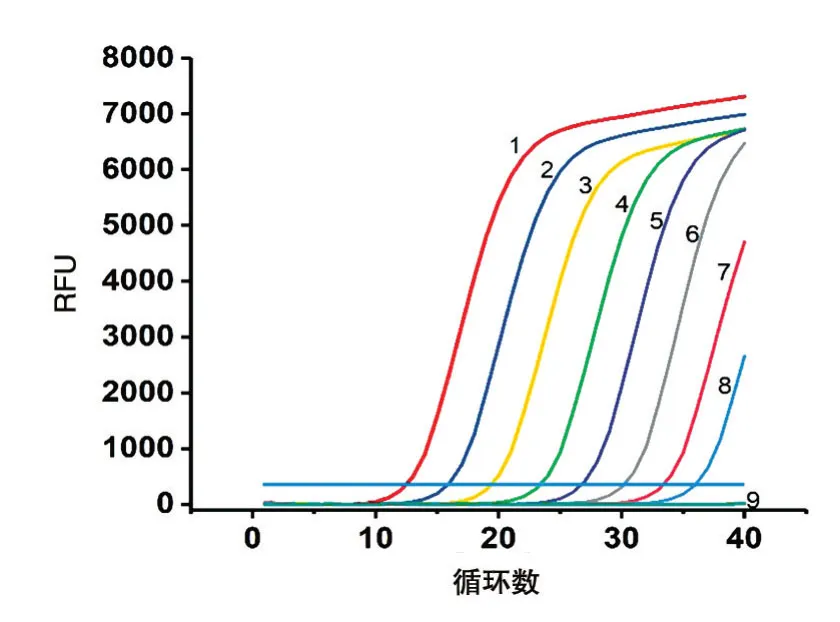
圖2 陽性質粒敏感性實驗結果
2.3 反應重復性
選取1.0×10-1、1.0×10-2、1.0×10-3、1.0×10-4、1.0×10-5ng/μL 共5個濃度的標準品,對建立的反應體系分別進行5 次重復檢測,記錄各組檢測Ct值并計算變異系數,結果見表1。可以看出,這5個濃度熒光定量PCR檢測Ct值的變異系數均小于0.6%,說明建立的檢測方法重復性極高。
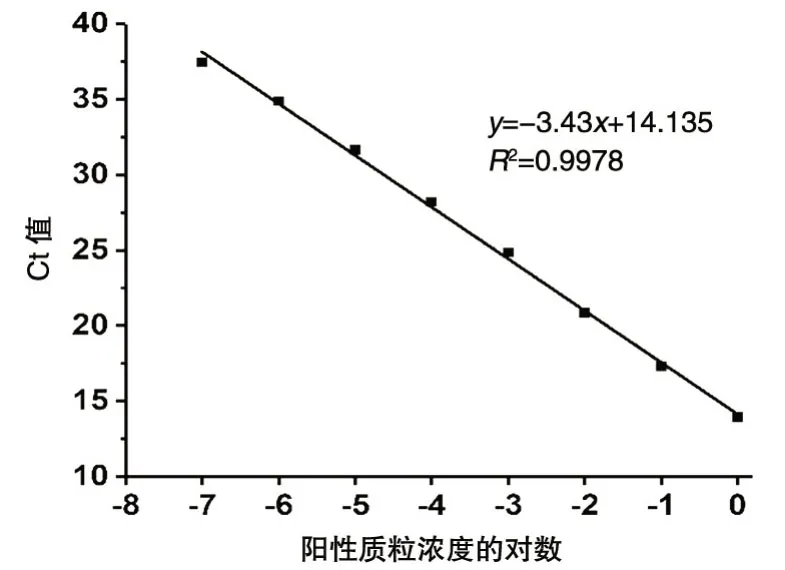
圖3 陽性質粒實時熒光定量PCR檢測標準曲線
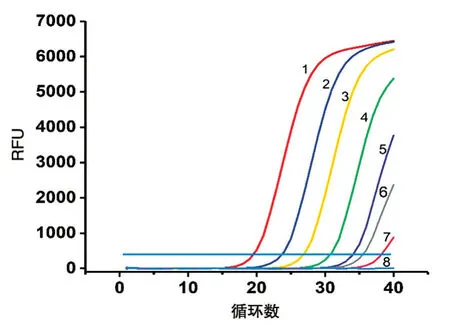
圖4 菌株樣本敏感性實驗結果

圖5 菌株樣本實時熒光定量PCR檢測標準曲線
選取菌液濃度為105、104、103、102CFU/mL 共4個濃度提取的基因組DNA,對建立的反應體系分別進行5 次重復檢測,并計算Ct值的變異系數,結果見表2。4個濃度熒光定量PCR檢測Ct值的變異系數均小于0.8%,可以看出建立的檢測方法重復性極高。
2.4 實際樣本的檢測
2019年7月本實驗室共接收海鮮樣本50 份,對海鮮樣本消化腺及人糞便樣本進行前處理后,采用天根生物公司的DNA 提取試劑盒提取基因組DNA,利用建立的沙門菌TaqMan 實時熒光定量PCR 法對基因組DNA 進行快速檢測,最終檢出沙門菌陽性19 份(38.0%)。用卓誠惠生沙門菌檢測試劑盒(探針法)對基因組DNA 進行檢測,最終檢出沙門菌陽性19 份(38.0%)。對比發現建立的沙門菌TaqMan 實時熒光定量PCR 法與卓誠惠生沙門菌檢測試劑盒對沙門菌檢出陽性率相同,說明建立的檢測方法可以用于臨床應用。
3 討論
沙門菌為革蘭陰性腸道桿菌,是一種侵襲性細菌,能夠進入多種宿主細胞,包括回腸黏膜上皮細胞、巨噬細胞以及網狀內皮系統的其他細胞和組織[9],作為一種人類致病菌每年都會導致大量死亡和嚴重疾病病例,在全世界被廣泛關注。沙門菌通常通過糞口途徑感染個體,動物或動物制品是最常見的感染源,新鮮農產品等間接受沙門菌污染的食品也會導致大量病例。由致病性沙門菌引起的疾病癥狀包括水樣腹瀉、惡心、腹痛、發燒和頭痛,在某些情況下能侵入人體成為系統性疾病[2]。老年人、極年幼者和免疫功能低下者發生并發癥和死亡的風險更高。因此,快速、準確地檢測沙門菌,對臨床疾病的有效治療、防止疾病的傳播以及食品安全的保障具有重要意義。
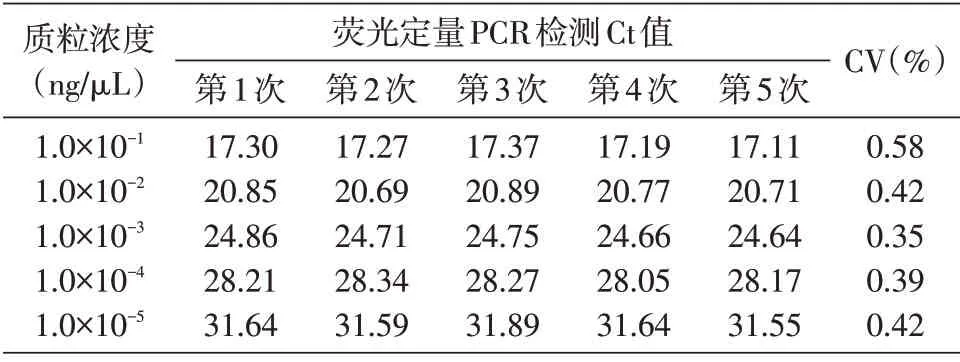
表1 陽性質粒重復性檢測結果
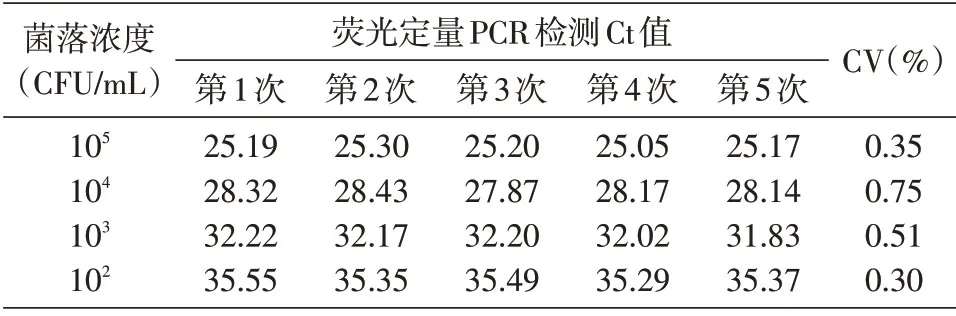
表2 菌株樣本重復性檢測結果
實時熒光定量PCR 是一種以PCR 為基礎建立的新技術,該技術擴增與檢測分析同時進行,具有快速、敏感、特異等優點[10-11]。之前Gallegos-Robles 等[12]將invA基因用于沙門菌的實時熒光定量PCR檢測。但由于invA基因是通過水平基因轉移獲得的SPI1 上的毒力基因,在沙門菌某些血清型中可能存在該基因不穩定或缺失的情況[13]。因此,利用實時熒光定量PCR 技術對沙門菌進行快速分子檢測,除了利用invA基因外,還應考慮其他靶點。研究表明靶點ompF為所有血清型沙門菌都具有的外膜孔蛋白基因[7],經在GenBank 中Blast 搜索發現,與ompF基因高度同源的序列只有沙門菌,表明ompF基因針對沙門菌具有覆蓋度高、特異性強的優點。我們選用該基因的特異性序列設計了引物和TaqMan 探針,利用pUC57 載體構建了重組陽性質粒。確定PCR 反應體系及反應條件后,同時對沙門菌陽性質粒、9種不同型別的沙門菌,以及10種其他不含沙門菌的腸道病原菌基因組DNA 進行了擴增檢測,最終所有沙門菌及其陽性質粒呈S 型擴增曲線,其他細菌沒有擴增,充分證明建立的沙門菌實時熒光定量Taq?Man PCR檢測方法具有高度特異性和覆蓋性。利用該方法分別對1/10 梯度稀釋的1.0×100~1.0×10-8ng/μL 范圍內的陽性質粒和100~106CFU/mL范圍內的沙門菌基因組DNA 進行了敏感性檢測及重復實驗,最終檢測靈敏度分別為1.0×10-7ng/μL和101CFU/mL,而且2種擴增曲線與對應模板濃度都呈很好的線性關系,重復實驗的Ct值變異系數也都低于0.8%。2013年杜雄偉等[14]建立的肉制品中沙門菌invA基因實時熒光定量PCR檢測方法的靈敏度為101CFU/mL,重復實驗的Ct值變異系數為0.96%。與其對比,2種方法的檢測靈敏度一致,但我們建立的方法Ct值變異系數更低,充分證明了此次建立的方法具有靈敏度高、穩定性好的特點。利用建立的方法與卓誠惠生沙門菌檢測試劑盒分別對實驗室50 份實際海鮮樣本中沙門菌進行檢測,最終2種檢測方法的陽性檢出率都為38.0%,說明建立的方法可有效應用于臨床檢測、食品安全監測等領域。
綜上所述,本工作建立了沙門菌TaqMan 實時熒光定量PCR檢測方法,該方法具有特異性強、靈敏度高、穩定性好、方便快捷等優點,同時我們也已經將該方法應用于實驗室日常保障檢測任務中,對沙門菌疫情防治具有重要意義。

