肺腺癌增強子調控miRNA前饋環路的識別與功能分析
李志學,梁子涵,賈承霖,漆宇騁,岳俊杰,郭志云
1.西南交通大學 生命科學與工程學院,四川 成都610031;2.軍事科學院 軍事醫學研究院 生物工程研究所,北京100071
肺癌在世界范圍的發病率和致死率都高居各類癌癥之首,分別達11.6%和18.4%[1]。肺癌分為小細胞癌和非小細胞癌,非小細胞癌又分為鱗狀細胞癌、腺細胞癌等亞型,其中肺腺癌最為常見。肺腺癌治療方法主要包括手術、放療、化療和靶向治療,但僅靠這些療法還無法保證徹底治愈[2]。因此,關于肺腺癌發生發展分子機制及調控機理的研究,仍是學術界關注的熱點。
在人類進化演變的過程中,形成了紛繁復雜又高度有序的基因網絡調控結構,它們由一定的模序(motif)元件所構成,在生物體內發揮著重要的基因調節作用[3]。其中,前饋環路(feed-for?ward loops,FFLs)是一種重要的循環線性模序,它由2個輸入調節因子P1和P2,以及1個輸出因子P3 構成。P1 可以調節P2,也可以與P2 共同調節P3,即P3 所受到的網絡調節的影響是P1、P2 元件綜合作用的結果。
增強子是真核細胞中普遍存在的順式調控元件,可以通過招募轉錄因子(transcription fac?tor,TF),進而結合多種激活因子,形成多蛋白復合物,使染色質成環,遠端調控啟動子。通過對增強子染色質的修飾和重塑等作用,促進基因的轉錄[4]。此外,較多證據表明,增強子與microRNA(miRNA)間同樣存在復雜的調控關系。Xiao 等[5]通過刪除HEK293T細胞系中的miR-24-1 增強子基因座,發現miR-24-1的表達量下降,其鄰近基因不能再被激活,表明miR-24-1 鄰近基因的轉錄激活依賴于完整增強子的存在。此外,miR-24-1可激活增強子RNA(eRNA)表達,改變組蛋白修飾,增加增強子位點p300和RNA PolⅡ的富集,從而激活轉錄。Suzuki 等證明增強子可以通過募集Drosha和DGCR8 這2個在miRNA初始轉錄本(primary miRNA,pri-miRNA)剪接過程中發揮重要作用的蛋白,調控成熟的miRNA在細胞中的水平,進而影響基因的表達[6]。目前,關于肺腺癌前饋環路的研究,多集中于miRNA-TF-基因所形成的調控網絡,而增強子在該調控網絡中發揮什么樣的作用、如何發揮作用,還不夠清晰。
考慮到前饋環路模型的多樣性和靈活性,我們在此將其引入肺腺癌分子機制的研究,通過數據篩選和處理,期望進一步了解在肺癌腺產生過程中,增強子、轉錄因子、miRNA、基因之間存在的調控關系。綜合多組學數據,本研究構建了TF-增強子-miRNA的前饋環路,并探討該前饋環路的功能,為探究肺腺癌發生的分子機制及其調控機理提供新的思路,也為以網絡標志物為主的肺腺癌診斷提供理論依據。
1 材料與方法
1.1 肺腺癌增強子數據的獲取
增強子數據下載自HACER[7]數據庫。該數據庫通過GRO_seq和PRO_seq 整合FANTOM與其他轉錄非穩定RNA的增強子,是目前最為全面的增強子數據庫。我們從HACER 數據庫下載肺腺癌A549細胞增強子3870個。
1.2 TF-增強子作用關系的識別
從Cistrome DB[8]和Unibind[9]數據庫下載獲取A549細胞系中的97個轉錄因子的Chip-Seq 數據集(.bed 文件),作為轉錄因子與DNA的結合位點信息。當轉錄因子的結合位點包含于同一染色體的增強子區域時,認為該轉錄因子對該增強子具有調控關系。
1.3 增強子-miRNA作用關系的識別
miRNA位置信息下載自miRBase 數據庫[10],miRNA轉錄起始位點數據下載自FANTOM 數據庫,人類蛋白質編碼基因注釋數據下載自GEN?CODE 數據庫。根據先前的增強子調控miRNA研究[11],對每個增強子的上游或下游,分別找到距增強子中心最近的miRNA轉錄起始位點和同側的所有蛋白質編碼基因轉錄起始位點。將增強子中心與miRNA轉錄起始位點間的距離定為M,增強子中心與同方向蛋白質編碼基因轉錄起始位點間的距離定為G。以調控評分公式計算score值,設定score值為0~0.2的增強子與miRNA之間存在調控關系。
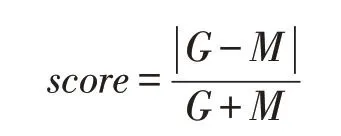
1.4 TF-miRNA作用關系的識別
利用上述獲取的轉錄因子、miRNA數據,如轉錄因子的結合位點包含于miRNA轉錄起始位點上游10 kb 及下游1 kb,認為該轉錄因子對該miRNA具有調控作用[12]。
1.5 TF-增強子-miRNA前饋環路的合并與多重假設檢驗
將上述3 類調控關系進行組合篩選,采用超幾何檢驗獲取非隨機性的前饋環路。公式如下:
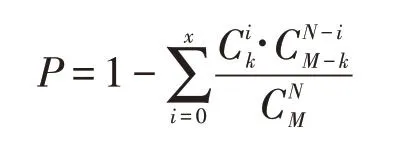
其中,M為miRNA總數,N為某一轉錄因子所調控的miRNA總數,k為某一增強子所調控的miRNA總數,x為該轉錄因子所調控的miRNA與該增強子所調控的miRNA的交集。依據Benjamini-Ho?chberge[13]方法,利用FDR值對該超幾何檢驗的概率值進行修正,并計算q值,將q≤0.05的前饋環路作為有生物學意義的前饋環路。
1.6 在前饋環路中提取關鍵性miRNA
miRNA都能夠對基因表達起調控作用,從構建的TF-增強子-miRNA前饋環路中選擇參與多個前饋環路的miRNA,獲取參與前饋環路的每個miRNA的表達量,將miRNA高于平均miRNA表達的作為前饋環路關鍵性的miRNA。前饋環路關鍵性miRNA表達量下載自FANTOM5 數據庫[14]。
1.7 前饋環路關鍵性miRNA的靶基因識別與富集分析
從mirTarBase[15]數據庫下載經實驗證實的miRNA靶基因,采用R軟件包clusterProfiler 對miRNA靶基因進行Gene Ontology(GO)與KEGG Pathway 功能富集分析。
1.8 前饋環路關鍵性miRNA的靶基因生存分析
利用KMplot[16]生存分析在線工具,選擇TF-增強子-miRNA前饋環路關鍵靶基因進行臨床樣本的生存分析。
2 結果與討論
2.1 轉錄因子、增強子、miRNA作用關系篩選
通過上述數據庫搜索,獲取了97個轉錄因子的DNA 結合位點信息、3870個肺腺癌組織特異性活性增強子區域信息、4801個miRNA的轉錄起始位點信息和80 455個蛋白質編碼基因的轉錄起始位點信息。最終,我們識別了227個TF-增強子作用關系,涉及61個轉錄因子和66個增強子;6973個增強子-miRNA作用關系,涉及3767個 增強子和1262個miRNA;10 715個TF-miRNA作用關系,涉及89個轉錄因子和1367個miRNA。
2.2 肺腺癌前饋環路構建
通過對上述作用關系進行整合,最終共獲得36個肺腺癌TF-增強子-miRNA前饋環路(表1),其中增強子(chr11:355877~356724)參與的前饋環路數目最多,為7個。本研究構建的前饋環路涉及增強子,增強子對miRNA的調控全為正調控,由此構建的前饋環路均為連貫前饋環路[3]。
在這些前饋環路中,平均每個miRNA涉及2.769個轉錄因子,其中大于等于3個轉錄因子的miRNA有hsa-miR-6734、hsa-miR-4677、hsa-miR-6743、hsa-let-7i、hsa-miR-210、hsa-miR-4492、hsa-miR-6760。hsa-miR-210 已被證實與肺癌相關[17]。這些miRNA在肺癌發生發展的過程中可能起關鍵作用,例如調控肺癌相關基因的表達,提高肺癌細胞的轉移性、浸潤性或異質性等。
2.3 肺腺癌前饋環路關鍵miRNA的GO與KEGG功能富集分析
從mirTarBase 數據庫獲取了36個TF-增強子-miRNA前饋環路中miRNA的所有靶基因,共計2404個,利用R 軟件包clusterProfiler 對所有靶基因進行了GO 功能富集。我們發現肺腺癌前饋環路在細胞周期正調控、細胞分化、蛋白質穩定性調控、能量代謝和糖代謝等方面具有重要功能(圖1),這與文獻報道的癌細胞基因功能一致。通過功能富集分析,我們發現了在肺癌細胞中起關鍵作用的多效基因TP53、IGF1、TPR、CREB、CASP3、STAT5B、APP、USP19 等,其中TP53、IGF1、TPR、CREB、CASP3、STAT5B、APP、USP19 已被證實與腫瘤密切相關,如TP53[18]和CREB基因已被證實可顯著影響肺腺癌的增殖。Illiano 等采用脂聯素干預A549 肺腺癌細胞,發現脂聯素可抑制CREB基因表達,顯著降低肺腺癌細胞的增殖[19]。
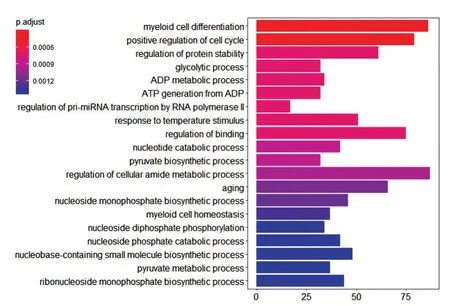
圖1 肺腺癌全前饋環路靶基因GO 功能富集結果
對靶基因進行KEGG 通路富集分析(圖2),發現與肺腺癌前饋環路miRNA靶基因廣泛參與糖代謝、甘氨酸/絲氨酸/蘇氨酸代謝、丙氨酸/天冬氨酸/谷氨酸代謝、半胱氨酸/甲硫氨酸代謝等通路。該結果說明肺腺癌前饋環路在大分子化合物代謝通路中起關鍵作用,該結果與癌細胞生理特征一致,其中涉及的關鍵基因有PGAM1、PGAM4、LDH4、LDHB、AGXT2 等。
為探究上述肺腺癌TF-增強子-miRNA前饋環路關鍵靶基因對肺腺癌患者的影響,我們對其中參與富集功能(≥2個)的多效基因進行生存分析。選擇具有表達活性差異的基因發現,TP53和CREB1在高表達時會使肺腺癌患者的生存率降低,而STAT5B和TPR在低表達時會使肺腺癌患者的生存率降低(圖3)。因此與多效基因TP53、CREB1、STAT5B、TPR 有關的前饋環路可能對肺腺癌的發展、轉移有重要影響。
2.4 肺腺癌前饋環路關鍵miRNA表達特征
依據FAMTOM5 提供的miRNA表達量數據,發現上述6個miRNA中,hsa-let-7i-3p、hsa-miR-210-5p、hsa-miR-6734-5p與hsa-miR-4677-5p在體內的表達量顯著高于前饋環路涉及到的13個miRNA表達量的平均值,暗示這4個miRNA可能是肺腺癌的關鍵性miRNA。其中hsa-miR-6734參與了7個前饋環路,顯著高于表達量平均值2.769,共涉及7個重要的轉錄因子ETS1、GABPA、PBX3、TEAD4、YY1、ZBTB33、DNase。其中的YY1已有文獻報道與腫瘤發生有關[20]。
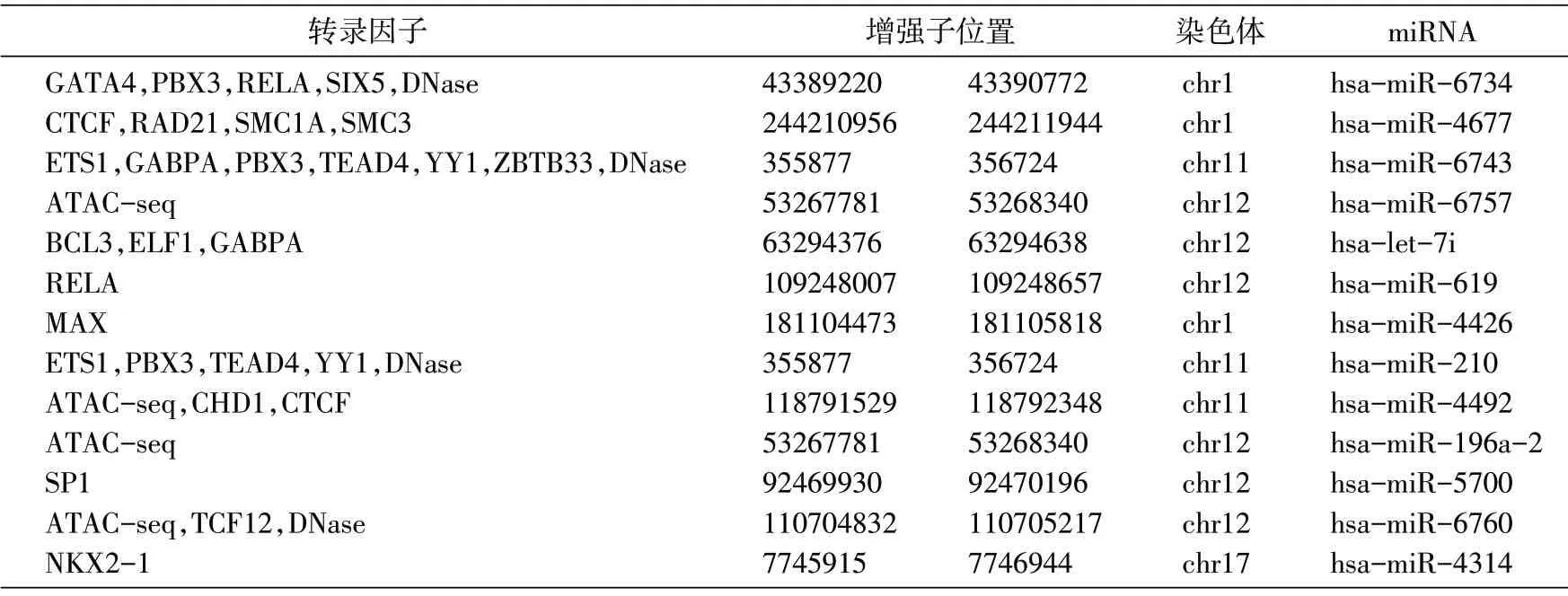
表1 36個肺腺癌TF-增強子-miRNA前饋環路
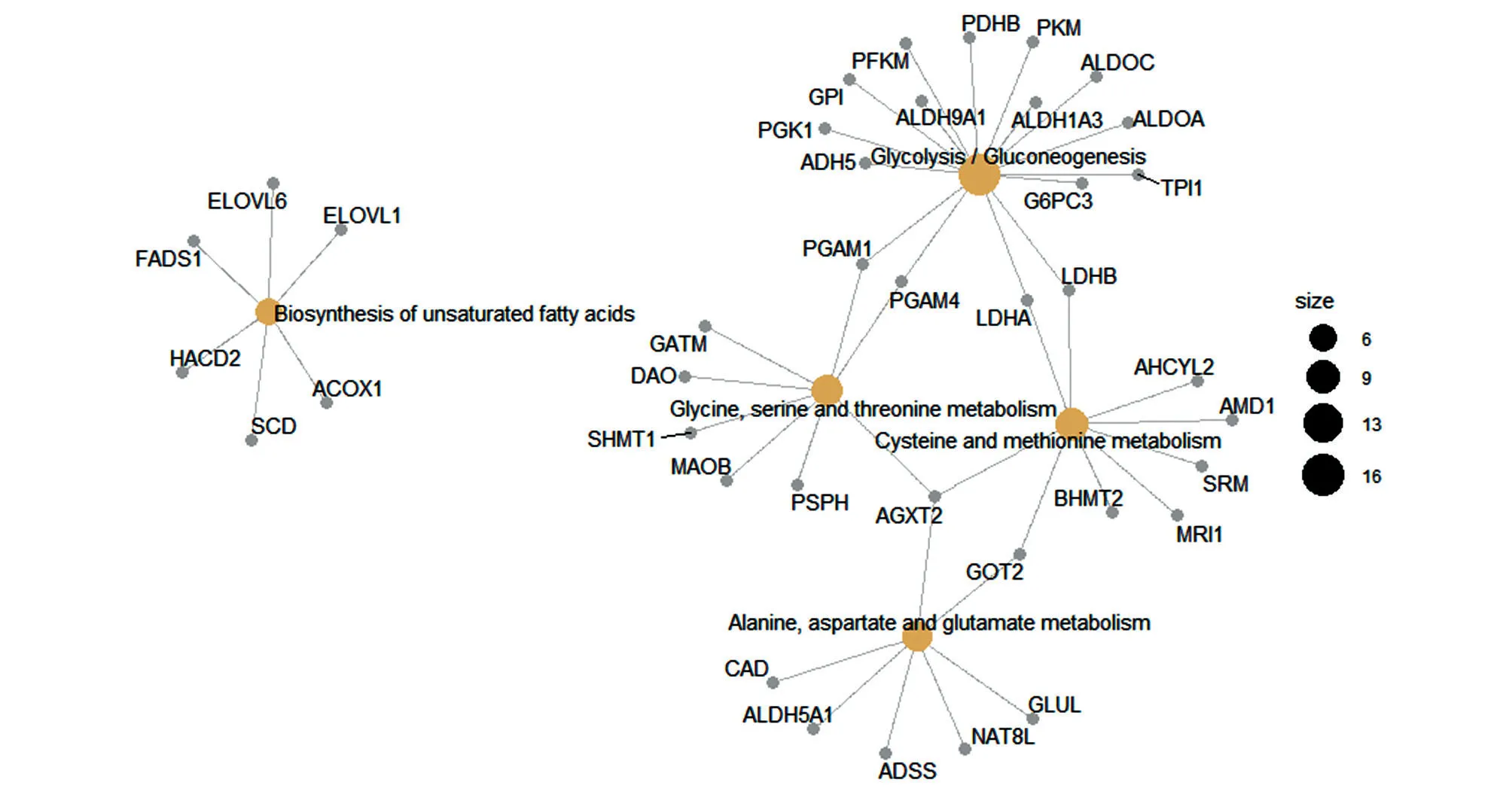
圖2 肺腺癌全前饋環路靶基因KEGG 通路富集結果
2.5 4個關鍵miRNA靶基因功能分析
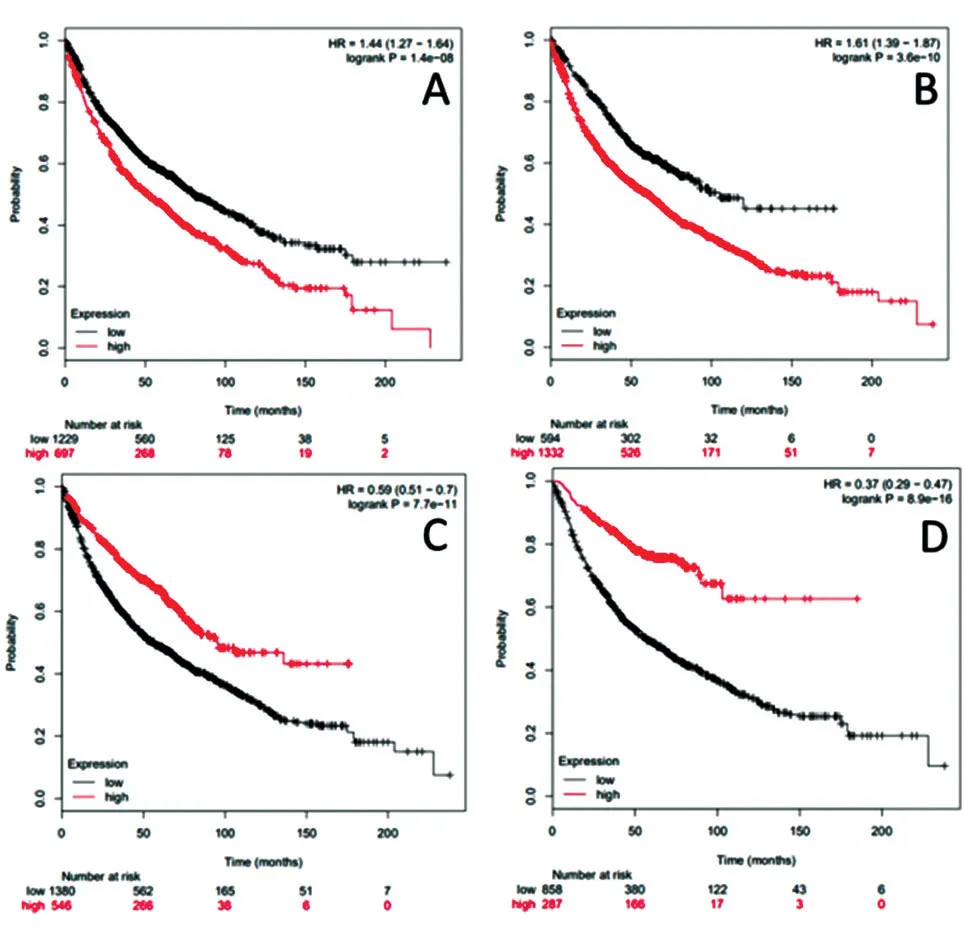
圖3 多效基因TP53(A)、CREB1(B)、
分別對上述4個關鍵miRNA靶基因進行GO功能分析和KEGG 通路分析。一方面我們獲取了這4個關鍵miRNA的功 能活性,hsa-miR-6734 具有強的核酸轉錄抑制活性,hsa-miR-210 具有強的分解代謝活性,hsa-let-7i 具有強的絲氨酸/蘇氨酸激酶活性,而hsa-miR-4677 無明確的富集功能。另一方面,構建4個關鍵miRNA的基因調控網絡,發現hsa-miR-210 調控細胞分解代謝和應激反應功能的關鍵靶基因PLK1、APC、BNIP3、ATG7、SIN3A,hsa-miR-6734 調 控 各 類 復 合 物(NuRD、CHD 類等)功能的關鍵靶基因MTA1、CSNK2A1、RBBP4、ZBTB7A,hsa-let-7i細胞周期正調節功能的關鍵靶基因IGF1、PDGFB、CDKN1A、CCND1、EDN1和CCNT2。
2.6 結論
我們探討了TF-增強子、增強子-miRNA、TFmiRNA作用關系,并識別了肺腺癌細胞系相關的36 條TF-增強子-miRNA前饋環路,涉及22個轉錄因子、13個增強子、13個miRNA。在功能富集和通路富集方面,我們發現肺腺癌細胞TF-增強子-miRNA前饋環路靶基因顯著富集于與癌癥密切相關的生物功能上,如細胞周期正調控、細胞分化、蛋白質穩定性調控、能量代謝和糖代謝等,其中涉及的關鍵基因已被很多研究證實在癌癥細胞中特異表達。KEGG 通路富集結果顯示前饋環路靶基因富集于肺癌代謝相關信號通路。結合miRNA的參與環路數和表達量,我們篩選了前饋環路關鍵miRNAhsa-miR-6734、hsa-miR-210、hsa-miR-4677和hsa-let-7i,探討了它們與基因的調控關系網絡。另外,我們對參與富集功能多的多效基因進行肺腺癌生存分析,發現前饋環路的多效靶基因TP53、CREB1、STAT5B、TPR的表達差異對患者肺癌的生存發展有重要影響。本研究揭示了肺腺癌相關前饋環路的特點,為以后肺腺癌前饋環路研究提供理論與方法參考。

