LncRNA SNHG1對非小細胞肺癌細胞遷移和侵襲的影響研究*
鄧仕華,胡章勇,吳東明,劉 騰,許 穎
成都醫學院第一附屬醫院 檢驗科(成都 610500)
肺癌作為最常見的惡性腫瘤之一,發病率、病死率都高居所有惡性腫瘤之首,分別占11.6%和18.4%[1]。臨床上肺癌又分為非小細胞肺癌(non-small cell lung cancer,NSCLC)和小細胞肺癌,其中NSCLC約占85%。目前,盡管臨床上對肺癌的治療已經取得了十足的進展,但肺癌的預后仍不如人意。肺癌早期臨床癥狀不明顯,導致肺癌患者預后不良的主要原因是肺癌晚期時腫瘤細胞轉移,且缺乏有效的治療措施。
目前關于肺癌轉移的具體分子機制尚未完全闡明。上皮間質轉化(epithelial-mesenchymal transition,EMT)是腫瘤細胞發生轉移的主要過程之一,常常受到多種基因的調節。在正常組織中,EMT與器官的發育、形成、組織的重塑和傷口的愈合有關。在腫瘤細胞發生EMT的過程中,極化的、遷移能力差的上皮細胞獲得高度惡性細胞的特征,特別是運動性、侵襲性和傳播能力[2]。EMT促進腫瘤遷移和侵襲的作用是基于間質標志物的富集(如N-cadherin)和上皮細胞標志物的減少(如E-cadherin)[3]而實現。近年研究[4-5]表明,長鏈非編碼RNA(long non-coding RNA,LncRNA)與包括肺癌在內的多種腫瘤的發生發展密切相關。核仁小分子RNA宿主基因1(small nucleolar RNA host gene 1,SNHG1)是一個LncRNA,在人體組織中廣泛表達,與多種腫瘤的發生發展均有一定關系。已有研究[6-7]表明,SNHG1可通過調控微小RNA(microRNA)而間接促進肺癌細胞的惡性化進展,但具體機制仍未有統一定論。因此,本研究在此基礎上, 進一步探討 SNHG1 在NSCLC細胞遷移和侵襲和中的作用及其可能機制。
1 材料與方法
1.1 材料
人肺腺癌細胞系A549及SPC-A1為本課題組保存。用于蛋白質印跡法相關一抗:β-actin;E-cadherin,N-cadherin,Vimentin及二抗均購自武漢三鷹生物技術有限公司(中國Proteintech公司)。本實驗所用的細胞培養皿、6孔板、24孔板、transwell小室等均購自康寧公司。qRT-PCR所用RNA提取試劑盒購于北京索萊寶生物公司。逆轉錄及擴增試劑盒購于美國Bio-rad公司。ECL顯影液購于美國Millipore公司,化學發光成像儀購于美國Bio-rad公司。細胞培養用小牛血清購于中國Cell max公司,青-鏈霉素購于美國Gbico公司;RPMI-1640培養基、0.25%胰酶購于美國hyclone公司。
1.2 實驗方法
1.2.1 細胞培養 A549及SPC-A1細胞用含有10%的小牛血清及雙抗(100 U/mL的青霉素、100 μg/mL的鏈霉素)的RPMI-1640培養基培養于37 ℃,5%CO2培養箱,待細胞密度達到約80%時,0.25%胰蛋白酶消化細胞,取對數生長期細胞進行實驗。
1.2.2 細胞轉染 過表達質粒由上海吉滿生物公司構建并合成,干擾套裝由廣州銳博生物公司設計提供。轉染前接種2×105個細胞于6孔板中,待細胞生長到80%時棄去原有培養基,更換為無血清新鮮培養基,1 750 μL/孔,取兩支1.5 mL EP管,分別加入125 μL無血清培養基再分別加入Lipo 3000 5 μL充分混勻。另取兩支1.5 mL EP管,分別加入125 μL 無血清培養基再分別添加SNHG1質粒或者干擾序列2 μg,充分混勻后分別加入4 μL P3000(干擾序列不加)再次混勻。將用稀釋的質粒或干擾序列分別加入到已稀釋的Lipo 3000中,充分混勻后室溫靜置5 min。最后將250 μL混合液分別加入到6孔板中,37 ℃CO2培養箱中培養。5 h后更換含10%小牛血清的新鮮培養基,常規培養。根據需要收集細胞進行實驗。
1.2.3 實時熒光定量PCR(qRT-PCR) 采用索萊寶總RNA提取試劑盒進行RNA的提取;Bio-rad逆轉錄試劑盒進行逆轉錄;利用Bio-rad的 SYBR-Green PCR Mix試劑盒檢測 SNHG1 mRNA 表達水平。β-actin 作為內參,采用 2-ΔΔCt公式對SNHG1基因表達進行相關計算。每組試驗重復 3 次。
1.2.4 蛋白質印跡法 RIPA裂解細胞,BCA試劑盒(上海碧云天)檢測蛋白濃度,取60 μg蛋白用于上樣,用10%的SDS page膠跑電泳(濃縮膠80 V,分離膠120 V),0.2 μmol/L的PVDF膜(美國Millipore)100 V轉膜,5%脫脂奶粉室溫封閉1 h,加入一抗(1∶1 000),4℃孵育過夜。次日TBST洗10 min 3次,加入二抗(1∶10 000)室溫孵育2 h,TBST洗10 min 3次,ECL顯影液顯影,化學發光成像系統進行成像。實驗重復3 次。
1.2.5 劃痕實驗 每6孔板孔中加10×104個各實驗組細胞,待細胞融合90%左右時用200 μL槍頭垂直6孔板劃橫線,生理鹽水洗3次,無血清培養基繼續培養24 h,按0、24 h的時間點拍照。實驗重復3次。
1.2.6 transwell遷移及侵襲實驗 2×104個細胞加入含有200 μL無血清的培養基的transwell小室(小孔直徑8 μm),24孔板孔中加入含有10%小牛血清的培養基600 μL,將transwell小室置于24孔板中,常規培養24 h。取出小室,PBS洗3次,用含1%的結晶紫染色15 min,PBS洗3次,用棉簽擦去小室上層細胞,取下底膜,用中性樹膠封片,高倍鏡下計數5個視野,取平均值,以檢測細胞的遷移能力。細胞侵襲實驗與遷移大致相同,只是在加入細胞前有鋪基質膠的過程:基質膠matrigel 4 ℃解凍,按無血清培養基:matrigel=7∶1的比例混勻作為基質膠層,每小室加入50 μL,待膠凝固(37 ℃ 1 h左右),之后按遷移的步驟進行后續實驗。實驗重復3次。
1.3 統計學方法
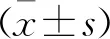
2 結果
2.1 SNHG1在肺癌中存在高表達且與患者總生存期呈負相關
利用GEO數據庫數據集(GSE19804,GSE19188,GSE74706) 資料分析發現,SNHG1在肺癌組織中明顯高表達;在肺癌患者中SNHG1的表達量與總生存期存在負相關(GSE30219,P<0.001; GSE19188,P=0.034; GSE37745,P=0.011)(圖1)。
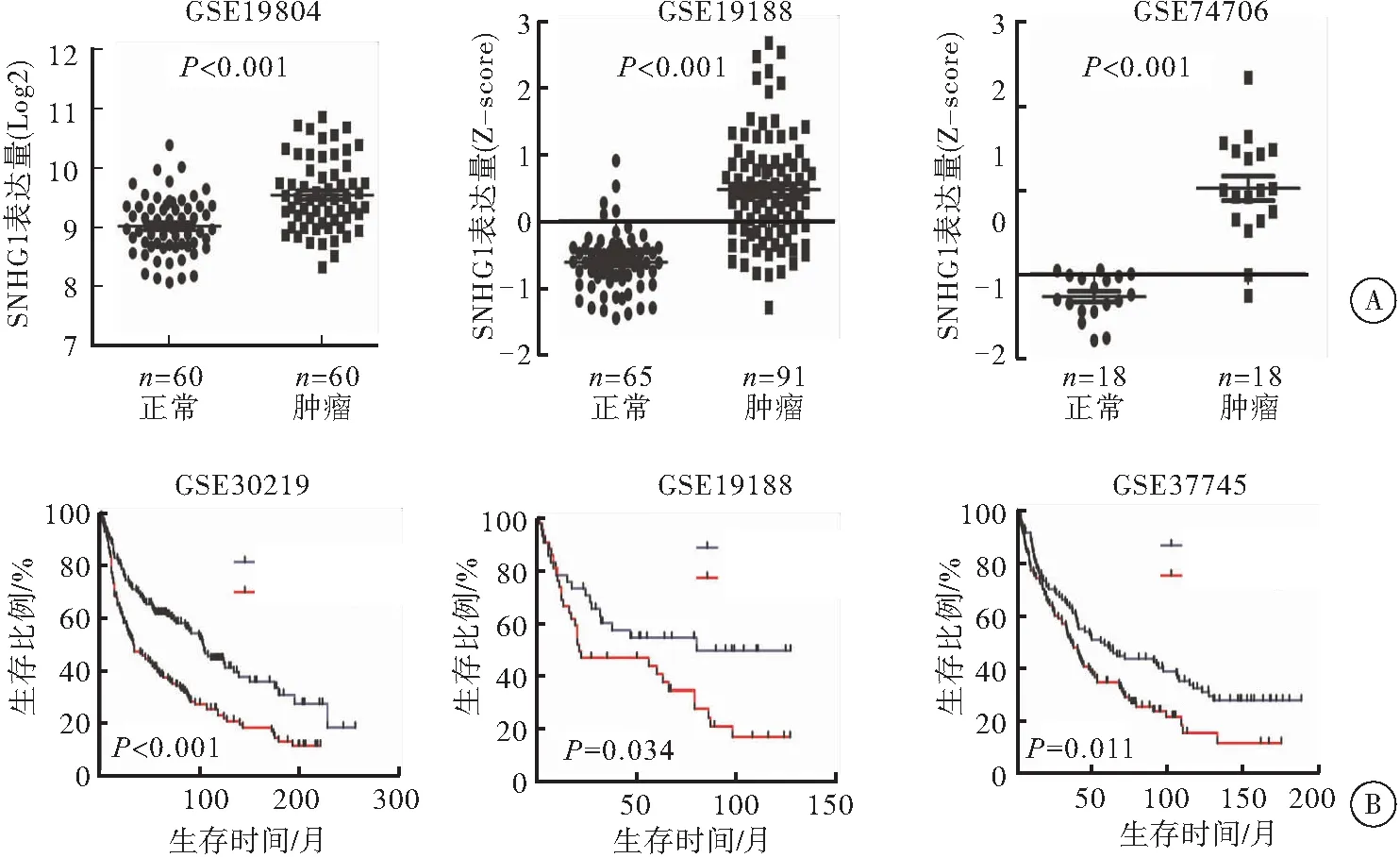
圖1 SNHG1在肺癌中存在高表達且與患者總生存期呈負相關
注:A:3個GEO數據集分析顯示,SNHG1在腫瘤組織中的表達均高于正常組織,差異均有統計學意義,P<0.001;B:3個GEO數據集分析顯示,SNHG1的表達與患者的總生存期呈負相關
2.2 過表達SNHG1促進NSCLC細胞遷移、侵襲及EMT
采用 qRT-PCR方法對SNHG1的過表達效率進行了驗證,結果顯示A549細胞及SPC-A1細胞均發生了明顯的過表達,細胞劃痕結果顯示,劃痕愈合率A549過表達組為(73.67±6.50)%,對照組為(43.00±5.56)%,P=0.003;SPC-A1過表組為(63.67±5.51)%對照組為(43.31±6.96)%,P=0.012;transwell遷移實驗結果顯示,遷移細胞數A549過表達組為61.67±5.68,對照組為37.33±8.02,P=0.012;SPC-A1過表組為71.33±5.13對照組為43.33±7.02,P=0.005。劃痕及遷移實驗均表明,SNHG1明顯促進了NSCLC細胞遷移;transwell侵襲實驗表明,SNHG1明顯提高了NSCLC細胞的侵襲能力(A549細胞侵襲數量為過表達組為46.00±7.50,對照組為29.00±5.65;P=0.035;SPC-A1過表組為75.00±8.00對照組為44.61±8.50,P=0.011)。利用蛋白質印跡法檢測過表達SNHG1及對照組NSCLC細胞的上皮及間質標志物,結果表明,與空載組相比,過表達SNHG1的細胞上皮標志蛋白E-鈣黏蛋白(E-cadherin)表達明顯減少,而間質標志蛋白N-鈣黏蛋白(N-cadherin)及波形蛋白(vimentin)明顯增加,提示過表達SNHG1后腫瘤細胞發生了明顯的EMT(圖2)。
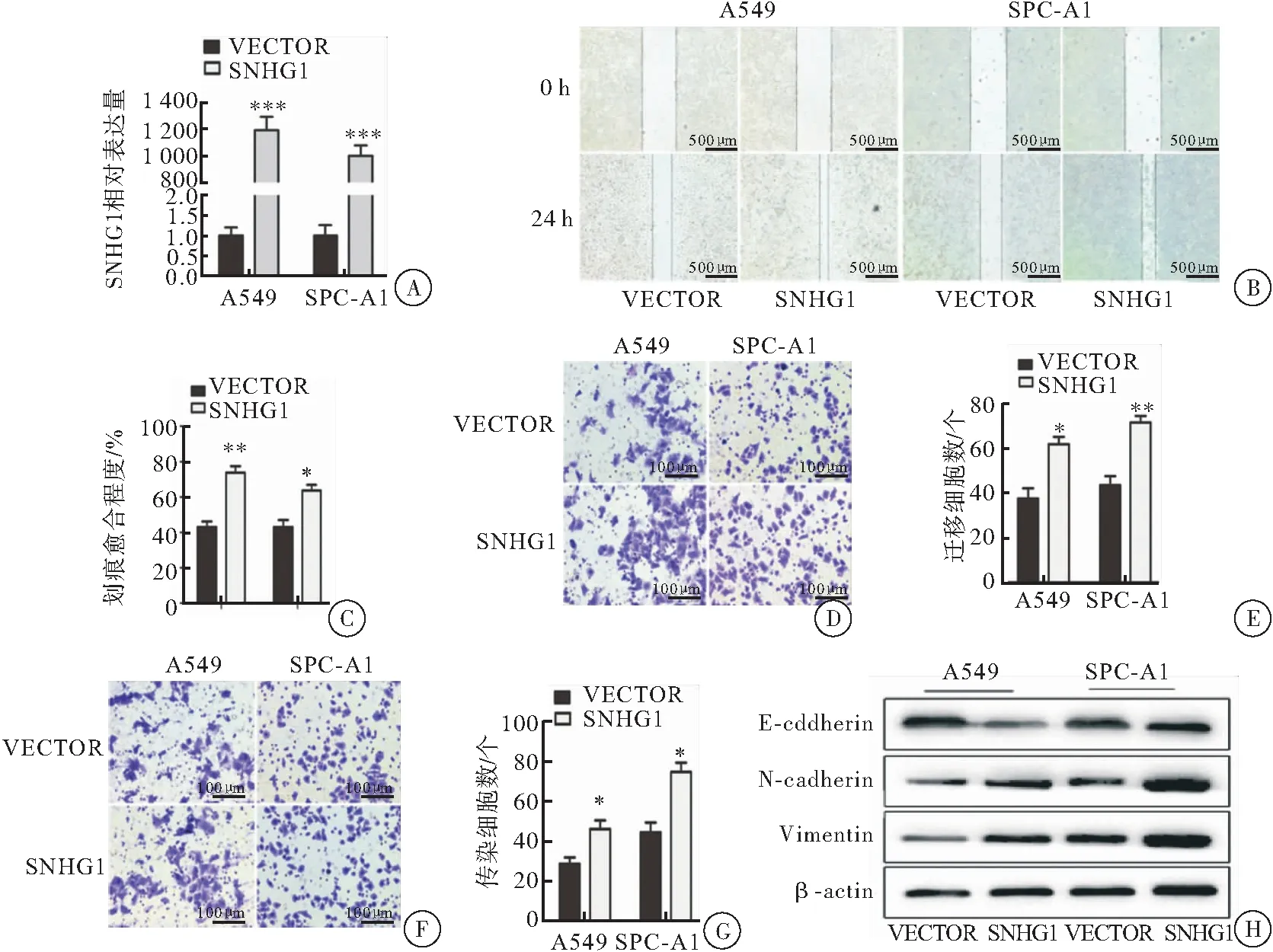
圖2 過表達SNHG1促進NSCLC細胞遷移、侵襲及EMT
注:A: qRT-PCR檢測過表達質粒SNHG1在A549及SPC-A1兩種NSCLC細胞中的表達效率,與空載組相比,***P<0.001;B、C:劃痕實驗檢測過表達SNHG1對NSCLC細胞遷移的影響,B:光鏡圖片,標尺:500 m;C:統計圖,與空載組相比,*P<0.05,**P<0.001;D、E:transwell遷移實驗檢測過表達SNHG1對NSCLC細胞遷移的影響;D:結晶紫染色光鏡圖片,標尺:50 m;E:統計圖,與空載組相比,*P<0.05,**P<0.001;F、G:transwell侵襲實驗檢測過表達SNHG1對NSCLC細胞侵襲能力的影響,F:結晶紫染色光鏡圖片,標尺:50 μm;G:統計圖,與空載組相比,*P<0.05;H:蛋白質印跡法檢測過表達SNHG1對NSCLC細胞EMT的影響
2.3 干擾 SNHG1抑制NSCLC細胞遷移、侵襲及EMT
為了進一步驗證SNHG1在NSCLC細胞遷移、侵襲及EMT中的作用,本研究設計了SNHG1的干擾序列,利用qRT-PCR對SNHG1的干擾效率進行了驗證,同時細胞劃痕[A549對照組愈合率為(43.32±9.07)%,干擾組為(22.00±3.61)%,P=0.019;SPC-A1對照組為(42.89±7.40)%,干擾組為(15.00±5.00)%,P=0.005]、transwell遷移(A549對照遷移數量為45.67±7.02,干擾組為29.00±5.00,P=0.028;SPC-A1對照組為35.67±7.63,干擾組為18.67±5.50,P=0.035)及侵襲(A549對照侵襲數量為40.00±5.00,干擾組為23.67±4.50,P=0.013;SPC-A1對照組為45.33±7.09,干擾組為26.67±5.68,P=0.023)實驗結果顯示:與對照組相比SNHG1干擾的NSCLC細胞遷移及侵襲能力明顯減弱。蛋白質印跡法檢測結果也證實干擾 SNHG1可明顯抑制NSCLC細胞EMT的發生(圖3)。
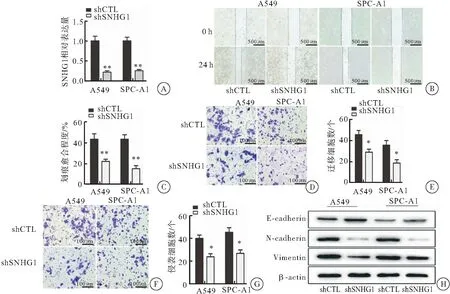
圖3 干擾 SNHG1抑制NSCLC細胞遷移、侵襲及EMT
注:A: qRT-PCR檢測SNHG1干擾序列在A549及SPC-A1兩種NSCLC細胞中的干擾效率,與對照組相比,**P<0.01;B、C:劃痕實驗檢測干擾SNHG1對NSCLC細胞遷移的影響;B:光鏡圖片,標尺:500 μm;C:統計圖,與空載組相比,**P<0.001;D、E:transwell遷移實驗檢測干擾SNHG1對NSCLC細胞遷移的影響;D:結晶紫染色光鏡圖片,標尺:50 μm;E:統計圖,與空載組相比,*P<0.05;F、G:transwell侵襲實驗檢測干擾SNHG1對NSCLC細胞侵襲能力的影響;F:結晶紫染色光鏡圖片,標尺:50 μm;G:統計圖,與空載組相比,*P<0.05;H:蛋白質印跡法檢測干擾SNHG1對NSCLC細胞EMT的影響
3 討論
肺癌是人類癌癥相關死亡的主要原因,2018年全球新發肺癌病例約209萬,死亡病例數約達176萬[1]。雖然當前肺癌的手術治療、放化療等主要方法不斷取得新的進展,但腫瘤轉移仍然是肺癌患者預后不良的主要原因,總體5年生存率仍較低[8]。因此,探索新的腫瘤轉移相關基因并研究其影響腫瘤發生發展的機制顯得尤為重要。
近年研究[9-10]表明,LncRNA不僅可通過調節染色質重構、組蛋白修飾、DNA甲基化等多種途徑而轉錄激活或干擾多種重要生命活動,還與腫瘤的發生發展密切相關。有研究[11]表明,異常表達的LncRNA在調控腫瘤細胞增殖、遷移及侵襲等惡性生物學進程中扮演著重要作用,LncRNA有望成為腫瘤治療的新靶點。SNHG1位于11號染色體的1區2帶上,其長度為1 134 bp[12]。近年研究表明,異常表達的SNHG1可通過負性調控多種miRNA而促進食管癌[13]、肝癌[14]、肺癌[15]等腫瘤的惡性化進展,另一方面SNHG1也可直接作用于腫瘤相關信號通路調控胰腺癌、結腸癌、食管癌等腫瘤的發生發展。而關于SNHG1在肺癌中的作用及具體的作用機制尚無統一定論,仍需進一步研究。本研究利用公共數據庫資料證實, SNHG1在肺癌組織中高表達,并分析了SNHG1的表達與肺癌患者的總生存期呈現負相關。并通過在兩種NSCLC細胞中過表達以及干擾SNHG1后,檢測NSCLC細胞的遷移、侵襲能力以及EMT的發生情況。
綜上所述,SNHG1可能通過促進NSCLC細胞發生EMT而增加其遷移和侵襲能力,由此推斷SNHG1可能成為NSCLC治療的新靶點。