水飛薊素對急性胰腺炎大鼠急性肺損傷及MAPK/NF-κB信號通路的影響
陳彩云,許秋霞,張 吟,莊奕筠,高雅莉
(福建醫科大學附屬第二醫院藥學部,福建 泉州 362000)
急性胰腺炎屬于臨床常見腹部急性病癥,輕度易于治療,重型急性胰腺炎(severe acute pancreatitis,SAP)不但引發胰腺重度炎癥、組織壞死,還會影響全身重要器官功能,其中肺部為最易受累的器官。調查顯示,SAP中肺損傷發生率高達70%,是導致SAP患者死亡的重要原因[1],因此,探究其發病機制,對于預防及治療SAP肺損傷者,改善預后,均十分重要。近期研究顯示,核因子κB(nuclear factor κB,NF-κB)的激活可導致肺損傷的發生,而抑制其表達后,可減輕肺損傷[2]。絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族成員主要包括p38、ERK、JNK,參與機體多種炎癥反應。研究顯示,在肺損傷過程中,激活MAPK通路后,可釋放大量炎癥因子,加重病情[3]。以上研究表明,MAPK/NF-κB可能作為SAP肺損傷的靶點。
水飛薊素(silymarin)是從水飛薊種皮中提取的黃銅木質素化合物。臨床研究顯示,水飛薊素不僅可用于肝病預防、治療,且具有廣泛的抗腫瘤作用,如在前列腺癌、肝癌、宮頸癌、乳腺癌中,能夠抑制癌細胞增殖分化[4]。張珂等[5]研究顯示,水飛薊素可通過抑制炎癥反應及氧化應激損傷,減輕大鼠肺缺血/再灌注損傷。以上研究表明,水飛薊素對肺損傷具有一定的保護作用,但有關水飛薊素在SAP引發的肺損傷的作用機制目前研究不多。為此,本研究通過建立SAP大鼠模型,觀察水飛薊素處理對MAPK/NF-κB信號通路的影響,探究其潛在作用機制。
1 材料與方法
1.1實驗動物SPF級♂SD大鼠72只,8周齡,體質量230~260 g,購于上海斯萊克實驗動物有限公司,許可證號為2015000504404。所有大鼠均在晝夜交替、自然光照下飼養,飼養過程中維持恒溫25 ℃,濕度為50%,期間大鼠自由飲水、攝食,定時對鼠籠進行清理,飼養期間所需水、食物及其他用品等,均經消毒,維持飼養環境清潔,保持通風。
1.2試劑與儀器水飛薊素購于上海純優生物科技有限公司,批號:20160803;地塞米松注射液,廣西萬德藥業股份有限公司,批號:20161107;蘇木精、伊紅染液購自美國Sigma公司;BCA蛋白檢測試劑盒購自美國Thermo Fisher Scientific公司;TNF-α、IL-1β ELISA試劑盒(批號:20161204、20160918),購于美國R&D公司;兔抗鼠p65、p-p65、IκBα、p-IκBα、ERK1/2、p-ERK1/2、JNK、p-JNK抗體,購自美國Santa Cruz公司;兔抗鼠p38、p-p38、辣根過氧化物酶標記羊抗鼠IgG二抗,購自美國R&D公司。蛋白凝膠成像儀,購自Bio-Rad公司;全自動血氣分析檢測儀,購于美國Beckman公司。
1.3方法
1.3.1動物模型的制備 根據文獻方法[6],制備SAP大鼠模型,制備前大鼠自由飲水,禁食12 h,腹腔注射2%戊巴比妥鈉麻醉,隨后固定于手術臺,常規消毒、鋪巾后,于腹部正中部位做一切口,暴露十二指腸,并將其提出體外,識別胰膽管匯入十二指腸系膜乳頭開口處,在其下緣腸壁處選取無血管區,用注射器針頭穿刺后,將5 cm硬膜外導管(外徑0.61 mm PE10聚乙烯導管)置入,朝向開口方向緩慢推進5 cm后,縫扎胰膽管下段及硬膜外導管,于導管末端連接輸液轉換器,泵入5%牛黃膽酸鈉1 mL·kg-1,流速控制在0.2 mL·min-1,2 min后,見胰膽管以及主胰管擴張后,維持10 min,將縫扎線去除,并將導管退出,封閉穿刺孔,復位十二指腸后逐層關腹。
1.3.2動物分組 將大鼠分為假手術組(僅翻動十二指腸、胰腺,不穿刺注藥)、模型組、水飛薊素低、中、高劑量組、地塞米松組(陽性組)。SAP模型制備完成后,水飛薊素低、中、高劑量組即刻腹腔注射用DMSO配制成的混懸液50、100、200 mg·kg-1,地塞米松組注射2 mg·kg-1地塞米松;假手術組、模型組腹腔注射同量生理鹽水,共給藥3 d。
1.3.3標本采集 各組隨機選取6只大鼠,末次給藥后,即刻采集下腔靜脈血3 mL,隨后剖腹采集腹主動脈血,將大鼠處死后獲得胰腺組織、肺組織。
1.3.4動脈血氣指標測定 采用全自動血氣分析檢測儀器,檢測腹主動脈血中氧分壓(arterial partial pressure of oxygen,PaO2)、二氧化碳分壓(arterial partial pressure of carbon dioxide,PaCO2),計算氧合指數(oxygenation index,OI)。
1.3.5血清中淀粉酶、TNF-α、IL-1β水平的檢測 下腔靜脈血凝固后離心,保留上清液,采用碘比色法檢測血清淀粉酶含量;采用ELISA法檢測TNF-α、IL-1β水平,具體參照試劑盒說明書進行操作。
1.3.6大鼠肺泡灌洗液(bronchoalveolar lavage,BAL)中中性粒細胞(polymorphonuclear neutrophils,PMN)計數 各組選取6只大鼠進行支氣管肺泡灌洗,利用自動血細胞分析儀對BAL中PMN進行計數。
1.3.7肺組織濕干重(wet weight/dry weight,W/D)測定 切除肺組織右肺下葉,用濾紙擦干后,置于玻璃試管中稱重,此時為肺組織濕重(W),置于烤箱中,溫度設定為60 ℃,連續烘烤、稱重,直至肺組織重量不再變化,此時所測重量為干重(D)。
1.3.8光鏡下觀察病理學變化 制備胰腺、肺組織石蠟切片,進行HE染色,采用Schmidt病理評分法[7],從胰腺水腫、壞死、炎癥細胞浸潤等方面對染色結果進行評定,分為5個等級,以0、1、2、3、4分進行標記。采用Holfbauer評分法[8],對水腫、出血、炎癥浸潤等進行評定:肺部無病變為0分;25%視野出現以上病變為1分,50%視野出現病變為2分;75%視野存在以上病變為3分;整個視野均出現以上病變為4分。
1.3.9Western blot檢測 肺組織剪碎后,添加蛋白裂解液放置30 min,離心后收集上清液,蛋白提取試劑盒提取細胞中蛋白,BCA試劑盒測定蛋白濃度,隨后進行SDS-PAGE電泳。電泳后,將蛋白轉移至PVDF膜,添加脫脂牛奶封閉后洗膜,添加1 ∶300稀釋的兔抗鼠p65、p-p65、IκBα、p-IκBα、ERK1/2、p-ERK1/2、JNK、p-JNK、p38、p-p38 一抗,置于4 ℃過夜,清洗后加二抗,置于37 ℃中孵育2 h,ECL顯色后,凝膠成像儀中觀察蛋白表達,并保存圖像。
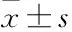
2 結果
2.1動脈血氣指標測定結果Tab 1結果顯示,與假手術組相比,模型組PaCO2升高,PaO2、OI降低,差異有顯著性(P<0.05)。與模型組相比,水飛薊素低、中、高劑量組和陽性組PaCO2降低,PaO2、OI升高,具有劑量依賴性,差異有顯著性(P<0.05)。

Tab 1 Comparison of PaCO2, PaO2 and OI levels in each group of rats n=6)
*P<0.05vssham;#P<0.05vsmodel
2.2血清淀粉酶、TNF-α、IL-1β測定結果Tab 2結果顯示,與假手術組相比,模型組淀粉酶活性、TNF-α、IL-1β水平升高,差異有顯著性(P<0.05)。與模型組相比,水飛薊素低、中、高劑量組和陽性組淀粉酶活性、TNF-α、IL-1β水平降低,具有劑量依賴性,差異有顯著性(P<0.05)。

Tab 2 Comparison of amylase, TNF-α and IL-1β levels in each group of rats n=6)
*P<0.05vssham;#P<0.05vsmodel
2.3各組大鼠W/D、PMN對比Tab 3結果顯示,與假手術組相比,模型組胰腺、肺組織W/D、PMN升高,差異有顯著性(P<0.05)。與模型組相比,水飛薊素低、中、高劑量組和陽性組胰腺、肺組織W/D、PMN降低,具有劑量依賴性,差異有顯著性(P<0.05)。

Tab 3 Comparison of W/D, PMN levels in each group of rats n=6)
*P<0.05vssham;#P<0.05vsmodel
2.4胰腺、肺組織病理形態學觀察Fig 1的HE染色顯示,假手術組大鼠胰腺組織細胞正常,胰腺小葉完整,間質未出現炎性細胞浸潤、充血以及壞死組織。模型組胰腺腺泡細胞出現大量壞死,結構模糊、融合成一片,小葉結構模糊,出現大量炎癥細胞浸潤,肺泡間間隔明顯變寬。水飛薊素組及陽性組均得到明顯改善,且隨著處理劑量的增加,肺組織逐漸恢復正常。Tab 4結果顯示,與假手術組相比,模型組大鼠胰腺組織病理評分升高,差異有顯著性(P<0.05);與模型組相比,陽性組、水飛薊素組胰腺組織病理評分均降低,隨著給藥劑量的升高,肺組織病理評分逐漸降低,差異有顯著性(P<0.05)。
如Fig 2所示,假手術組肺泡結構完整,肺間質未出現水腫、充血、炎性細胞浸潤等。模型組肺泡壁變厚、間隔變寬,肺間質出現充血,且伴隨大量炎性細胞浸潤。水飛薊素組及陽性組均得到明顯改善,且隨著處理劑量的增加,肺組織逐漸恢復正常。Tab 4結果顯示,與假手術組相比,模型組大鼠肺組織病理評分升高,差異有顯著性(P<0.05);與模型組相比,水飛薊素組及陽性組大鼠肺組織病理評分均降低,隨著給藥劑量的升高,肺組織病理評分逐漸降低,差異有顯著性(P<0.05)。

Fig 1 Pathological staining structure of pancreatic tissues (×100)
A: Sham operation group; B: Model group; C: Silymarin low dose group; D: Silymarin medium dose group; E: Silymarin high dose group; F: Dexamethasone group.
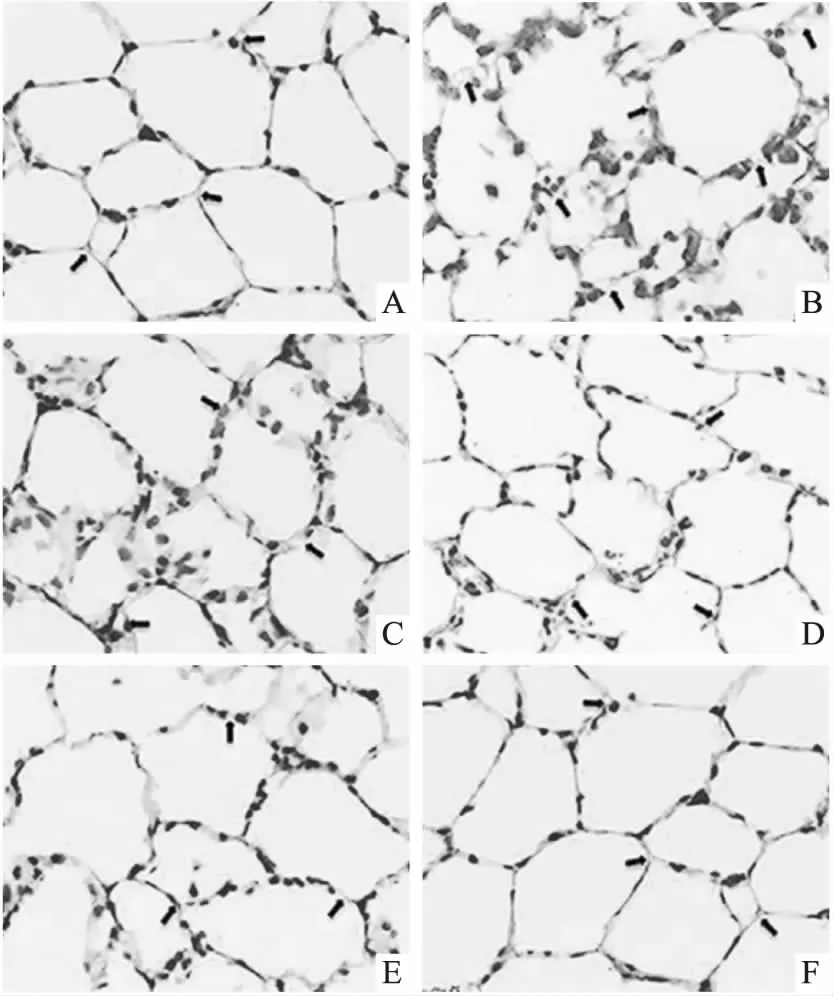
Fig 2 Pathological staining of lung tissues (×200)
A: Sham operation group; B: Model group; C: Silymarin low dose group; D: Silymarin medium dose group; E: Silymarin high dose group; F: Dexamethasone group.

Tab 4 Comparison of pathological scores of pancreas tissues and lung tissues in rats n=6)
*P<0.05vssham;#P<0.05vsmodel
2.5大鼠肺組織MAPK信號通路蛋白檢測如Fig 3、Tab 5所示,與假手術組相比,模型組p-JNK、p-p38、p-ERK1/2蛋白表達升高(P<0.05)。與模型組相比,水飛薊素低、中、高劑量組和陽性組p-JNK、p-p38、p-ERK1/2蛋白表達降低,具有劑量依賴性(P<0.05)。各組間JNK、p38、ERK1/2蛋白表達無明顯變化,差異無統計學意義(P>0.05)。
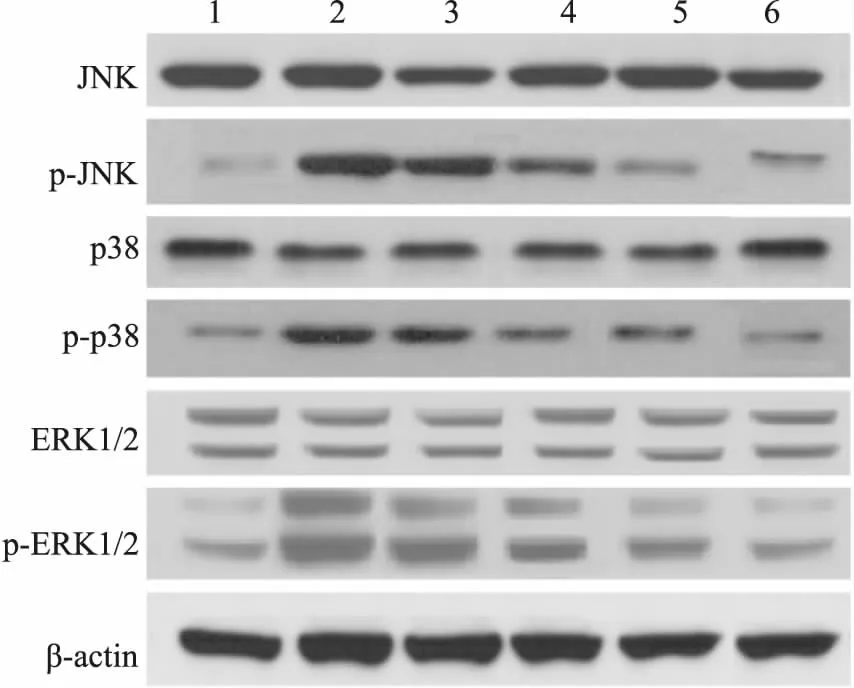
Fig 3 Protein expression of MAPK signaling pathway
1: Sham operation group; 2: Model group; 3: Silymarin low dose group; 4: Silymarin medium dose group; 5: Silymarin high dose group; 6: Dexamethasone group.
2.6大鼠肺組織NF-κB通路蛋白檢測如Fig 4、Tab 6所示,與假手術組相比,模型組p-p65、p-IκBα蛋白表達升高(P<0.05)。與模型組相比,水飛薊素低、中、高劑量組和陽性組p-IκBα蛋白表達降低,具有劑量依賴性(P<0.05)。各組間p65、IκBα蛋白表達無明顯變化(P>0.05)。
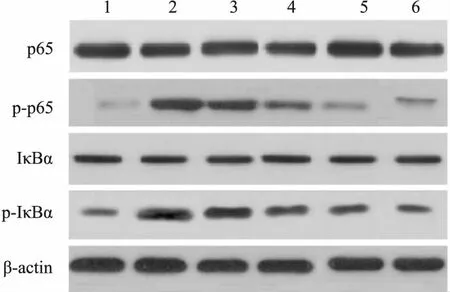
Fig 4 Protein expression of NF-κB pathway
1: Sham operation group; 2: Model group; 3: Silymarin low dose group; 4: Silymarin medium dose group; 5: Silymarin high dose group; 6: Dexamethasone group.
3 討論
SAP損傷后,病理學主要表現有小葉局部壞死,胰腺細胞中出現大量炎癥細胞浸潤,胰腺腺泡破壞等病理特征。本研究HE 染色顯示,模型組大鼠胰腺組織腺泡細胞出現大量壞死,結構模糊、融合成一片,小葉結構模糊,出現大量炎癥細胞浸潤,肺泡間間隔明顯變寬,這與臨床上水腫型胰腺炎病理特征相似[9],提示SAP模型大鼠制備成功。而給予水飛薊素處理后,胰腺組織腺泡細胞破裂減少,隨著處理劑量的增加,炎癥浸潤也明顯減輕,以上均提示水飛薊素可減輕SAP胰腺炎癥。肺組織損傷具有典型病理特征,如肺泡結構變化、肺水腫及炎性浸潤。本研究進一步對肺組織進行HE染色,結果顯示模型組肺泡壁變厚、間隔變寬,肺間質出現充血,且伴隨大量炎性細胞浸潤,表明SAP可導致大鼠肺組織損傷,而給予水飛薊素處理后,肺組織損傷程度明顯減輕。研究證實,地塞米松對脂多糖誘導的急性肺損傷具有保護作用[10]。本研究以地塞米松作為陽性對照藥物,結果顯示,水飛薊素高劑量組大鼠肺組織恢復程度與陽性組相似,提示水飛薊素可緩解SAP所引發的肺損傷,與地塞米松處理結果相似。

Tab 5 Expression of JNK, p-JNK, p38, p-p38, ERK1/2, p-ERK1/2 protein in lung tissues of rats n=6)
*P<0.05vssham;#P<0.05vsmodel

Tab 6 p65, p-p65, IκBα and p-IκBα pathway proteins in rat lung tissues n=6)
*P<0.05vssham;#P<0.05vsmodel
肺泡巨噬細胞可產生大量TNF-α、IL-1β等促炎性細胞因子,引起炎癥反應。動物研究發現,IL-1β抗體可減輕急性肺損傷動物模型中的肺損傷[11]。此外,研究發現,IL-1β、TNF-α等細胞因子表達的上調,能夠進一步促進中性粒細胞浸潤至損傷肺組織中,加重肺組織炎癥反應,形成惡性循環[12]。以上表明,中性粒細胞浸潤、炎性細胞因子是與肺炎癥性損傷有關的關鍵因素。本研究發現,大鼠血清TNF-α、IL-1β、PMN明顯升高,進一步證實SAP大鼠肺組織炎性損傷。水飛薊素可通過降低機體炎癥反應,緩解SAP大鼠肺損傷,與地塞米松處理結果相似,提示水飛薊素可能通過減少血清中炎癥細胞因子,抑制肺組織中性粒細胞浸潤,從而減輕肺組織炎癥反應,緩解肺組織損傷。
NF-κB/MAPK信號通路過度激活,在肺損傷的發生中發揮重要作用。NF-κB一般情況下被IκB抑制,以非活性狀態存在細胞質中,在外界刺激下IκB發生磷酸化被激活后,NF-κB抑制作用被解除,磷酸化后進入細胞核內,促進靶基因的轉錄。本研究結果顯示,模型組大鼠p-p65、p-IκBα蛋白表達升高,說明NF-κB通路被激活。國內學者在肺損傷動物研究中也發現,模型組大鼠NF-κB信號通路相關蛋白表達明顯高于正常組大鼠,與本研究結果一致[13]。在給予水飛薊素后,p-IκBα蛋白表達明顯降低,與地塞米松處理結果相似,表明水飛薊素可能通過抑制NF-κB信號通路活性,緩解肺部炎癥損傷。
MAPK信號通路激活后,可促進機體內大量炎癥因子的釋放,進而加重炎癥反應[14]。本研究結果顯示,模型組p-JNK、p-p38、p-ERK1/2蛋白表達較假手術組明顯升高,與以往報道相符[15],提示SAP大鼠可能通過激活MAPK信號通路,導致肺損傷。進一步研究顯示,在給予水飛薊素后,肺組織中p-JNK、p-p38、p-ERK1/2蛋白表達較模型組明顯降低,與地塞米松處理結果相似,說明水飛薊素可抑制SAP引發的MAPK信號通路激活,進而緩解肺部損傷,保護肺組織。
綜上所述,水飛薊素能夠降低SAP大鼠肺部炎癥反應,同時抑制NF-κB/MAPK信號通路活性,推測水飛薊素改善SAP肺損傷可能與抑制NF-κB/MAPK信號通路有關。SAP肺損傷機制較復雜,本研究中水飛薊素僅能部分緩解肺組織炎癥反應,而非逆轉SAP引發的大鼠肺損傷,可能與其他因素有關,還有待深入探究,以期為疾病的治療提供更有力的實驗依據。