治療自身免疫病藥物研究進展
張玲玲,魏 偉
(安徽醫科大學臨床藥理研究所,抗炎免疫藥物教育部重點實驗室,安徽省高校抗炎免疫藥物協同創新中心,安徽省高校抗炎免疫藥物創新團隊,安徽 合肥 230032)
自身免疫病(類風濕關節炎、系統性紅斑狼瘡、炎癥性腸病、干燥綜合征、強直性脊柱炎、慢性活動性肝炎、支氣管哮喘等)是一類以局部或全身性異常炎癥免疫反應為特征的炎癥免疫性疾病。自身免疫病的治療包括兩個目標,第一是癥狀緩解和功能維持,第二是延緩組織損害進程。目前,治療自身免疫病藥物主要分為非甾體抗炎藥(nonsteroid anti-inflammatory drugs,NSAIDs)、甾體抗炎藥(steroid anti-inflammatory drugs,SAIDs)和改善病情抗風濕藥(disease modifying anti-rheumatic drugs,DMARDs)三類。NSAIDs通過抑制環氧合酶(cyclooxygenase,COX)活性,減少前列腺素(prostaglandin,PG)生成,抑制多種細胞因子分泌而發揮抗炎、解熱和鎮痛作用,可改善疾病癥狀和體征,主要用于自身免疫病的對癥治療。SAIDs具有較強抗炎作用和免疫抑制作用,阻止炎癥細胞向炎癥部位聚集,抑制炎性因子釋放,抑制T、B淋巴細胞增殖和分泌。DMARDs包括化學藥物、天然藥物以及生物制劑等,能夠抑制炎癥、改善癥狀、延緩組織破壞。DMARDs起效緩慢,用藥數周或數月后,癥狀和體征才逐漸減輕,需長時間連續用藥方可獲得比較穩定的療效。
炎癥細胞因子(TNF-α、IL-1、IL-6、IL-17、IL-12、IL-23等)、細胞表面分子(CD20、CD80/86等)及其介導的信號通路(MAPKs、PI3K、NF-κB、JAK/STAT等)參與免疫細胞功能紊亂和自身免疫病的病理進程。以細胞因子、受體和信號分子為治療靶點的靶向生物制劑,近年來獲得較快發展。細胞因子和生長因子與細胞表面受體結合,觸發JAK家族蛋白(JAK1、JAK2、JAK3、Tyk2)磷酸化,進一步活化STAT,啟動JAK/STAT信號通路,參與炎癥免疫應答。靶向JAK/STAT信號通路的多個小分子藥物近年來研究活躍,已用于臨床或臨床試驗[1]。炎癥免疫反應軟調節(soft regulation of inflammatory immune responses,SRIIR)藥物是一類選擇性調控機體組織細胞功能、基因和蛋白異常變化所致病理狀態恢復至生理水平的藥物。芍藥苷-6-氧-苯磺酸酯(代號CP-25)是具有抗炎免疫調節作用的SRIIR藥物,在治療自身免疫病中具有潛在前景[2]。本文綜述了治療自身免疫病藥物的研究進展。
1 NSAIDs
NSAIDs是治療類風濕關節炎(rheumatoid arthritis,RA)和強直性脊柱炎(ankylosing spondylitis,AS)等自身免疫病常用藥物,能有效減輕患者臨床癥狀和體征,消除關節局部炎癥反應,但是該類藥只能治標,不能治本,不能控制疾病的活動及進展。NSAIDs共有的不良反應包括中樞神經系統癥狀(疼痛、眩暈、耳鳴等)、心血管損害(高血壓、浮腫、心肌梗死、心衰等)、胃腸道癥狀(上腹痛、納差、嘔吐、潰瘍、出血等)、造血系統改變(血小板減少)、肝腎功能不全、哮喘和皮膚藥疹等。繼阿司匹林之后,眾多NSAIDs被研發用于臨床[3],見Tab 1。
2 傳統DMARDs
目前,臨床常用的傳統DMARDs主要包括甲氨蝶呤(methotrexate,MTX)、來氟米特(leflunomide,LEF)、環磷酰胺(cyclophosphamide,CTX)、硫唑嘌呤(azathioprine,AZA)、環孢素A(cyclosporin A,CsA)、嗎替麥考酚酯(mycophenolate mofetil,MMF)、他克莫司(FK506)、柳氮磺吡啶等[4]。該類藥物廣泛應用于自身免疫病、慢性腎病、移植排斥反應、腫瘤等的治療。雖然傳統DMARDs化學結構和藥理作用機制不盡相同,但臨床藥理學特征相似,即起效慢,用藥數周或數月后,癥狀和體征逐漸減輕,長時間連續服藥可獲得比較穩定的療效。如MTX抑制二氫葉酸還原酶而降低四氫葉酸形成,阻斷DNA合成,能延緩關節破壞并修復骨破壞,適用于活動期RA。MTX也可治療銀屑病關節炎(psoriasis arthritis,PsA)[5]。LEF主要抑制二氫乳清酸脫氫酶活性,影響淋巴細胞嘧啶合成,可改善RA患者臨床癥狀和實驗室指標。LEF聯合激素治療狼瘡腎炎(lupus nephritis,LN),療效明顯[6]。傳統DMARDs的藥理作用特點、臨床適應癥及不良反應見Tab 2[7-8]。
3 生物制劑
生物制劑通過阻斷關鍵炎癥細胞因子或細胞表面分子而發揮治療作用,如靶向IL-1、IL-6、TNF-α和IL-17的單克隆抗體,抗CD20單抗、B淋巴細胞刺激因子(B cell activating factor,BAFF)抑制劑、T 細胞抑制劑、整合素單克隆抗體、選擇性黏附分子抑制劑等[6]。
3.1細胞因子、受體及信號分子抑制劑
3.1.1TNF-α抑制劑 TNF-α抑制劑包括英夫利昔單抗(Infliximab)、阿達木單抗(Adalimumab)、依那西普(Etanercept)、戈利木單抗(Golimumab)等。Infliximab 是人鼠嵌合性TNF-α單克隆抗體,對MTX等治療無效的RA患者具有滿意療效,早期應用的效果更好。Etanercept是人重組TNF受體p75和IgGFc段的融合蛋白,治療RA耐受性較好。Adalimumab是針對TNF-α的全人源化單克隆抗體。通過皮下注射給藥,用于治療RA療效確切。Adalimumab、Infliximab、Etanercept也常用于治療銀屑病。Adalimumab可用于治療難治性重型銀屑病。Infliximab對于中重度銀屑病療效較佳。Etanercept可減輕銀屑病患者的疲勞感,并且對患者的煩躁、抑郁情緒予以有效緩解。Infliximab、Adalimumab和Golimumab均被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準用于臨床治療潰瘍性結腸炎(ulcerative colitis,UC)。Infliximab是最早被FDA 批準用于治療炎癥性腸病(inflammatory bowel disease,IBD)的生物制劑,對免疫抑制劑及激素不能耐受或無效的中、重度UC 患者均有效,目前常作為UC的二線治療藥物。Adalimumab于2012年被FDA 批準用于治療UC,可明顯降低中、重度UC 患者的住院率及死亡率。Etanercept、Adalimumab有時也用于治療AS等脊柱關節疾病。TNF-α 抑制劑主要不良反應是注射部位反應、感染、腫瘤發生風險等。其他靶向TNF-α的抑制劑見Tab 3。
3.1.2IL-6 抑制劑 托珠單抗(Tocilizumab)是抗IL-6 受體單克隆抗體,可以通過結合IL-6 跨膜受體來抑制IL-6介導的信號轉導,抑制自身抗體,如類風濕因子(rheumatoid factor,RF)和抗瓜氨酸蛋白抗體(anti-citrulline protein antibody,ACPA)產生。主要用于治療中、重度RA,也用于治療幼年特發性關節炎(juvenile idiopathic arthritis,JIA)。隨著Tocilizumab 研發成功,以IL-6信號通路作為靶點的多個生物制劑也正在研發用于治療RA。IL-6抑制劑主要不良反應包括輸液反應、感染、腫瘤發生風險、消化道潰瘍、血脂檢查異常、肝轉氨酶升高、中性粒細胞減少等[9]。靶向IL-6的其他抑制劑見Tab 3。

Tab 1 The pharmacological mechanisms, indications in autoimmune diseases and adverse reactions of NSAIDs

Tab 2 The pharmacological mechanisms, indications in autoimmune diseases and adverse reactions of DMARDs
CD: Crohn’s disease; JIA: juvenile idiopathic arthritis; LN: lupus nephritis; MS: multiple sclerosis; PsA: psoriasis arthritis; SLE: systemic lupus erythematosus; UC: ulcerative colitis.

Tab 3 Biological agents targeting cytokines and receptors of cytokines
AS: ankylosing spondilitis; IBD: inflammatory bowel disease.
3.1.3IL-17 單克隆抗體 蘇金單抗(Secukinumab)是2015年美國FDA批準用于治療成人中、重度斑塊型銀屑病的IL-17單克隆抗體,對銀屑病具有良好療效。Brodalumab是人IL-17 A受體(IL-17AR)拮抗劑。2017年,美國FDA 批準治療成人中、重度斑塊性銀屑病[10]。其他IL-17單克隆抗體見Tab 3。
3.1.4抗IL-12/23單克隆抗體 目前應用較廣的抗IL-12/23抗體為優特克單抗(Ustekinumab),美國FDA于2009年批準用于銀屑病的治療,臨床療效明顯優于其他生物制劑[11]。其他抗IL-12/23單克隆抗體見Tab 3。
3.2抗CD20單抗利妥昔單抗(Rituximab)是靶向B細胞CD20的嵌合鼠/人單克隆抗體,該抗體與CD20特異性結合,通過補體依賴性細胞毒性和抗體依賴性細胞介導的細胞毒性,誘導B細胞凋亡。2005年,Rituximab獲得批準用于治療TNF-α拮抗劑療效不佳的RA患者,與MTX聯用適用于治療成年中度嚴重活動性RA,也可與CsA聯合用藥。Rituximab可明顯改善SLE患者蛋白尿、血清白蛋白,并可減少維持階段激素的劑量,對活動期LN誘導治療,緩解率升高,系統性紅斑狼瘡(systemic lupus erythematosus,SLE)活動度評分明顯降低。不良反應表現為1 000 mg首次治療,30%病人出現皮疹,滴注部位反應、原有心臟病加重、輕微和可逆性出血以及真菌、細菌、病毒感染等。嚴重或活動性感染禁用,可導致B細胞耗竭[12]。其他抗CD20單抗見Tab 4。
3.3BAFF抑制劑
3.3.1貝利木單抗(Belimumab) Belimumab是抗可溶性BAFF人源化IgG1型單克隆抗體。Belimumab是近50多年來獲批用于治療SLE的首個生物制劑,2011年獲得美國和歐盟批準,用于自身抗體陽性的成年SLE治療。Belimumab能抑制BAFF的生物活性,從而降低SLE抗體水平,控制病情發展,可降低SLE治療對激素的依賴性,抑制疾病活動性。2016年,美國風濕病學會報道,75.6%的患者可獲得臨床緩解,而且軀體疼痛、總體健康、生理功能、生理職能、社會功能、生命活力6項健康相關生活質量功能評分均明顯改善。在激素和免疫抑制劑基礎上加用Belimumab,能夠降低LN的復發率。Belimumab適用于治療活動性、自身抗體陽性的正在接受標準治療的SLE成年患者[13]。有重要器官受累的SLE患者接受Belimumab治療可取得明顯療效。Belimumab治療RA處于Ⅱ期臨床試驗階段,ACR20 應答率為34%。Belimumab常見不良反應包括惡心、腹瀉、發熱、鼻咽炎、支氣管炎、失眠、肢體疼痛、抑郁、偏頭痛等。
3.3.2阿塞西普(Atacicept) Atacicept是BAFF受體TACI胞外區和人IgG1的Fc片段構建而成的TACI-Ig融合蛋白。動物實驗中,TACI-Ig融合蛋白能明顯抑制關節炎癥反應,并能抑制骨和軟骨的破壞以及疾病的發展。Ⅰb期臨床試驗結果表明,TACI-Ig能降低血清免疫球蛋白、RF及抗ACPA抗體水平。治療12 周后,32%的患者達到ACR20應答。IgM、IgG、IgA及RF水平明顯降低。TACI-Ig治療SLE患者,可減少紅斑樣皮損發生率,防止復發,提高生活質量。目前,TACI-Ig 已進入非腎炎SLE患者的II/Ⅲ期臨床試驗[14]。
3.4T細胞抑制劑阿貝西普(Abatacept)是由免疫球蛋白IgG1的Fc區和細胞毒T淋巴細胞抗原4(cytotoxic T lymphocyte-associated antigen 4,CTLA4)細胞外結構域組成的融合蛋白,是選擇性T細胞共刺激抑制劑。Abatacept通過與抗原遞呈細胞上的CD80和CD86結合,抑制T細胞激活,從而抑制炎性因子如TNF-α、IFN-γ和IL-2 的產生。臨床適用于經1種或多種傳統DMARDs應答不足的中、重度活動性RA患者,也可用于JIA。Abatacept可降低血清lL-6、RF、C-反應蛋白、MMP-3及TNF-α水平,延緩組織結構性破壞進程,減輕癥狀和體征。不良反應為上呼吸道和泌尿道感染、惡性腫瘤等。另外,Abatacept治療干燥綜合征(Sjogren syndrome,SS)目前處于Ⅲ期臨床試驗階段。Abatacept能夠明顯降低SS疾病活動度,改善疼痛和疲勞等癥狀。Abatacept也用于治療PsA[15]。
3.5整合素單克隆抗體
3.5.1那他珠單抗(Natalizumab) Natalizumab是重組α4-整合素單克隆抗體,能阻止激活的T淋巴細胞通過血腦屏障。2004年通過FDA快速通道審批,臨床上用于治療復發性多發性硬化癥(multiple sclerosis,MS)和CD。MS復發率可降低68%。常見不良事件包括頭痛、呼吸道感染和疲勞。由于發生罕見不良反應“進行性多灶性白質腦病(progressive multifocal leukoencephalopathy,PML)”,于2005年撤市。后因疾病治療的迫切需求,2006年6月,FDA同意其在風險最小化計劃方案下重新上市[16]。
3.5.2維多珠單抗(Vedolizumab) Vedolizumab是一種全人源化IgG單克隆抗體,能夠特異性拮抗α4β7整合素。2014年,FDA批準用于對TNF拮抗劑或免疫抑制劑療效不佳或不能耐受的中、重度UC治療。相比于抗TNF-α 制劑,Vedolizumab起效較慢,治療6周后效果才明顯。不良反應有上呼吸道感染、鼻咽炎、腹痛、惡心、發熱、關節痛等,嚴重不良事件報道包括嚴重感染、惡性腫瘤等[1]。
其他單克隆抗體生物制劑見Tab 4。
4 JAK靶向小分子抑制劑
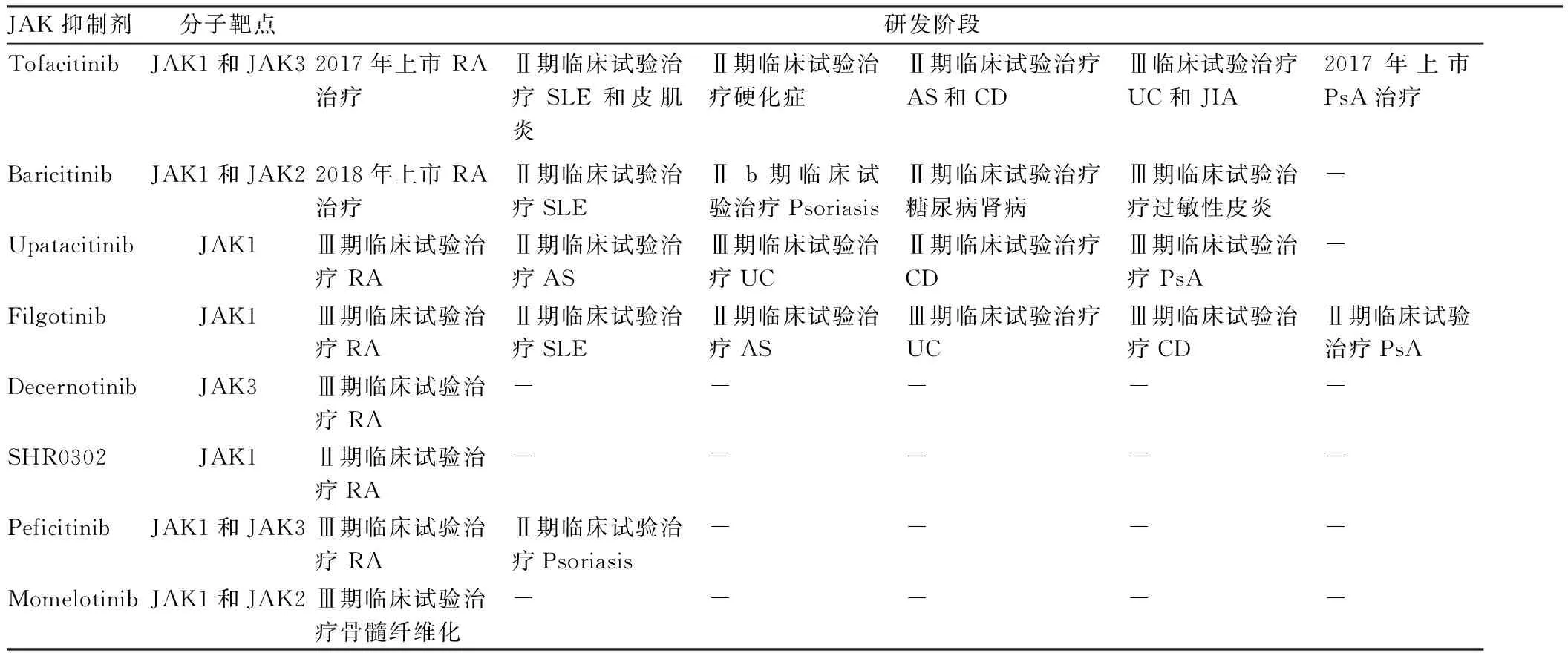
許多促炎癥細胞因子信號通過不同途徑,激活JAK/STAT信號通路,JAK/STAT進一步介導下游信號,參與自身免疫病細胞增殖、活化、抗體和細胞因子產生等病理過程。特異性抑制JAK/STAT信號通路,可阻斷細胞因子的級聯放大作用,從而改善自身免疫病的病理和臨床表現[17]。JAK抑制劑(Tofacitinib、Baricitinib、Upatacitinib、Filgotinib等)通過抑制細胞因子和生長因子的信號轉導,進而抑制免疫細胞功能,包括T細胞、B細胞、巨噬細胞、樹突細胞等。
4.1托法替尼(Tofacitinib) Tofacitinib為靶向JAK3的抑制劑,也有相對弱的JAK1活性,于2012 年被FDA 批準治療RA。Tofacitinib能夠在TNF單抗耐藥或不應答的患者中產生良好應答,可以緩解和降低疾病活動性。Tofacitinib可治療SLE、MS、AS、UC、CD、皮肌炎等自身免疫病,目前處于臨床試驗階段[18]。Tofacitinib說明書上有嚴重感染和惡性腫瘤風險增加的黑框警告。
4.2BaricitinibBaricitinib是JAK1/2選擇性抑制劑,具有輕度抗酪氨酸激酶2(tyrosine kinase 2,TYK2)活性和極少抗JAK3活性,治療對傳統DMARs無應答或不耐受的中、重度成人RA,可降低健康問卷評分和關節X線進程,顯示較高的ACR 20/50/70應答率和良好耐受性。Baricitinib治療銀屑病、糖尿病腎病、過敏性皮炎正在臨床試驗階段。
4.3FilgotinibFilgotinib為JAK1選擇性抑制劑,在臨床中顯示出與Tofacitinib類似的療效,但安全性有所提高,特別是淋巴細胞減少的癥狀大大緩解。Filgotinib治療RA、SLE、MS、AS、UC、CD、銀屑病關節炎等自身免疫病,目前處于臨床試驗階段。近期研發的其他小分子JAK 抑制劑見Tab 5。
5 天然藥物
用于治療自身免疫病的天然藥物包括苷類和生物堿,苷類藥物如白芍總苷、人參總苷、絞股藍總苷、黃芪甲苷、雷公藤總苷、三七總皂苷等,生物堿類如青藤堿、川烏總堿、槐果堿、雷公藤新堿等。
5.1雷公藤總苷(tripterygiumglycosides,TG) TG是雷公藤根部提取物,為雷公藤的主要有效成分,可抑制T細胞增殖、自身抗體產生及炎癥細胞因子IL-1、IL-6、IL-8、TNF-α和PGE2產生,具有較強抗炎和免疫抑制作用。臨床上,TG常聯合小劑量MTX治療RA。TG改善SLE臨床癥狀,能降低γ-球蛋白,使抗核抗體ANA轉陰或滴度下降。TG聯合潑尼松治療LN遠期療效較好。TG也用于治療銀屑病,改善局部微循環。TG不良反應主要有皮膚過敏反應及心血管、消化、造血、神經、生殖系統不良反應等,還可引起脫發、色素沉著、腰痛等。TG引起月經紊亂及精子活力降低,數量減少,停藥可恢復正常。孕婦忌服,老年患者及嚴重心血管病的患者慎用[19]。
5.2白芍總苷(totalglucosidesofpaeony,TGP) TGP是從白芍中提取的有效部位,其成分包括芍藥苷、羥基芍藥苷、芍藥花苷、芍藥內酯苷、苯甲酰芍藥苷等,其中芍藥苷是TGP的主要活性成分。TGP具有抗炎免疫調節作用,抑制PGE2、 IL-1、LTB4、TNF-α等細胞因子產生,調節免疫細胞信號轉導。TGP作為天然藥物來源的Ⅱ類化學藥品被批準上市治療RA,可改善RA患者臨床癥狀和體征,降低血沉和RF。TGP治療SLE和LN患者,能有效下調血清IL-6、IL-8、IL-18、TNF-α和INF- α水平。TGP 可減少每日激素和免疫抑制劑用量,降低復發及感染率。TGP治療SS可改善口干、眼干癥狀,降低血沉,減少其飲水量等臨床癥狀,并可長期應用。TGP聯合硫酸羥氯喹治療SS患者,其口干、眼干癥狀評分及飲水量均低于單獨硫酸羥氯喹治療的患者。TGP治療銀屑病可抑制細胞因子分泌,改善銀屑病患者癥狀,也可降低阿維A在銀屑病治療中的不良反應。TGP不良反應少,發生率低且輕微,偶有軟便和稀便,長期使用患者耐受性好。

Tab 4 Biological agents targeting molecules on cell surface and receptors
Tab 5 Development of JAK inhibitors
5.3青藤堿(sinomenine) 青藤堿是從青風藤中提取的生物堿,有較強的抗炎鎮痛及免疫抑制作用,可抑制淋巴細胞增殖,降低培養細胞上清液中IL-1、IL-6、TNF等炎癥細胞因子濃度。臨床上,青藤堿可有效緩解RA疼痛和局部炎癥。青藤堿不良反應顯示,少數病人出現皮疹或白細胞減少,停藥后即可消失。對本品過敏者禁用,孕婦及哺乳期婦女慎用[20]。
6 SAIDs
糖皮質激素(glucocorticoid)起效快,可用于控制急性期病變,可減少T淋巴細胞、嗜酸性粒細胞和單核細胞,抑制白介素合成和釋放,降低補體和免疫球蛋白。常與傳統DMARDs藥物聯合應用,延緩RA早期關節破壞,改善關節功能。糖皮質激素是治療SLE最有效的藥物之一,特別是治療LN的首選基礎藥物。對控制IBD急性發作有較好療效,有效率高達90%,主要用于中、重度或經氨基水楊酸類制劑治療無效的UC、活動性及兒童和青春期生長發育遲緩的CD等。糖皮質激素不良反應多,停藥后會復發,目前臨床多主張與其他免疫抑制劑聯合使用。近些年研究表明,低劑量糖皮質激素有疾病調修特性,特別對早期RA患者,可減慢RA病情進展,不良反應小。糖皮質激素不作為治療RA首選藥物,但在下述情況可選用:①伴隨類風濕血管炎,包括多發性單神經炎、類風濕肺及漿膜炎、虹膜炎等;②在重癥RA患者過渡治療,可用小量糖皮質激素快速緩解病情,一旦病情控制,應首先減少或緩慢停用糖皮質激素;③經正規DMARDs治療無效患者,可加用小劑量糖皮質激素;④對于關節腫脹明顯、受累關節少、全身治療有禁忌的患者,可行關節腔內注射,此療法與口服相比全身不良反應小,可短期小劑量應用[3]。
7 SRIIR藥物
上述NSAIDs、SAIDs、傳統DMARDs、生物制劑、JAK抑制劑等治療自身免疫病,療效確切,但也存在胃腸道癥狀、免疫抑制、骨髓抑制、感染、新生腫瘤等不良反應。特別是靶向細胞因子、受體或信號分子的藥物,通過阻斷某一分子或受體,而完全阻斷下游信號,導致細胞功能過度抑制,甚至凋亡,這可能是臨床出現不良反應的重要機制之一。因此,研發具有抗炎免疫調節作用的SRIIR藥物將是研究者關注的熱點。SRIIR藥物是一類選擇性調控機體組織細胞功能、基因和蛋白異常變化所致的病理狀態恢復至生理水平的藥物,其作用機制可能是調控異常信號通路中某一個或幾個關鍵信號分子的活性,來適度恢復機體穩態平衡,在發揮治療作用時,盡量不損害生理功能,以減少不良反應。芍藥苷-6-氧-苯磺酸酯(代號CP-25)來自于天然藥物活性成分芍藥苷的結構修飾[21]。CP-25能夠通過下調炎癥介質的產生和免疫應答而抑制大鼠佐劑性關節炎和小鼠膠原性關節炎的炎癥,減輕骨損傷[22-23]。CP-25緩解SS模型小鼠癥狀,增加流涎率,減少腺體組織T細胞浸潤,降低血清細胞因子IFN-γ、IL-4、 IL-6和IL-17A水平[24]。體外,CP-25通過下調CD40、CD80、CD83、CD86和MHC-Ⅱ的表達,來抑制PGE2或TNF-α刺激的樹突狀細胞成熟。CP-25下調BAFF刺激的B細胞增殖,下調CD19+B細胞、CD19+CD20+B細胞、CD19+CD27+B細胞和CD19+CD20+CD27+B細胞百分比,抑制BAFFR、TRAF2和p52的表達。CP-25與Etanercept、Rituximab療效比較,CP-25是適度下調上述異常升高的指標,而Etanercept和Rituximab是過度抑制上述指標至正常水平以下[25]。進一步探討CP-25的作用機制和調控靶點,發現CP-25對一些信號通路中關鍵調節蛋白的活性有調控作用,進一步調控異常信號通路。這些研究提示,CP-25可能是不良反應少、新的SRIIR藥物。
8 總結與展望
總之,隨著對自身免疫病病理機制的深入闡明和新藥物靶點的發現,治療炎癥免疫病的藥物除了NSAIDs、SAIDs、傳統DMARDs外,靶向細胞因子和細胞表面分子的新型生物制劑獲得較快發展。生物制劑通過阻斷炎癥細胞因子或細胞表面分子而發揮治療作用,如靶向IL-1、IL-6、TNF-α和IL-17的單克隆抗體,抗CD20單抗、BAFF抑制劑、T細胞抑制劑、整合素單克隆抗體、選擇性黏附分子抑制劑等。靶向JAK/STAT信號通路的多個小分子藥物,如Tofacitinib、Baricitinib、Upatacitinib、Filgotinib等,近年來也被研發應用于臨床。這些藥物療效確切,但也存在胃腸道癥狀、免疫抑制、骨髓抑制、感染新生腫瘤等不良反應。研發具有抗炎免疫調節作用的SRIIR藥物,將是研究者追求的目標。CP-25可能是新的SRIIR藥物,治療自身免疫病將具有潛在前景。控制炎癥免疫反應相關細胞過度活化,且不損害其生理功能的SRIIR藥物,是治療自身免疫病藥物研發的新策略和主要方向之一。