脂多糖應答分子LRG參與內毒素預處理誘導腦缺血耐受機制的研究
王 瑜,徐廣民,曾 思,張 鵬,雷 遷
(四川省醫學科學院·四川省人民醫院麻醉科,四川 成都 610072)
腦缺血預處理可誘導腦細胞及神經元對持續性缺血的耐受,可能會預防和保護缺血再灌后的腦損傷[1,2]。有研究證實了腦缺血預處理(IPC)誘導耐受現象的器官普遍性[3]。研究發現部分內源性物質,也可以誘導類似腦缺血耐受的發生,例如脂多糖(LPS)預處理可以誘導大鼠腦缺血耐受,顯示有部分神經保護作用,但其作用機制尚不清楚[4~6]。2016年9月至2018年9月我院開展研究,探討脂多糖應答分子LRG參與內毒素預處理誘導的腦缺血耐受的作用機制,為臨床治療腦缺血性疾病提供可行性理論支持。
1 材料與方法
1.1 材料①實驗動物:健康8周齡C57雄性小鼠80只,清潔級,體重(22±3)g,購自四川省人民醫院實驗動物研究所。②實驗試劑:MTT、LPS、DMSO(Escherichia coli,O111:B4)均購自于美國Sigma公司;0.25%Trypsin-0.02%EDTA、DMEM/F12、抗生素均購自于賽默飛公司;胎牛血清購自四季青公司;小鼠TNF-α、IL-6、TNF-1β ELISA試劑盒均購自深圳達科為生物技術有限公司。③實驗儀器:帶針縫合線(中國強生醫療器械有限公司);AL104電子天平(上海民橋精密科學儀器有限公司公司);SZM45體視顯微鏡(深圳博宇); R4100酶聯免疫檢測儀(Dynateeh,美國);超聲細胞破碎儀(Sonics&Meterials公司);MicroCL 21R 離心機(Thermo Scientific,德國);power PAC 2000電泳儀(Biorad公司)。
1.2 方法
1.2.1小鼠腦皮質原代細胞神經元的分離培養 取新生健康小鼠(<24 h),75%冰乙醇浸泡10 min,在無菌環境下斷頭處死,快速取出大腦組織,置于冷的D-PBS中。將0.25%胰蛋白酶加入到徹底剪碎的腦組織中充分消化后,用DMEM-F12(含10%FBS)培養制成單細胞懸液。再將其接種在培養瓶中(密度1×106個/ml),并置于培養箱中培養。4 h后,將種植液換成神經元基礎培養基,繼續維持培養,隔3天以半量神經元基礎培養基換液(實驗方法參照文獻[7])。
1.2.2LPS預處理后檢測神經元細胞中LRG分子的蛋白水平 分離出純化的神經元細胞,在6孔板上以1×106/孔的密度做細胞培養,并分為control組、LPS直接刺激組、LPS預刺激組。其中預刺激組先用0.01 μg/ml脂多糖預刺激18 h,然后用1 μg/ml脂多糖再刺激6、24、48 h。將RIPA裂解液加入收集細胞,4 ℃裂解30分鐘,12000 ×g 4 ℃離心,上清即為蛋白液。BCA試劑盒測樣品蛋白濃度,調濃度均一化。上樣同等量蛋白樣電泳,80 v恒壓電泳2 h后,進行電轉膜,17 V恒壓轉膜30 分鐘,封閉液封閉4 h,后加入特異性脂多糖應答分子一抗,4 ℃孵育過夜,1×TBST洗3次,每次5分鐘,然后加入對應的二抗,重復上述的孵育和清洗過程,洗去未結合的二抗,最后X射線膠片曝光分析,利用Image J軟件分析灰度值。
1.2.3體外神經元缺血再灌注模型的建立 將LRG表達下降的神經元細胞,野生型神經元細胞放入密閉恒溫裝置,細胞培養液換為不含糖的人工腦脊液(NaCl 123 mmol/L,KCl 3.75 mmol/L,KH2PO41.25 mmol/L,NaHCO326 mmol/L,MgCl21 mmol/L,CaCl22 mmol/L,pH 7.4)。溫度為(30±2)℃,混合氣體組成為5%CO2、94%N2和1% O2,10 min后培養液更換為有10 mmol/L葡萄糖的人工腦脊液,將細胞置于培養箱中,于37 ℃培養1小時構建出缺血再灌注模型。
1.2.4神經元細胞細胞活性的檢測 取96孔板,將3組細胞接種于板子上(密度8×103),每孔100 μl。均設置3個復孔,每個孔再加入20 μl MTT溶液(5 g/L MTT溶于PBS中),37 ℃孵育4 h(避光),丟棄上清,每個孔再加入100 μl DMSO,振蕩10 min,待藍紫色結晶充分溶解后,用酶標儀在490 nm波長處測定其吸光度,以檢測各組神經元的活細胞數量。
1.2.5檢測LPS預處理后小鼠腦缺血再灌注模型中LRG的變化 ①小鼠腦缺血再灌注模型的建立:隨機數字表法將30只C57雄性小鼠分為3組,LPS預處理+腦缺血再灌注(MCAO)模型組10只小鼠,建立模型前3天,腹腔注射200 μl 0.2 mg/kg LPS(E.coli 0111:B4,L-2630,Sigma);腦缺血再灌注(MCAO)模型組10只小鼠,注射200 μl無菌生理鹽水;上述兩組小鼠,均術前12 h禁食,采用大腦中動脈線栓法(MCAO)[7],小鼠大腦中動脈缺血1 h后,恢復血流,建立再灌注24 h模型。假手術對照組10只小鼠,術前12 h禁食,僅分離頸總動脈,不做缺血處理,其余操作均同手術組。②Western Blot檢測腦組織中LRG蛋白水平的變化:再灌后24 h,麻醉小鼠,取小鼠大腦組織用PBS(pH 7.4)灌流,清洗干凈后,充分剪碎并加入裂解液裂解1 h,組織勻漿后12000×g 4 ℃,再離心10分鐘,上清即為蛋白液。BCA蛋白定量試劑盒測定LRG蛋白濃度,統一濃度為5 μg/μl。上樣同等量蛋白樣品電泳,80 V恒壓電泳2 h后,進行電轉膜,17 V恒壓轉膜30分鐘,封閉液封閉2-4小時,后加入特異性脂多糖應答分子一抗,4 ℃孵育過夜,1×TBST洗3 次,每次5分鐘,然后加入對應的二抗,重復上述的孵育和清洗過程,洗去未結合的二抗,最后X射線膠片曝光分析,利用Image J軟件分析灰度值。
1.2.6檢測LRG基因沉默型小鼠腦缺血再灌注損傷 ①尾靜脈注射LRG RNAi慢病毒載體,構建針對LRG基因沉默型小鼠8只,野生型C57雄性小鼠8只,采用前述方法建立MCAO模型。假手術組C57雄性小鼠8只,不做缺血處理。②神經功能評分。手術完畢,待小鼠自然蘇醒后,重新放回鼠籠,給予自由飲食。達到24小時后,根據Garcia評分法[8]評價并記錄分數。③Western Blot檢測腦組織中LRG蛋白水平的變化。采用1.2.5中的方法,檢測各組之間神經系統中腦組織脂多糖應答分子的蛋白表達水平。④ELISA試劑盒檢測血清中炎性因子IL-1β,IL-6,TNF-α的水平。再灌注24 h后,摘眼球取血于1.5 ml EP管中。室溫靜置2 h后,3000 rpm,4 ℃離心10分鐘,上清液即為血清,轉移到1.5 mL離心管中備用。采用ELISA試劑依次檢測血清中IL-6,IL-1β,TNF-α的含量。
1.3 統計學方法采用SPSS 22.0軟件處理數據。計量資料以均數±標準差表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析及q檢驗。P< 0.05為差異有統計學意義。
2 結果
2.1 LPS預處理后不同時間點刺激神經元表達LRG的水平Western Blot檢測各組神經元表達LRG的水平,結果顯示,與control組比較,LPS直接刺激組神經元細胞表達LRG水平顯著增加(P< 0.05);與LPS直接刺激組比較,LPS預處理組LRG表達水平下調(P< 0.05)。LPS預處理后再刺激6、24、48 h神經元表達LRG水平均降低(P< 0.05),但隨著時間的增加,LRG表達水平增加,呈時間依賴性,見圖1。
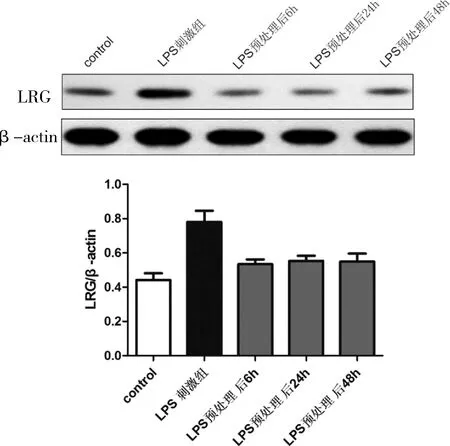
圖1 LPS預處理后對神經元細胞表達LRG的蛋白水平
2.2 LRG表達下降型神經元在體外缺血再灌模型中的細胞活力利用MTT法檢測不同組在體外缺血再灌后神經細胞活性發生的變化。結果表明,與假手術對照組(101.6±3.7)比較,神經元細胞在腦缺血再灌注(MCAO)模型組(39.7±6.4)中,細胞活力下降(P< 0.01)。與腦缺血再灌注(MCAO)模型組比較,LRS預處理+腦缺血再灌注(MCAO)模型組(53.3±4.2%)中神經元細胞活力較好,差異有統計學意義(P< 0.05)。
2.3 LPS預處理小鼠腦缺血再灌注模型中LRG的表達水平Western Blot檢測小鼠腦缺血再灌模型組腦組織的LRG蛋白表達水平。與假手術對照組比較,MCAO模型組LRG蛋白表達水平顯著增加(P< 0.05)。與MCAO模型組比較,LPS預處理+MCAO模型組LRG蛋白表達水平下調(P<0.05)。見圖2。
2.4 LRG基因沉默型小鼠神經功能的影響腦缺血再灌注24 h后,假手術組中行為學結果顯示,神經功能評分0分,沒有神經功能缺損癥狀。MCAO模型組中小鼠神經功能缺損(2.89±0.39),行為異常,差異顯著(P< 0.01)。與MCAO模型組比較,LRG基因沉默型小鼠+MCAO模型組小鼠神經功能評分較低(1.77±0.61),差異有統計學意義(P< 0.05)。
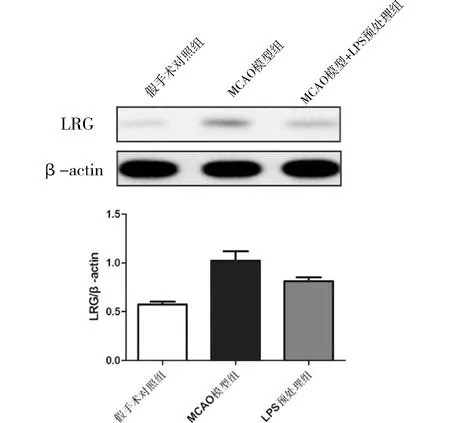
圖2 不同組中腦組織表達LRG的水平
2.5 LRG基因沉默型對腦缺血再灌模型小鼠中LRG蛋白水平的影響腦缺血再灌注24 h后,Western Blot檢測腦組織中LRG的表達水平。結果顯示,與假手術對照組比較,MCAO模型組中LRG表達水平顯著上調。與MCAO模型組比較,LRG基因沉默型小鼠模型組LRG表達水平下調,差異有統計學意義(P<0.05)。見圖3。

圖3 不同組中腦組織表達LRG的水平比較
2.6 LRG基因沉默型小鼠腦缺血再灌組血清中其炎性因子IL-1β,TNF-α和IL-6變化利用ELSIA試劑盒檢測血清中其炎性因子IL-1β,TNF-α和IL-6的含量。結果顯示,與假手術對照組作比較,MCAO模型組中IL-1β、TNF-α、IL-6均顯著增加(P<0.05)。與MCAO模型組比較,LRG基因沉默型+MCAO模型組中IL-1β、TNF-α、IL-6均顯著下調(P<0.05)。見表1。

表1 LRG基因沉默型小鼠腦缺血再灌注后血清IL-1β,TNF-α和IL-6的變化
*與假手術對照組比較,P< 0.01;與MCAO模型組比較,#P< 0.05,##P< 0.01
3 討論
腦缺血再灌注損傷是一類腦血流供應受阻,缺血所致腦組織缺血缺氧引起的腦組織損傷引發的神經元凋亡及炎癥反應,最終影響機體神經功能的一類復雜腦血管性疾病。腦缺血再灌注是腦受損,神經功能缺失的主要原因。腦缺血/再灌注損傷的發生率、死亡率呈上升趨勢,形勢不容樂觀。非缺血性預處理是當前研究熱點之一,內毒素LPS預處理對腦缺血損傷耐受的交叉誘導和保護作用具有較好療效,但確切機制的研究沒有突破性進展,同時LPS預處理存在毒性和副作用,在臨床上應用存在困難[9,10]。
腦缺血再灌注過程中伴隨有炎癥反應的發生,炎癥級聯反應的發生是神經元功能性損傷的關鍵原因。再灌注發生時,腦血管內皮破損,氧自由基爆發,加重氧化應激的反應,激活炎癥細胞,促使大量炎性因子釋放入血[11~13]。其中炎性因子TNF-α能夠激活中性粒細胞,使之與白細胞粘附,募集,促進白細胞分泌大量粘附分子,加速炎癥反應的發生,導致腦組織持續損傷。IL-1β的爆發性釋放可以使內皮細胞激活,表達分泌粘附分子ICAM-1等,進一步募集大量炎癥細胞到缺血組織區,加重腦組織缺血損傷[14,15]。
作為炎癥反應發生的重要分子LPS,其在腦組織缺血再灌注中刺激炎癥反應發生的作用機制尚不明確。LPS預處理可以調節炎癥反應,增強機體缺血耐受。既然LPS預處理在臨床上不易實現,本研究探討了脂多糖應答分子LRG在腦缺血再灌中的作用機制。結果顯示,LRG基因沉默在腦缺血發生時,LRG表達下調,可以減緩腦缺血再灌損傷。同時血清中炎性因子含量減少,炎癥反應減少,表明LRG基因沉默可以調節炎癥反應,增強機體腦缺血耐受,保護腦組織。但是LRG調節炎癥反應的作用機制通路仍有待深入研究,只有完全明確LRG在調節炎癥反應,增強缺血耐受發揮腦保護作用,才能在臨床上探索替代LPS預處理的治療腦缺血再灌注的策略。

