Twist對結直腸癌HCT116細胞上皮-間質轉化、腫瘤干細胞表型轉化、化療抵抗的影響
鄧君健,張帆,包文婷,熊琳,劉遠識,范黎,徐細明
(武漢大學人民醫院,武漢430060)
結直腸癌(CRC)是臨床常見的腫瘤之一,其發病率居世界第三,而病死率居世界第四[1~4]。隨著年齡增大,CRC的發病危險系數逐漸升高,全世界每年約有120萬新發病例,同時每年約有60萬患者死于CRC。約20%的CRC患者有遠處轉移,轉移的臟器往往是肝臟。上皮-間充質轉化(EMT)是癌細胞遠處轉移的始動因素及基礎環節,EMT發生時,腫瘤細胞中的部分胚胎基因重編程,該過程可逆[5~8]。EMT的標志是上皮細胞間連接的溶解及細胞骨架的整體重組,從而導致上皮特征的喪失和間充質形態的獲得,這一變化由基因差異表達決定[9,10]。當前CRC的治療主要是手術切除及放化療,但伴隨放化療抵抗問題。腫瘤細胞EMT發生時,眾多EMT相關轉錄因子如ZEB1、ZEB2、TWIST、SNAIL的蛋白表達或活性急劇變化,調控下游系列基因簇的表達,與患者的預后相關[11]。EMT在增強細胞侵襲能力的同時,其相關的轉錄因子如SNAIL,還可促使癌細胞獲得腫瘤干細胞的特性,從而獲得放化療抵抗能力[12,13]。扭曲因子Twist是一種具有堿性螺旋-環-螺旋結構域的轉錄因子,可通過上調胚胎基因表達,介導胚胎的發育[14]。既往研究證實,Twist可促使腫瘤細胞部分基因簇重編程,從而調控腫瘤細胞的EMT行為[15],然而其在結直腸癌細胞中的更多作用,目前尚不清楚。我們前期研究發現,Twist在結直腸癌組織中的表達高于癌旁組織。2014年2月~2018年5月,我們以結直腸癌細胞系HCT116為研究對象,分析Twist對結直腸癌細胞EMT及干細胞表型、化療抵抗的影響。
1 材料與方法
1.1 材料 E-cadherin一抗購自美國Cell Signaling Technology公司,N-cadherin一抗、vimentin一抗、Twist一抗、P-gp一抗、α-tubulin一抗購自美國Santa Cruz Biotechnol公司。Bmi-1一抗、Nanog一抗購自美國Epitomics公司。Alexa Fluor 488/594標記的二抗、辣根過氧化物酶標記的二抗、DAPI染液及Lipofectamine 2000購自美國Invitrogen公司。PrimeScript一步法逆轉錄試劑盒RT及熒光定量PCR SYBR染液購自日本TAKARA公司。
1.2 細胞培養、轉染及分組 研究所用的人結直腸癌HCT116細胞購自上海中科院細胞典藏中心,培養條件:37 ℃、5%CO2,培養基為McCoy′5a,10%胎牛血清,抗生素。本研究所有細胞實驗分為兩組:空載體組及Twist過表達組(Twist組)。轉染前,將細胞HCT116種至6孔板中,次日將10%的培養基換為無血清培養基,2 h后,空載體組及Twist過表達組分別將2 μg的空載體pcDNA3.1或pcDNA3.1-Twist載體(采用脂質體2000包裹轉染),轉染至HCT116細胞。并在轉染6 h后,將培養基換為含10%胎牛血清不含抗生素的培養基,繼續培養48 h后收取細胞。
1.3 扭曲基因Twis對HCT116細胞的侵襲能力的影響檢測 采用博伊登小室進行分析,預先包被基質膠于小室內,隨后種植細胞,細胞體積和數量分別為300 μL、1×105個細胞,小室上下培養基不同,上層為1%胎牛血清,此層進行pcDNA3.1或pcDNA3.1-Twist載體轉染,下層為10%胎牛血清,此層培養基作為趨化劑,誘導細胞侵襲。細胞培養48 h后,終止培養。以棉花拭子去除包被的基質膠,加入PBS洗滌,隨后以濃度為4%的多聚甲醛固定30 min,加入結晶紫染色,拍照分析。每組實驗均重復3次。
1.4 Twis對HCT116細胞EMT影響檢測 ①Western blotting法。培養的細胞以預冷的PBS洗滌3次,于冰上加入碧云天公司弱型RIPA裂解液進行細胞裂解,反復吹打至細胞脫落,將細胞懸液轉移EP管中,隨后冰上超聲破碎細胞,繼續裂解30 min。將樣品于4 ℃低溫離心機中,12 000 r/min離心15 min,隨后吸取上清,測定空載體組及Twist組蛋白濃度,加入Loading buffer 100 ℃煮至蛋白變性,迅速降溫,置于-80 ℃冰箱低溫保存,直至使用。蛋白表達差異檢測,采用Bio-rad公司的蛋白電泳系統,程序如下:SDS-PAGE膠蛋白電泳完畢后,將蛋白電轉至 PVDF膜,再以濃度為5%的脫脂牛奶在室溫下封閉2 h。以TBST洗滌PVDF膜后,加入E-鈣黏蛋白,波形蛋白vimentin一抗工作液過夜(濃度為1∶1 000)。次日,于室溫下復溫1 h,再次以TBST洗脫,加入辣根過氧化物酶標記的二抗工作液進行孵育(濃度為1∶10 000),再依次洗滌,曝光,拍照并分析。②免疫熒光法。培養的細胞以預冷的PBS洗滌3次,加入4%多聚甲醛固定10 min,0.1%的Triton100打孔20 min。隨后加入E-鈣黏蛋白,波形蛋白vimentin一抗工作液過夜(濃度為1∶100),4 ℃孵育過夜,次日加入熒光二抗工作液(1∶500),37 ℃孵育1 h,PBS洗滌后拍照分析。
1.5 腫瘤干細胞標志物蛋白表達檢測 細胞轉染48 h后,通過光鏡觀測細胞形態變化,采用Western blotting法檢測兩組腫瘤干細胞標志物Bmi-1、Nanog、CD44表達。
1.6 細胞活力檢測 將細胞種植于96孔板中,細胞密度為1×104,空載體組與Twist組分別進行空載體pcDNA3.1或Twist載體轉染,細胞轉染48 h后分別加入抗腫瘤藥物奧沙利鉑刺激,奧沙利鉑設置0~10 μmol/L的梯度濃度。測試之前,以PBS洗滌細胞,隨后加入MTT試劑,37 ℃孵育4 h,隨后去除孵育試劑,置換為DMSO溶液,于570 nm波長處測定細胞活力。
1.7 P-gp蛋白表達檢測 HCT116細胞轉染pcDNA3.1、Twist過表達質粒48 h后,采用 Western blotting法檢測P-gp蛋白表達。
1.8 化療抵抗相關分子ABCB1、ABCC1、ABCC2、ABCC3、ABCC4、ABCC5、ABCG2、ERCC1、XRCC1、MSH2、TUBB3、POLH、GSTπ、γ-GT1蛋白表達檢測 采用酚氯仿法萃取提取化療抵抗相關分子RNA。向細胞培養板中加入TRIzol,反復吹打,吸取至EP管,室溫靜置10 min后,加入氯仿萃取,TRIzol∶氯仿=5∶1。再次室溫靜置15 min,4 ℃低溫下,12 000 r/min離心15 min,隨后小心吸出上層水相,加入等體積的異丙醇沉淀RNA,混勻后4 ℃低溫過夜。次日4 ℃低溫下,12 000 r/min離心10 min,獲得RNA,再依次以75%、95%乙醇洗滌RNA沉淀,隨后加入DEPC水溶解RNA。采用日本TAKARA公司的一步法逆轉錄cDNA合成試劑盒合成cDNA。每次反應采用的RNA為1 μg、20 μL體系。PCR反應程序:37 ℃ 15 min,85 ℃ 5 s,降溫至4 ℃。待反應完成,立即將樣本取出,并置于-80 ℃冰箱保存。采用TAKARA公司的熒光定量PCR Mix Buffer進行定量擴增反應,反應體系為20 μL,反應程序:95 ℃預變性5 min,隨后進行39個循環擴增,包括95 ℃ 1 min,58 ℃ 30 s,最后5 min溶解曲線。PCR結果采用GAPDH校正,以校正值為統計值。
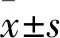
2 結果
2.1 兩組細胞侵襲能力比較 Twist組HCT116細胞的形態由圓形向長梭形態分化,空載體組與Twist組HCT116細胞穿膜細胞數分別為(6.24±0.89)、(26.83±1.02)個/HP,兩組比較,P<0.05。
2.2 兩組E-鈣黏蛋白、波形蛋白表達比較 空載體組與Twist組EMT相關分子蛋白E-鈣黏蛋白相對表達量分別為0.82±0.09、0.24±0.04,波形蛋白相對表達量分別為0.12±0.02、1.05±0.12,兩組E-鈣黏蛋白、波形蛋白表達比較,P均<0.05。
2.3 兩組細胞向腫瘤干細胞表型轉化情況比較 過表達Twist可顯著上調HCT116細胞成球能力,空載體組與Twist組HCT116細胞成球數量分別為(2.43±0.14)、(10.19±0.58)個/HP,兩組比較,P<0.05。熒光定量PCR及Western blotting檢測結果顯示,Twist可促進腫瘤干細胞標志物Bmi-1、Nanog、CD44表達,空載體組與Twist組干細胞相關分子Nanog相對表達量分別為0.06±0.01、0.88±0.07,Bmi1相對表達量分別為0.23±0.04、1.26±0.88,CD44相對表達量分別為1.45±0.09、8.92±0.89,兩組Nanog、Bmi1、CD44表達比較,P均<0.05。
2.4 兩組細胞對化療藥物的抵抗能力及P-gp蛋白表達比較 上調Twist可顯著抑制化療藥物奧沙利鉑對HCT116細胞的殺傷作用,在高濃度藥物情況下,產生明顯抵抗。Twist可顯著上調ABCB1的表達,而對其余分子表達變化并無影響。Twist可顯著上調ABCB1基因的編碼產物P-gp蛋白表達。Twist組在奧沙利鉑濃度0、0.1、1、5、10 μmol/L刺激HCT116細胞后細胞活力分別為1.00±0.08、0.84±0.09、0.70±0.10、0.53±0.07、0.48±0.06,空載體組分別為1.00±0.07、0.76±0.08、0.58±0.05、0.27±0.04、0.08±0.04,奧沙利鉑各濃度刺激HCT116細胞后兩組細胞活力比較,P均<0.05。奧沙利鉑刺激HCT116細胞后,Twist組腫瘤化療抵抗相關的調控分子 ABCB1、ABCC1、ABCC2、ABCC3、ABCC4、ABCC5、ABCG2、ERCC1、XRCC1、MSH2、TUBB3、POLH、GSTπ、γ-GT1蛋白相對表達量分別為3.20±0.35、1.10±0.11、1.14±0.18、1.09±0.09、0.88±0.09、1.09±0.12、1.30±0.14、0.98±0.10、1.02±0.13、1.13±0.08、1.42±0.25、1.09±0.08、0.92±0.10、1.29±0.35,空載體組分別為1±0.10、1±0.14、1±0.13、1±0.15、1±0.09、1±0.12、1±0.11、1±0.15、1±0.14、1±0.13、1±0.15、1±0.09、1±0.15、1±0.17,兩組ABCB1表達比較,P<0.05。
3 討論
基因的異常激活是CRC獲得惡性表型的始動因素之一,腫瘤細胞的EMT表型轉化是化療抵抗產生原因之一,而EMT相關的驅動分子同時亦可促使腫瘤細胞向干細胞表型轉化。腫瘤干細胞具有無限增殖、遭受打擊時保持休眠的特點,從而在放化療刺激下保證存活,并在適當時機再次惡性增殖、轉移,導致CRC的復發。然而當前關于結直腸癌的治療措施仍是傳統手術切除及放化療,進展緩慢,術后復發及放化療抵抗等遠期不良預后仍較常見[19]。腫瘤細胞放化療抵抗是患者不良預后的主要原因,腫瘤細胞在遭受放化療的初次打擊后,部分細胞殘存下來,成為異質細胞群,該群細胞具有增殖及侵襲能力、抗打擊能力強的特點。部分細胞獲得了腫瘤干細胞特性,腫瘤干細胞具有自我更新和無限增殖的能力,同時其轉移能力強大,并可在損傷打擊下進行休眠,從而逃避打擊[20,21]。
EMT是高度協調的動態過程,以上皮細胞失去少部分或多數上皮特征并呈現間充質表型為特點。上皮細胞向間充質細胞的轉化在胚胎發育過程中必不可少,EMT的產生可促使胚胎期細胞間黏附及極性喪失,從而獲得遷移和侵入能力。胚胎期細胞的EMT對機體的正常發育有積極作用,而成熟細胞EMT的異常激活則利于腫瘤的發生、侵襲、轉移,并獲得治療抵抗力。腫瘤細胞EMT及治療抵抗時,腫瘤細胞的轉錄組重編程,眾多基因簇表達失衡[22]。通過過表達手段我們發現,扭曲基因Twist可促使HCT116細胞形態轉變為梭型,且上調其侵襲能力。Twist可顯著上調EMT相關標志物vimentin表達,而抑制上皮相關的E-鈣黏蛋白表達,提示Twist可通過轉錄及翻譯層面調控CRC細胞的EMT變化,促使其侵襲并轉移至其他組織或器官。
腫瘤細胞EMT相關的部分轉錄因子snail、Twist可驅動腫瘤干細胞相關基因表達,從而促使腫瘤細胞獲得干性[19]。干細胞具有體外培養時成球的特性。本研究結果發現,Twist可促使HCT116細胞成球并可上調腫瘤干細胞標志物Bmi-1、Nanog、CD44表達。腫瘤細胞發生EMT、干細胞表型轉換時,其增殖及抗凋亡能力將顯著上調,我們的研究證實,過表達Twist的HCT116細胞在遭受奧沙利鉑打擊時,其活力相較對照細胞顯著上調。提示Twist在促使HCT116細胞EMT及干細胞表型轉化之后,導致其對化療藥物的打擊失去了敏感性。進一步研究發現,Twist對HCT116細胞的化療抵抗調控作用是通過ABCB1/P-gp途徑實現的。既往研究表明,P-gp是能量依賴性“藥泵”調節分子,可通過消耗ATP將腫瘤細胞內的化療藥物逆濃度泵至細胞外,從而降低腫瘤細胞內化療藥物濃度,促使腫瘤細胞產生耐藥性。
綜上所述,Twist可促使結直腸癌HCT116細胞發生EMT表型轉化,獲得干細胞特性,進一步通過ABCB1/P-gp途徑,增強其自身耐藥。

