酶聯免疫吸附測定法檢測白條鴨表皮組織中的脫氫松香酸
仇新媛 姚忠 耿志明 馬晶晶 李鵬鵬
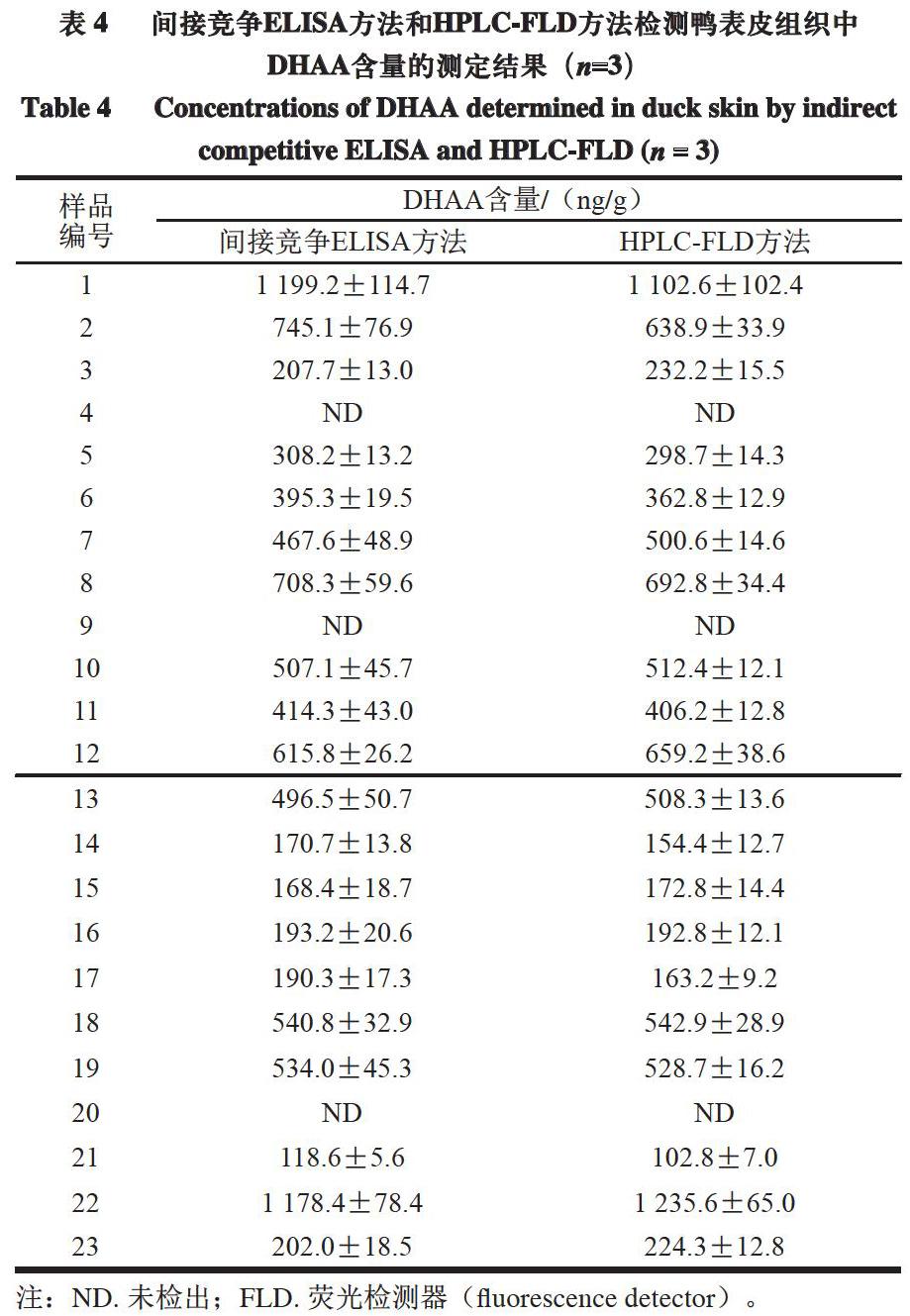
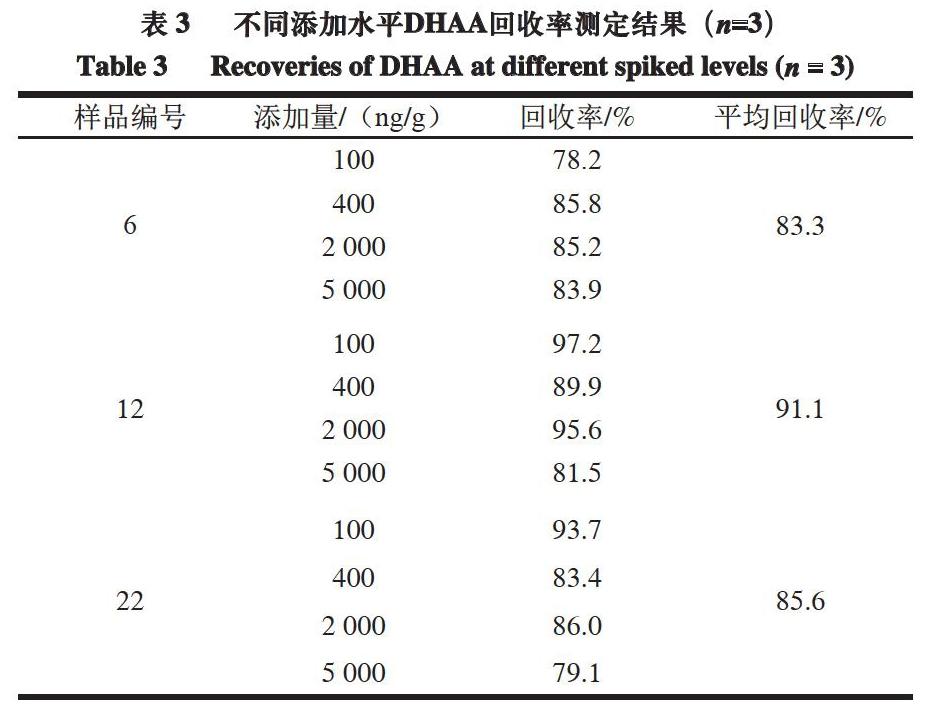
摘 要:通過優化抗原包被質量濃度、抗體稀釋倍數及二抗稀釋倍數等參數,建立白條鴨表皮組織中脫氫松香酸(dehydroabietic acid,DHAA)含量的間接競爭酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)方法。白條鴨表皮組織中的DHAA用甲醇提取,經磷酸鹽緩沖液稀釋,使用酶標板進行檢測。結果表明:最佳抗原包被質量濃度為1.0 ?g/mL,最佳抗體稀釋倍數為1∶6 400,最佳二抗稀釋倍數為1∶10 000;ELISA方法的檢測限及檢測范圍分別為41.0 ng/g和100.0~20 150.0 ng/g;在100~5 000 ng/g添加量范圍內,DHAA回收率為78.2%~97.2%;實際樣品分析結果顯示,市場流通領域中白條鴨表皮組織中DHAA的檢出率達到87%,含量范圍為118.6~1 199.2 ng/g。
關鍵詞:白條鴨表皮組織;松香;脫氫松香酸;殘留;酶聯免疫吸附測定
Abstract: An indirect competitive enzyme-linked immunosorbent assay (ELISA) was developed for determination of dehydroabietic acid (DHAA) in duck skin. DHAA in duck skin samples was extracted with methanol, followed by dilution with phosphate buffer saline (PBS), and determined by an ELISA reader. Results indicated that the optimal coating antigen concentration and the optimal dilution of antiserum were found to be 1.0 ?g/mL and 1:6 400, respectively, while the optimal dilution of HRP-IgG antibody was 1:10 000, the limit of detection and the working concentration range were 41.0 ng/g and from 100.0 to 20 150.0 ng/g respectively. The recoveries from spiked samples at concentration levels of 100–5 000 ng/g were in the range of 78.2%–97.2%. When the method was applied to real samples, DHAA was detectable in up to 87% of the samples at levels of 118.6–1 199.2 ng/g.
Keywords: duck skin; rosin; dehydroabietic acid; residue; enzyme-linked immunosorbent assay
DOI:10.7506/rlyj1001-8123-20190909-214
中圖分類號:TS207.3? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A 文章編號:1001-8123(2019)12-0045-05
松香是來源于松樹的一種天然物質,包含多種樹脂酸,其中松香酸(abietic acid,AA)和脫氫松香酸(dehydroabietic acid,DHAA)是其主要成分。AA和DHAA能顯著抑制水蚤、虹鱒魚等的生長發育[1]。在細胞毒理學方面,AA可導致人體肺泡上皮細胞溶解,而DHAA能夠促進人體上皮細胞、成纖維細胞死亡并對人體紅細胞有毒害作用[2]。作為一種普通工業原料,松香被廣泛用于肥皂、造紙、油漆涂料等領域。AA和DHAA廣泛存在于造紙廠廢水中,在日用消費品,如藥劑、化妝品等中也常有檢出,甚至可以通過包裝材料遷移進入食品中[3-4]。
因加熱后具有優良的黏附特性,松香曾被畜禽屠宰加工企業廣泛用于畜禽屠宰,尤其是鴨(鵝)屠宰的二次脫毛。值得關注的是,殘留在水禽胴體中的AA和DHAA經過烹飪加工后依然殘留在水禽肉制品中,給消費者健康帶來潛在危害[5]。2009年,我國《食品安全法》禁止在畜禽屠宰中使用松香脫毛,但是中小畜禽加工企業違禁使用松香脫毛的現象仍然十分嚴重。
AA和DHAA作為松香殘留的主要標志物,一般通過氣相色譜(gas chromatographic,GC)法和高效液相色譜(high performance liquid chromatography,HPLC)法進行分析[6-8]。相對而言,HPLC的應用更為普遍[9-11]。酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)法靈敏度高,具有特異性強、成本低、檢測容量大等特點,適用于大批量樣本中微量污染物的快速分析[12-14]。近年來,ELISA技術發展迅速,除醫藥、臨床領域外,在環境監測、食品安全等方面也獲得廣泛應用,并已成為有機污染物殘留快速檢測的主要分析手段之一[15-17]。本課題前期建立了水禽肉制品中AA和DHAA同時測定的HPLC-紫外-熒光分析方法,同時成功合成了DHAA的人工抗原,并通過免疫新西蘭大白兔制備了多克隆抗體[18-20]。因此,本研究通過優化抗原包被質量濃度、抗體稀釋倍數及二抗稀釋倍數等參數,進一步建立白條鴨表皮組織中DHAA含量的間接競爭ELISA檢測方法,為畜禽產品中松香殘留快速分析方法標準的制定提供參考。
1 材料與方法
1.1 材料與試劑
23 種品牌冷凍白條鴨 南京冷鏈批發市場。
AA標準品(純度95%) 北京百靈威科技有限公司;DHAA標準品(純度98%)、異海松酸標準品(純度98%)、長葉松酸標準品(純度97%)、海松酸標準品(純度95%) 北京樂博生物科技有限公司;辣根過氧化物酶(horseradish peroxidase,HRP)標記羊抗兔免疫球蛋白G(immunoglobulin G)(IgG-HRP) 上海拜力生物科技有限公司;其他化學試劑均為分析純。
1.2 儀器與設備
Epoch2全波長酶標儀 美國伯騰儀器有限公司;Biofuge stratos高速離心機 德國Heraeus公司;T25高速勻漿機 德國IKA公司;酶標板 上海源葉生物科技有限公司。
1.3 方法
1.3.1 DHAA人工抗原合成及抗體制備
前期研究中合成了DHAA的人工抗原并制備了多克隆抗體[21]。簡述如下:以脫氫松香胺(dehydroabietylamine,DHAM)作為半抗原,首先與琥珀酸酐(succine anhydride,SUC)進行酰化反應,生成DHAM-SUC,通過紅外光譜、核磁共振及質譜進行表征;DHAM-SUC進一步分別與牛血清蛋白(bovine serum albumin,BSA)和鑰孔血藍蛋白(keyhole limpet hemocyanin,KLH)進行偶聯反應,合成完全抗原DHAM-SUC-BSA和DHAM-SUC-KLH,偶聯比分別為12∶1和35∶1;用DHAM-SUC-KLH免疫家兔,制備、純化抗血清;以DHAM-SUC-BSA為包被抗原,采用間接ELISA測定抗血清滴度。結果表明,4號新西蘭大白兔的抗血清效價達1.28×105,可以用于建立白條鴨表皮組織中DHAA含量的間接競爭ELISA方法。
1.3.2 標準溶液的配制
稱取適量的DHAA標準品,用甲醇配制成質量濃度為1 mg/mL的標準儲備液;用磷酸鹽緩沖液(phosphate buffer saline,PBS)稀釋成質量濃度分別為10、20、40、80、160、320、640、1 280、2 560、5 120 ng/mL的系列工作溶液。
1.3.3 間接競爭ELISA測定步驟
參考Gurmit等[22]的方法。以一定質量濃度的抗原包被96 孔酶標板,每孔100 μL,4 ℃孵育過夜;12 h后傾去孔內液體,用磷酸鹽-吐溫緩沖液(phosphate buffer saline with Tween-20,PBST)洗滌3 次,每次5 min,在干凈的吸水紙上拍干;用質量濃度2 g/100 mL明膠(純水配制)進行封閉,每孔100 μL,37 ℃孵育1 h,PBST洗滌3 次后拍干;加入系列質量濃度的標準溶液(或被檢抗原)和一定稀釋倍數的抗血清,按體積比1∶1混合后,每孔100 μL,37 ℃孵育2 h,PBST洗滌3 次后拍干;加入一定稀釋倍數的羊抗兔IgG-HRP,每孔100 μL,37 ℃孵育5 min,PBST洗滌3 次后拍干;加入新鮮配制的四甲基聯苯胺底物溶液,每孔100 μL,顯色10 min;每孔加入50 μL 2 mol/L濃硫酸終止反應;反應結束后,用酶標儀在450 nm波長處測定各孔光密度(optical density,OD) 值。以標準溶液質量濃度的對數為橫坐標,抑制率為縱坐標,繪制抑制率曲線。抑制率按下式計算。
1.3.4 樣品前處理
參考張蘇珍等[23]的方法,并稍作修改。分別在每只肉鴨頸、翅、胸、背、腿5 個部位取表皮組織,剪碎、混合均勻備用。稱取2 g混合樣品置于10 mL離心管,加入4 mL甲醇,超聲振蕩15 min后4 000 r/min離心5 min,取1 mL上清液加入1.5 mL PBS混合后待ELISA檢測。
1.4 數據處理
測定結果均用平均值±標準差表示,采用SPSS statistics 17.0軟件對數據進行相關性分析。
2 結果與分析
2.1 間接競爭ELISA條件的優化
在前期實驗中,利用DHAM為半抗原合成了DHAA的完全抗原,并通過免疫新西蘭大白兔制備了多克隆抗體。合成的松香人工抗原具有理想的免疫原性,獲得的多克隆抗體具有較好的靈敏度[21]。本研究在前期研究的基礎上通過優化一系列參數,包括抗原包被質量濃度、抗體稀釋倍數、二抗稀釋倍數等,建立白條鴨表皮組織中DHAA殘留檢測的間接競爭ELISA方法。
采用三維滴定法確定最佳抗原包被質量濃度及抗體稀釋倍數。設置抗原包被質量濃度范圍為0.0~4.0 μg/mL,抗體稀釋倍數范圍為1∶800~1∶12 800。由圖1可知,按照OD450 nm接近于1.0所對應實驗組合為最佳組合的標準,確定包被抗原質量濃度為1.0 μg/mL,抗體稀釋倍數為1∶6 400。
采用單因素控制法,在1∶5 000、1∶10 000、1∶20 000、1∶40 000、1∶80 000二抗稀釋倍數條件下分別進行間接競爭ELISA分析,按照陽性血清OD450 nm/陰性血清OD450 nm比值最大的選取原則,確立二抗稀釋倍數為1∶10 000。
2.2 線性范圍、檢出限配制質量濃度范圍為10~10 240 ng/mL的DHAA標準溶液,在最優條件下進行間接競爭ELISA分析,繪制抑制率曲線。結果表明,線性范圍為10~5 120 ng/mL,回歸方程為y=26.03x-13.87(R2=0.992),式中:x為標準溶液質量濃度的對數,y為抑制率。
在間接競爭ELISA方法中,最低檢測限定義為抑制率10%對應的分析物質量濃度,工作質量濃度范圍定義為抑制率20%~80%對應的分析物質量濃度。通過線性回歸方程計算可知,方法檢測限為8.2 ng/mL,工作質量濃度范圍為20.0~4 030.0 ng/mL,抑制率50%時對應的分析物質量濃度為283.8 ng/mL。根據鴨表皮組織的前處理條件,鴨表皮組織中DHAA的檢測限及檢測范圍分別為41.0 ng/g和100.0~20 150.0 ng/g。根據Zhu Yongzhi等[24]的報道,使用松香脫毛后,鴨表皮組織中的DHAA含量范圍為160~3 750 ng/g。因此本研究建立的間接競爭ELISA方法工作質量濃度范圍可以滿足鴨表皮組織中DHAA的檢測需求。
2.3 交叉反應實驗
松香是樹脂酸混合物,除了AA和DHAA還包括其他樹脂酸,如長葉松酸、海松酸、異海松酸等[25-27],這些樹脂酸在松香中含量雖少,但它們都是三環二萜類含氧化合物,可能會和抗體產生反應,從而干擾檢驗結果[28-29]。通過交叉反應評價本研究建立的間接競爭ELISA方法檢測DHAA的特異性。
分別配制質量濃度為1 mg/mL的AA、長葉松酸、海松酸、異海松酸4 種標準儲備液,用PBS梯度稀釋成系列工作溶液,進行間接競爭ELISA分析,得到抑制率曲線。根據各線性回歸方程計算抑制率分別為20%、50%、80%時所對應的標準溶液質量濃度。
由表1可知,AA、長葉松酸、海松酸、異海松酸4 種樹脂酸與DHAA的交叉反應率均小于3.00%,表明這些結構類似的樹脂酸對DHAA測定的影響很小,可以忽略不計,因此,本研究所建立的間接競爭ELISA檢測方法對DHAA具有優良的特異性。
2.4 精密度實驗
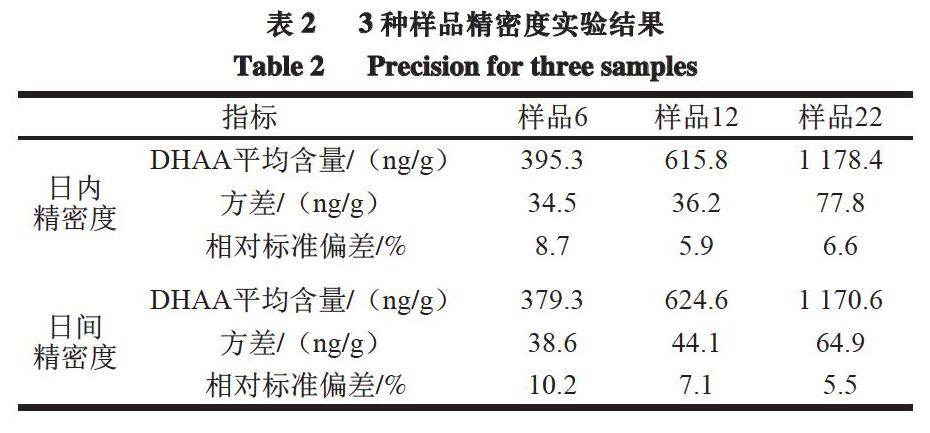
選擇3 個DHAA含量不同的白條鴨樣本開展精密度實驗,包括日內和日間精密度實驗,評價建立的間接競爭ELISA方法的重復性。日內精密度實驗在1 d內進行、共設置6 個重復;日間精密度實驗每天3 個重復、連續進行4 d實驗。
由表2可知,日內和日間精密度實驗測定結果為相對標準偏差分別為5.9%~8.7%和5.5%~10.2%,表明本研究建立的間接競爭ELISA方法具有良好的重復性。
2.5 回收率實驗
選擇3 個DHAA含量不同的白條鴨樣本,進行4 個不同水平的添加回收實驗,評價建立的間接競爭ELISA方法的準確度。由表3可知,回收率范圍為78.2%~97.2%,表明所建立的間接競爭ELISA檢測方法準確度較高。
2.6 實際樣品分析
用所建立的間接競爭ELISA方法分別對23 個白條鴨樣本中的DHAA含量進行檢測,并與HPLC-FLD方法的測定結果進行對比。由表4可知,2 種方法的測定結果無明顯差異。ELISA方法測定結果表明,23 個白條鴨樣本中,20 個樣本檢出DHAA,陽性率達87.0%,DHAA含量范圍為118.6~1 199.2 ng/g,無論是陽性率還是DHAA殘留水平均與Zhu Yongzhi等[30]的報道基本一致。因此,本研究所建立的白條鴨表皮組織中DHAA含量的間接競爭ELISA分析方法準確度高,可以滿足流通領域中白條鴨表皮組織中DHAA含量的快速分析。
3 結 論
通過間接競爭ELISA參數的優化,建立白條鴨表皮組織中DHAA含量的間接競爭ELISA測定方法。方法的檢測限及檢測范圍分別為41.0 ng/g和100.0~20 150.0 ng/g。回收率實驗、交叉反應實驗及實際樣本測定結果表明,本研究建立的間接競爭ELISA方法具有良好的靈敏度和準確度,操作簡便、快捷,適用于大樣本量的白條鴨中DHAA殘留量的分析檢測,也可用于市場流通領域中違禁使用松香脫毛加工的白條鴨的鑒別。
參考文獻:
[1] KAMAYA Y, TOKITA N, SUZUKI K, et al. Effects of dehydroabietic acid and abietic acid on survival, reproduction, and growth of the crustacean Daphnia magna[J]. Ecotoxicology and Environmental Safety, 2005, 61(1): 83-88. DOI:10.1016/j.ecoenv.2004.07.007.
[2] PENG Guomei, ROBERTS J C. Solubility and toxicity of resin acids[J]. Water Research, 2000, 34(10): 2779-2785. DOI:10.1016/s0043-1354(99)00406-6.
[3] LISS S N, BICHO P A, SADDLER J N. Microbiology and biodegradation of resin acids in pulp mill effluents: a mini review[J]. Canadian Journal of Microbiology, 1997, 43(7): 599-611. DOI:10.1139/M97-086.
[4] SMITH P A, GARDNER D R, DROWN D B, et al. Detection of resin acid compounds in airborne particulate generated from rosin used as a soldering flux[J]. American Industrial Hygiene Association Journal, 1997, 58(12): 868-875. DOI:10.1080/15428119791012207.
[5] 張蘇珍, 卞歡, 王道營, 等. 肉鴨經松香脫毛后表皮松香殘留的薄層色譜檢測研究[J]. 江西農業學報, 2013, 25(5): 117-119. DOI:10.19386/j.cnki.jxnyxb.2013.05.035.
[6] MITANI K, FUJIOKA M, UCHIDA A, et al. Analysis of abietic acid and dehydroabietic acid in food samples by in-tube soid phase microextraction coupled with liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2007, 1146(1): 61-66. DOI:10.1016/j.chroma.2007.01.118.
[7] 張蘇珍, 卞歡, 王道營, 等. 食品中松香殘留檢測方法的研究進展[J]. 江蘇農業科學, 2013, 41(8): 307-308. DOI:10.3969/j.issn.1002-1302.2013.08.116.
[8] 張蘇珍, 耿志明, 王道營, 等. 固相萃取-高效液相色譜法檢測肉鴨表皮組織中的松香酸[J]. 食品科學, 2014, 35(4): 82-85. DOI:10.7506/spkx1002-6630-201404017.
[9] KERSTEN P J, KOPPER B J, RAFFA K F, et al. Rapid analysis of abietanes in conifers[J]. Journal of Chemical Ecology, 2006, 32(12): 2679-2685. DOI:10.1007/s10886-006-9191-2.
[10] NILSSON U, BERGLUND N, LINDAHL F, et al. SPE and HPLC/UV?of resin acids in colophonium-containing products[J]. Journal of Separation Science, 2008, 31(15): 2784-2790. DOI:10.1002/jssc.200800210.
[11] LEE B L, KOH D, ONG H Y, et al. High performance liquid chromatographic determination of dehydroabietic and abietic acids in traditional Chinese medications[J]. Journal of Chromatography A, 1997, 763(1): 221-226. DOI:10.1016/S0021-9673(96)00901-6.
[12] 肖敬川, 王順蘭, 曹卉. 血清碳酸酐酶Ⅱ抗體ELISA方法的建立及應用評價[J]. 國際檢驗醫學雜志, 2018, 39(8): 953-955. DOI:10.3969/j.issn.1673-4130.2018.08.016.
[13] YANG Fan, WANG Huan, YANG Juan, et al. An indirect competitive immunoassay for analysis of carminic acid in meat products[J]. Food Analytical Methods, 2017, 10(11): 3687-3693. DOI:10.1007/S12161-017-0947-6.
[14] LIN Lu, JIANG Wei, XU Liguang, et al. Development of IC-ELISA and immunochromatographic strip assay for the detection of flunixin meglumine in milk[J]. Food and Agricultural Immunology, 2018, 29(1): 193-203. DOI:10.1080/09540105.2017.1364710.
[15] 布冠好, 朱婷偉, 陳復生, 等. 大豆球蛋白間接競爭ELISA檢測方法的建立[J]. 河南工業大學學報(自然科學版), 2014, 35(4): 1-5; 11. DOI:10.16433/j.cnki.issn1673-2383.2014.04.005.
[16] 張澤英. 酶聯免疫分析技術在獸藥殘留檢測中的應用[J]. 湖北畜牧獸醫, 2013, 34(10): 59-61. DOI:10.16733/j.cnki.issn1007-273x.2013.10.027.
[17] 趙芮, 劉磊, 劉麗, 等. 酶聯免疫吸附法和液相色譜-質譜聯用法分析海洋生物中記憶缺失性貝毒[J]. 分析實驗室, 2015, 34(8): 882-885. DOI:10.13595/j.cnki.issn1000-0720.2015.0191.
[18] LI Yanshen, SHI Weimin, SHEN Jianzhong, et al. Development of a rapid competitive indirect ELISA procedure for the determination of deoxynivalenol in cereals[J]. Food and Agricultural Immunology, 2012, 23(1): 41-49. DOI:10.1080/09540105.2011.589046.
[19] 楊小康, 張繪艷, 顧建紅, 等. 拉沙里菌素單克隆抗體的研制及間接競爭ELISA檢測方法的建立[J]. 中國畜牧獸醫, 2017, 44(10): 3049-3056. DOI:10.16431/j.cnki.1671-7236.2017.10.031.
[20] 姚閩娜, 楊旭, 孫遠明, 等. 食品中重要有害物殘留快速檢測技術的研究進展[J]. 熱帶生物學報, 2016, 7(3): 395-401. DOI:10.15886/j.cnki.rdswxb.2016.03.021.
[21] 卞歡, 仇新媛, 李鵬鵬, 等. 松香人工抗原的合成及多克隆抗體的制備[J]. 食品科學技術學報, 2018, 36(6): 51-57. DOI:10.3969/j.issn.2095-6002.2018.06.008.
[22] GURMIT S, LIGIA V, ANNE-CATHERINE H, et al. Development of a polyclonal antibody-based indirect competitive ELISA for determination of sterigmatocystin in wheat and corn flours[J]. Food Additives and Contaminants: Part A, 2019, 36(2): 327-335. DOI:10.1080/19440049.2019.1567943.
[23] 張蘇珍, 耿志明, 王道營, 等. 肉鴨表皮組織中脫氫樅酸殘留的SPE-HPLC檢測方法[J]. 食品科學, 2014, 35(16): 101-104. DOI:10.7506/spkx1002-6630-201416019.
[24] ZHU Yongzhi, ZHANG Suzhen, GENG Zhiming, et al. Simultaneous determination of abietic acid and dehydroabietic acid resdues in duck meat by HPLC-PAD-FLD[J]. Food Analytical Methods, 2014, 7(8): 1627-1633. DOI:10.1007/s12161-014-9798-6.
[25] 刁開盛, 尹顯洪, 王海軍. 松香樅酸結構和性質的理論研究[J]. 林業科學, 2009, 45(8): 117-123. DOI:10.3321/j.issn:1001-7488.2009.08.021.
[26] 崔國友, 莫炳榮, 陳文納. 脫氫樅酸的應用研究進展[J]. 精細與專用化學品, 2006, 14(20): 6-8. DOI:10.3969/j.issn.1008-1100.2006.20.002.
[27] 段文貴, 陳小鵬, 王琳琳, 等. 氫化松香主要化學組成的研究[J]. 林產化學與工業, 2001, 21(1): 1-6. DOI:10.3321/j.issn:0253-2417.2001.01.001.
[28] 張妤琳, 曹玲, 譚力, 等. 液質聯用技術用于沉香中非法摻入含松香酸類物質的檢測[J]. 中成藥, 2011, 33(5): 844-847. DOI:10.3969/j.issn.1001-1528.2011.05.032.
[29] 蘇運勝, 呂立盈, 聶少姬. 環境溫度對去氫樅酸檢測結果的研究[J]. 化工技術與開發, 2012, 41(4): 32-33. DOI:10.3969/j.issn.1671-9905.2012.04.010.
[30] ZHU Yongzhi, ZHANG Suzhen, GENG Zhiming, et al. Analysis of abietic acid and dehydroabietic acid residues in raw ducks and cooked ducks[J]. Poultry Science, 2014, 93(10): 2663-2667. DOI:10.3382/ps.2014-04045.

