海扇殼源性碳酸鈣納米微粒的急性毒性作用研究*
付文亮,邵春燕,崔鼎豪,陳志宏△
(1.承德醫學院人體解剖學教研室, 河北承德 067000;2.中國人民解放軍聯勤保障部隊第九八一醫院口腔科;3.新疆醫科大學臨床醫學系)
近幾十年來,納米微粒在抗癌藥物載藥體系中的應用受到了廣泛關注。與傳統的抗癌藥物相比,納米載藥體系具有更高的腫瘤微環境靶向選擇性和實體瘤高通透性[1]。與其它載藥體系相比,生物源性碳酸鈣納米微粒(calcium carbonate nanoparticles,CCNPs)具有良好的生物相容性、生物降解性和pH敏感性,展現了作為載藥體系的強大潛力[2]。本課題組前期研究已經成功用海扇殼制備了CCNPs,并發現阿霉素裝載的CCNPs能有效殺滅骨肉瘤細胞,所使用的海扇貝由純文石型碳酸鈣自然組成[3-4]。但是,目前國內外還沒有相關的實驗研究報道CCNPs體內注射的安全劑量。本研究將首次探討靜脈注射海扇殼源性CCNPs在大鼠體內的急性毒性效應,為CCNPs在生物醫學和藥物應用中的安全性評價提供可靠的實驗依據。
1 材料與方法
1.1 試劑、藥品與動物 海扇殼購自馬來西亞當地市場,十二烷基二甲基胺乙內酯(dodecyl dimethyl betaine,BS-12)購自美國Sigma-Aldrich公司。
五周齡清潔級雌性SD大鼠,重量140~170g,購自于馬來西亞博特拉大學獸醫學院動物資源部門,飼養于恒溫(25±3℃)、恒濕(55±5%)的環境中。本研究的動物實驗方案由博特拉大學實驗動物倫理委員會批準(批準號:UPM/IACUC/AUP-R027/2015)。
1.2 CCNPs的制備 將洗凈干燥的海扇殼打碎研磨,過75 μ m實驗篩得到微米級的粉末。5g微米級粉末加50ml去離子水在磁力攪拌器中70℃、1300r/min攪拌1h;將1ml BS-12加入到上述混懸液中,室溫、1000r/min攪拌110min;過濾收集CCNPs,于70℃烘箱中干燥2d,備用。使用前紫外線照射CCNPs粉末滅菌2h,用無菌生理鹽水配制成所需濃度。
1.3 CCNPs表面形態的觀察 透射電子顯微鏡觀察CCNPs的形狀并測量大小。
1.4 14天重復劑量毒性試驗 SD大鼠隨機分為四組,CCNPs低、中、高劑量組和對照組,每組6只。CCNPs低(30mg/kg/d)、中(60mg/kg/d)、高(120mg/kg/d)劑量組大鼠分別給予不同劑量的CCNPs尾靜脈注射,連續14d;對照組大鼠每天給予等量生理鹽水尾靜脈注射,連續14天。
1.4.1 毒性反應觀察和體重測量:每天觀察大鼠的死亡情況、毒性反應和行為異常,如皮膚、皮毛、眼睛或自主活動的改變,步態和姿勢的變化;同時,每天記錄大鼠的體重。
1.4.2 組織病理學檢查:分別取大鼠肝臟、肺、脾、腎和心臟,10%中性福爾馬林固定,常規石蠟包埋,連續切片,片厚5 μm,HE染色,普通光學顯微鏡觀察并拍照。
1.5 統計分析 所有數據采用SPSS 23.0統計軟件進行統計學分析。數據以(±s)的形式表示,組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。以P<0.05時為差異具有統計學意義。
2 結果
2.1 CCNPs的形貌與表面特性 透射電子顯微鏡下觀察顯示,本研究制備的CCNPs為球形,直徑為20~60nm,為多孔性質(圖1)。CCNPs的多孔特性有助于其通過物理吸附作用裝載藥物到納米粒子。

圖1 透射電子顯微鏡下CCNPs的形貌
2.2 14天重復劑量毒性試驗
2.2.1 各組大鼠的生存率和毒性反應觀察:實驗結束時,低劑量組和對照組大鼠生存率為100.00%(6/6),中劑量組大鼠生存率為66.67%(4/6)、高劑量組大鼠生存率為50.00%(3/6)。整個實驗過程中,低劑量組大鼠日常表現與對照組大鼠無明顯差別;在中劑量組和高劑量組,一些大鼠出現皮毛粗糙、自發活動減少等表現。CCNPs三個劑量組大鼠均未發現注射部位局部損傷病變。
2.2.2 各組大鼠的體重:在實驗過程中,CCNPs各給藥組和對照組大鼠的體重均逐漸增加。實驗結束時,CCNPs低劑量組、中劑量組大鼠體重與對照組大鼠相比,差異無統計學意義(P>0.05);CCNPs高劑量組大鼠體重顯著低于對照組大鼠(P<0.05)。見圖2:
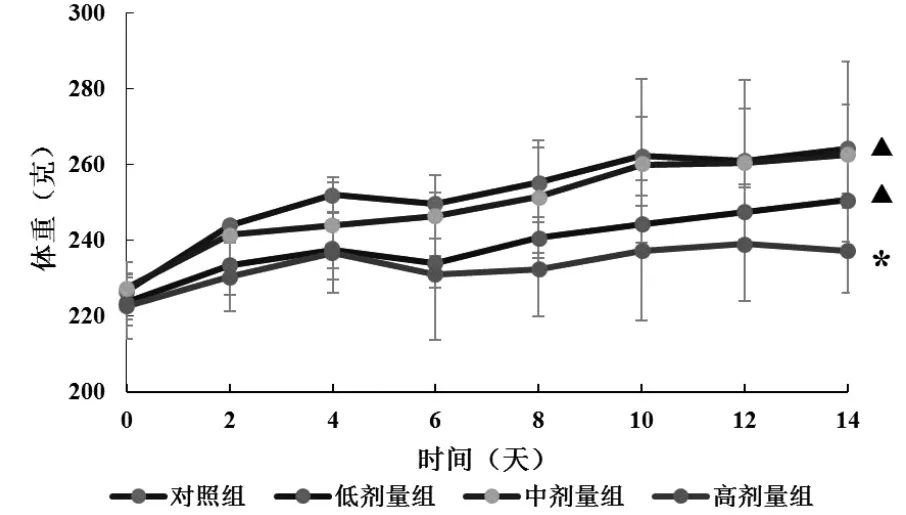
圖2 各組大鼠體重的變化
2.2.3 組織病理學觀察:主要臟器的病理學變化見圖3。⑴肝臟:低劑量組,大鼠肝細胞仍以條索狀排列,可見輕度的空泡變性和淋巴細胞浸潤;中、高劑量組,大鼠肝細胞排列輕度紊亂,肝細胞內空泡增多,可見大量炎性細胞浸潤。⑵肺:與對照組相比,低劑量組大鼠肺泡間隔膜增厚且伴有炎性細胞浸潤,肺間質中可見輕度肉芽腫形成;在中、高劑量組,大鼠肺可見大量炎性細胞浸潤,肺泡間質增厚及大量肉芽腫形成。⑶脾:CCNPs各給藥組大鼠脾臟的形態結構發生了明顯病理變化,尤其是中、高劑量組大鼠,且高劑量大鼠脾臟白髓的輪廓不規則或消失。⑷心臟:低劑量組,大鼠心臟切片可見輕度炎性細胞浸潤;中劑量組,大鼠心肌細胞間質中有明顯擴張充血的血管,紅細胞外滲和中度炎性細胞浸潤;高劑量組,大鼠心肌纖維腫脹、斷裂甚至壞死,伴有嚴重的淋巴細胞浸潤。⑸腎:低劑量組,大鼠腎臟切片未見明顯病理改變;中、高劑量組,大鼠腎臟切片可見明顯病理變化,如腎小球萎縮和系膜區明顯增寬,擴張毛細血管內淤血明顯。
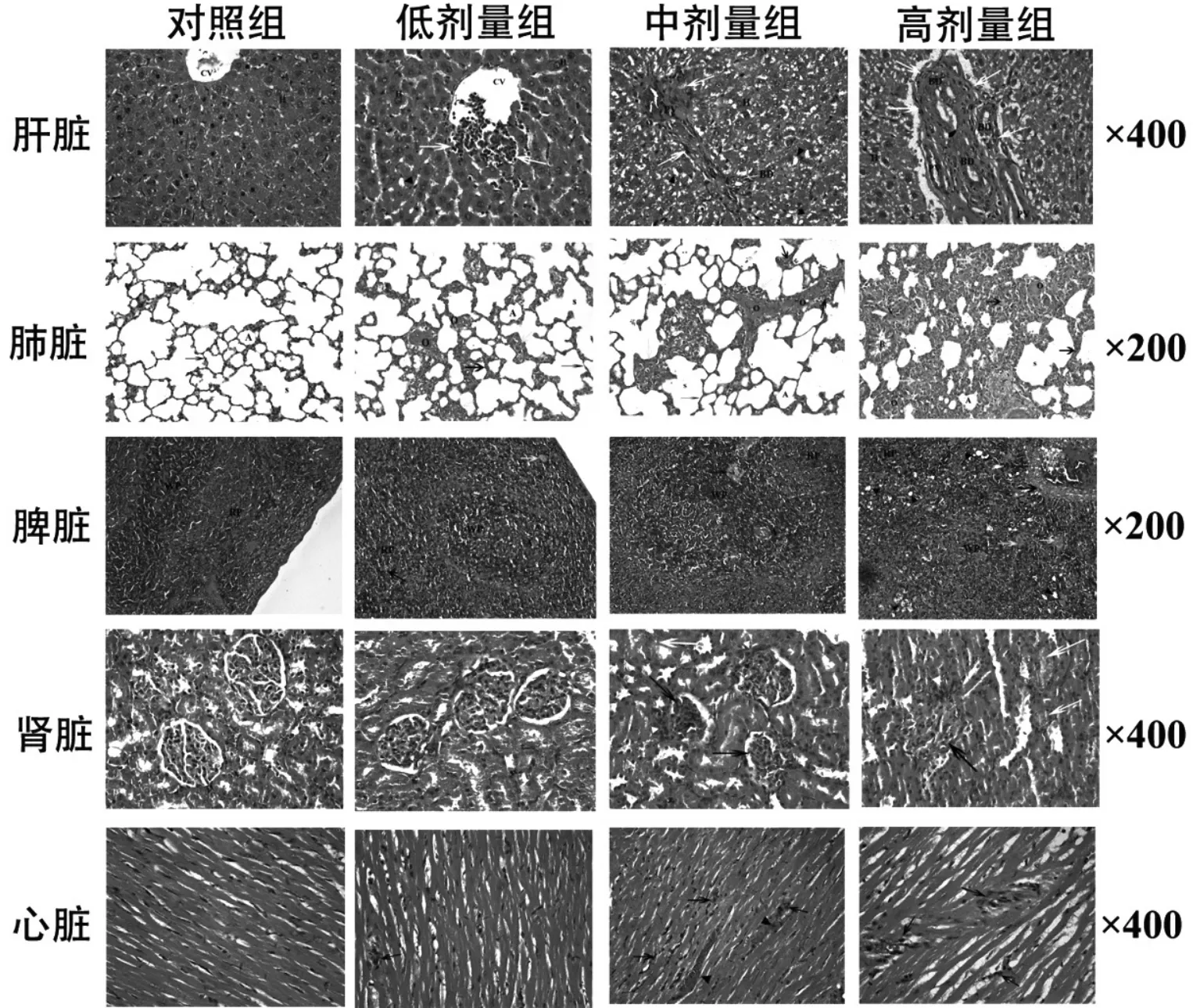
圖3 大鼠各臟器HE染色結果
3 討論
傳統抗癌藥物由于缺乏對腫瘤組織細胞的靶向性,在殺滅腫瘤細胞的同時也會損害正常的組織細胞,造成劑量相關的毒副作用[5-6]。隨著納米技術的發展,具有腫瘤組織細胞靶向性的納米載藥體系可以在增加藥物抗癌效果的同時,減少對正常組織的毒副作用。作為具有良好生物相容性載藥體系的CCNPs,至今其體內使用的安全劑量及具體的生物學效應尚不清楚。為此,本研究采用14天連續靜脈注射的給藥方式,初步探究了不同劑量CCNPs對雌性SD大鼠的急性毒性作用。
本研究顯示,CCNPs低劑量組大鼠全部存活,中、高劑量組大鼠存活率分別為66.67%和50.00%,并且大鼠死亡之前均出現了不規則呼吸和嚴重嗜睡等毒性反應。體重減輕是一個簡單而靈敏的毒性實驗指標[7]。本研究發現,CCNPs低、中劑量組大鼠體重與對照組大鼠比較差異無統計學意義,而高劑量組大鼠的體重與對照組比較明顯降低。本研究結果提示,高劑量CCNPs連續14天靜脈注射可能通過影響雌性大鼠的正常代謝導致了大鼠體重增長的減慢;同時,高劑量組中部分大鼠出現了皮毛粗糙、自發活動減少等毒性反應的表現。
組織病理學分析是觀察藥物毒性作用引起器官微觀結構變化的可靠方法[8]。本研究組織病理學觀察發現,CCNPs暴露引起的組織病理學改變主要是肺、肝、脾、腎和心臟的炎性細胞浸潤,其機制可能是納米微粒進入體內激活了機體的免疫應答,在免疫應答期間促炎性細胞因子釋放增加,進而可能導致氧化應激反應或細胞損傷的發生[9]。同時,本研究還發現,CCNPs低劑量組大鼠肝臟、脾、肺、心臟和腎臟的病理變化較輕或未觀察到明顯病理變化,而中、高劑量組大鼠各臟器的病理變化明顯較重。
綜上所述,雌性大鼠14天重復劑量急性毒性實驗中,小劑量的CCNPs靜脈給藥不會引起嚴重的急性毒性反應,即CCNPs對于雌性大鼠的安全劑量為≤30mg/kg,本研究可為CCNPs在生物醫學和藥物應用中的安全性評價提供可靠的實驗依據。

