生物分子結合水的結構與動力學研究進展?
葉樹集 李傳召 張佳慧 談軍軍 羅毅
(中國科學技術大學,合肥微尺度物質科學國家研究中心,合肥 230026)
(2018年7月2日收到;2018年8月27日收到修改稿)
生物結合水在維護生物大分子的結構、穩定性以及調控動力學性質和生理功能等方面起著決定性的作用.從分子水平上理解生物結合水分子的結構與性質及其影響生物結構和功能的本質與規律,是揭示生物大分子生理功能機理的關鍵.目前生物結合水的結構與動力學相關研究尚處于初步階段.本文從三個方面介紹當前生物結合水的相關研究及其進展:首先介紹結合水對蛋白質折疊、質子給予與遷移、配體結合與藥物設計以及變構效應等生物結構和功能的影響;然后介紹生物分子周圍的水分子結構研究情況;最后從時間尺度、動力學屬性、生物分子與水分子之間的動力學耦合作用、蛋白質表面結合水次擴散運動等角度介紹生物分子水合動力學的研究進展,并歸納出一些目前尚待進一步解決的科學問題.
1 引 言
生物分子結合水作為水的一種重要的存在狀態,是指受限于蛋白質、酶、DNA,RNA或細胞膜等生物分子緊鄰的溶劑化層內的水分子(見圖1)[1-4].自從20世紀50年代證實生物分子結合水存在以來[5],越來越多的證據表明生物結合水已經成為生命活動中不可或缺的有機組成部分,其在維護生物大分子的結構、穩定性以及調控動力學性質和生理功能等方面起著決定性的作用[4,6-9].以蛋白質為例,蛋白質作為生命體執行特定生理功能的分子機器,其與水分子的相互作用直接控制著許多與蛋白質功能相關的過程.比如,與蛋白質結合的水分子(簡稱結合水)的行為不僅直接影響到蛋白質折疊構象轉變的途徑與速率,還調控著蛋白質玻璃化溫度轉變、離子通道開關、質子和能量轉移、蛋白-蛋白識別、配體和藥物結合、酶催化等關鍵過程[7,10,11].對于許多蛋白質而言,水合作用必須達到一定程度,其功能才能正常實現.此外,細胞膜上的水分子為許多生化反應、離子傳輸、信息交換、基因調節、免疫應答、細胞組裝等過程提供獨特的環境,并影響著這些生物過程[12,13].

圖1 幾種不同水合模式相關水分子示意圖 A對應著與表面結合的分子,動力學交換用虛線箭頭表示,字母k表示的是交換速率,B為水合層內的準自由水分子,C則為體相水中的自由水分子[3]Fig.1.Schematic depicting the existence of different types of water molecules associated with different hydration modes.Water type(A)corresponds to molecules bound to the surface.Their dynamical exchange is represented with dashed arrows,and k denotes the exchange rates.Water types(B and C)are quasi-free and free molecules,respectively[3].
雖然生物結合水很重要,但我們對其了解甚少,遠遠不及對液體水的了解.原因主要有兩方面.一方面,水具有非常復雜的氫鍵網絡結構,該網絡結構每時每刻都在發生超快的斷裂與再構過程,并與周圍水分子產生協同作用,從而不僅影響形成氫鍵水分子的OH伸縮振動頻率,而且影響近鄰水分子以及遠層分子的氫鍵形態[14].純水中氫鍵的協同形成和斷裂過程發生在數十飛秒到幾皮秒的時間尺度內[15,16].氫鍵的這種超快可再構行為為實現蛋白質折疊、溶劑化作用等生物過程提供了可能.另一方面,生物分子與水分子之間的相互作用非常微妙,水合層內水分子必須與生物分子有足夠強的相互作用來保證生物分子的穩定,但又不能太強,以至于阻礙表面位點或抑制生物分子結構變化,導致與特定功能相關聯的自由活化能的增加[17].與此同時,生物分子表面很復雜,與水作用的界面涉及許多組分,使得生物分子周圍的水分子處于不同的環境中,而水氫鍵的結合能(約為1—50 kJ/mol)又取決于局部的幾何構型以及氫鍵供給體之間相互作用的類型和強度[18].理論上,極性基團傾向于直接與水分子作用,而非極性基團則會增強水分子之間的相互作用[19].生物分子表面的這種非均質化學特性,大大增加了生物分子與水分子之間相互作用的復雜性,使得生物結合水具有與體相水明顯不同的動力學特性[8,9,20,21]:相對于純水,生物分子表面水分子的局域密度增加了25%[22];蛋白質等生物分子與水分子之間的氫鍵結構取代了體相水中的水-水氫鍵結構,從而阻止了生物結合水的結冰[23];在體相水中,氫鍵連接的水分子之間的極化增加了偶極矩和介電常數,而生物體系中觀察不到水分子氫鍵極化[21];介電弛豫研究表明蛋白質水合層處的水分子動力學明顯存在三個區域,而水相中只存在一種區域[2,24];水分子在水合層中的遷移率比體相水更低且移動方式有所區別.與純水比較,水合層內的轉動和平動均表現出反常的時間依賴性[25,26],生物水動力學變慢很多,主要表現在水合層水分子之間氫鍵斷裂的平均速率比體相水中的斷裂速率要慢,例如,球蛋白或含親水基團的膠束表面上的水分子動力學慢4—7倍,含較大親水尾巴的膠束周圍的水分子甚至變慢1—2個數量級[27].
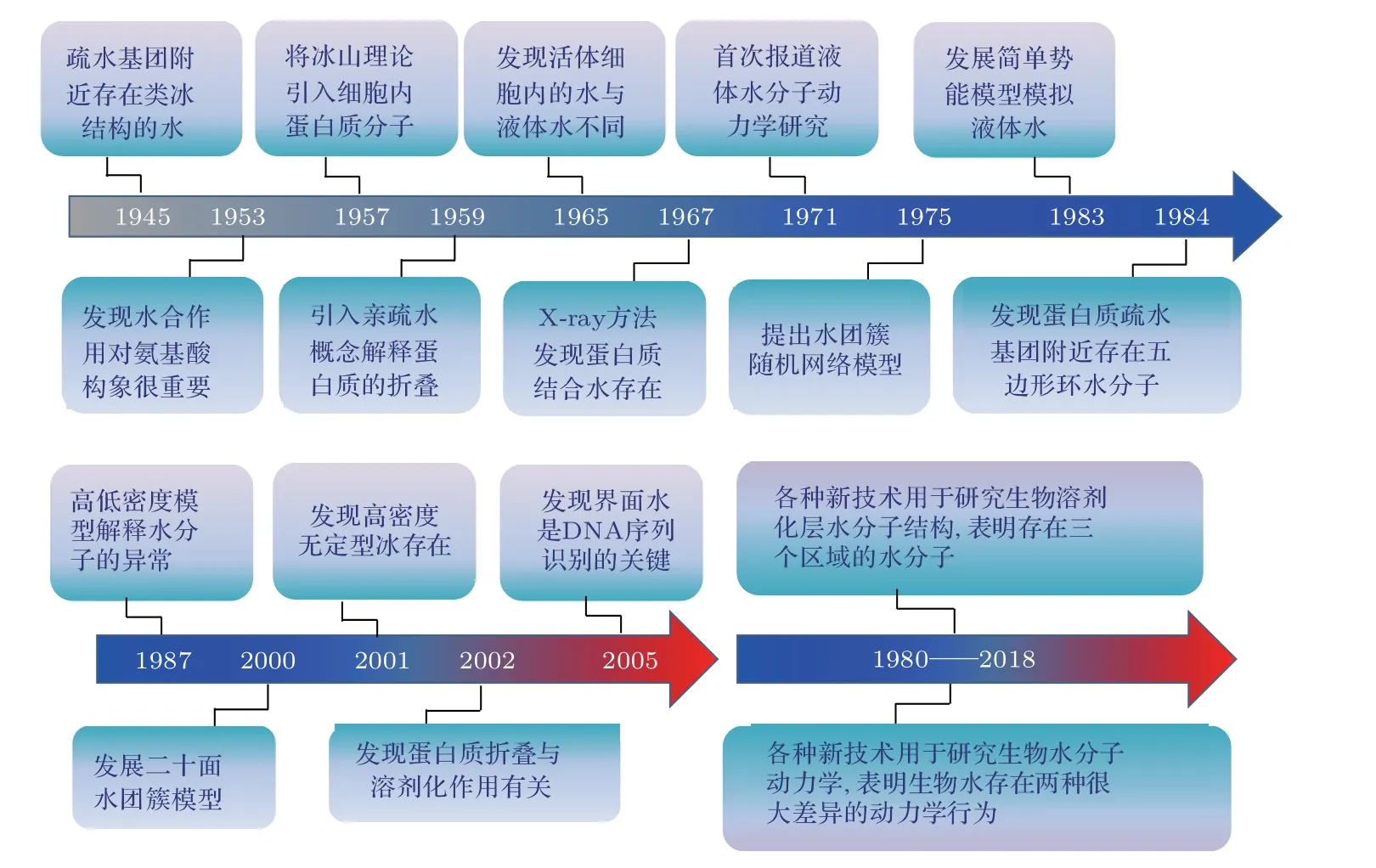
圖2 生物結合水科學的研究簡史Fig.2.A brief history of biological water science.
正是因為生物結合水的復雜性及其與液體水的差異,引起了人們對生物水研究的極大興趣.目前,人們主要從三方面開展生物結合水的研究:一是研究結合水對生物結構和功能的影響;二是研究生物分子周圍的水分子結構;三是研究生物分子水合動力學.目前已經有不少綜述總結了生物結合水的相關研究進展[10,28-30].例如,Chaplin[10]列出了2006年前的生物水科學的簡單歷史(見圖2)以及生物水在細胞生物學中的重要性;2016年,Biedermannova和Schneider[29]綜述了蛋白質和核酸水合作用的實驗和理論研究工作;2016年,Garcia等[11]綜述了水對蛋白質結構和動力學的影響;方海平等[31]總結了生物分子表面水的生物功能研究進展;2017年,Hynes等[32,33]系統地總結了生物分子水合層內水分子結構與超快動力學的進展、存在的分歧和爭議以及未來的展望.
為了更好地梳理生物結合水相關研究的關鍵科學問題,讓國內更多的學者了解生物結合水的研究,本文從三方面介紹該領域的發展動態;結合水對生物結構和功能的影響;生物分子周圍的水分子結構研究情況;生物分子水合動力學的研究進展.
2 生物結合水對生物結構和功能的影響
水作為生命之源,人們很早就在宏觀上認識到水對于生命的重要性,例如《列子·湯問》中“緣水而居,不耕不稼”這句話十分形象地概括了人類對水的依賴關系.然而,人們在微觀上了解水對生物結構和功能的影響,則是近百年來的事情.基于核磁共振(NMR)、介電弛豫(DR)、中子散射、X射線和超快光譜等技術,人們了解到生物結合水不僅僅作為溶劑在發揮作用,而且還是生物結構與功能的積極參與者,在諸多生物和細胞過程中扮演核心角色,包括促進蛋白質折疊、影響錯誤折疊進程,作為結構的重要組成元素維持蛋白質結構的完整性,為生理和細胞過程提供獨特環境,在生物信號傳導中發揮離子通道的門控作用,發揮質子和電子傳遞媒介作用,調控分子識別和加速酶催化等.正因為這樣的重要性,Ball等[30,34,35]甚至認為生物結合水是本身能夠承載一定生物功能的特殊生物分子.
2.1 對蛋白質折疊和錯誤折疊的影響
蛋白質是以氨基酸為基本單元構成的生物高分子,其一級結構指的是其氨基酸序列.通過殘基間的相互作用,氨基酸序列能夠迅速地形成立體的三級結構,這個過程稱為蛋白質折疊[36-39].大多數蛋白質都能自然折疊為一個特定的三維結構,這一特定結構被稱為天然狀態.其折疊動力學主要是分子內氫鍵形成和疏水相互作用兩種因素的平衡結果,并受蛋白質接觸強度和分布的影響.折疊的時間尺度從微秒到秒變化.理論上蛋白質存在大量的可能構象,以100個氨基酸殘基組成的蛋白質為例,每個氨基酸存在兩種構象,則該蛋白質的總構象數目多達2100.倘若蛋白質尋找最低能態的構象一次耗時1 fs,所有構象尋索一遍則需耗時4千萬年,顯然與蛋白質折疊時間尺度嚴重不符.這個悖論早在1968年就被Levinthal首次提出,后人稱之為Levinthal悖論[40].該悖論表明蛋白質折疊遵循特異性途徑,也就是說折疊過程中只嘗試有限數目的構象.而蛋白質折疊要能遵循特異性途徑,其自由能面必須是一個只包含小能壘的多維漏斗式結構,這樣依賴熱擾動就能很容易地克服這些小能壘的障礙,見圖3[10].這需要一個同時具有靈活性、可交換和可拓展性的聯動機理來實現蛋白質折疊過程.而水分子調控的氫鍵結構則能滿足這方面的需求.正如圖3所示,低水合度條件下,蛋白質勢能面存在許多坑坑洼洼,即存在很多局域的低能態,這些低能態有可能將蛋白質陷在不活躍的三維分子亞穩態構型中,從而使折疊無法順利進行.相比之下,在足夠高的水合度條件下,勢能面變得很光滑了,這樣就有利于蛋白質直接而快速地沿著某個特異性途徑到達活躍的最低能態構象[36-38,41].由此可見結合水對蛋白質折疊過程的重要性.
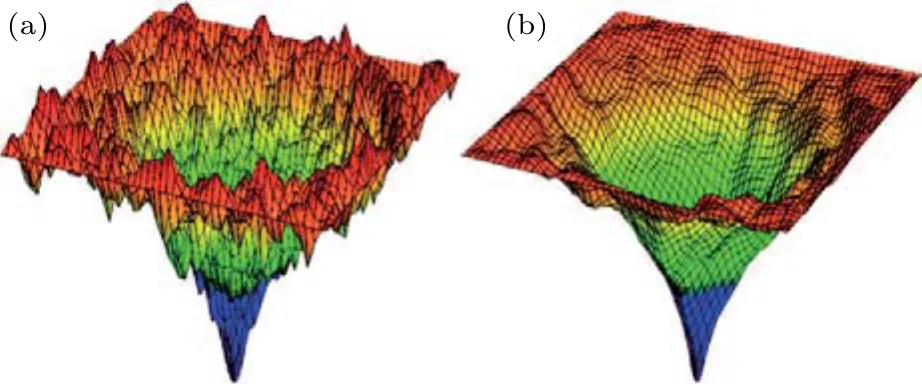
圖3 蛋白質折疊自由能面示意圖[10] 未折疊的蛋白質處于較高能態(見紅桔邊緣),折疊過程降低能量,蛋白質沿著具有最低能態的結構轉變(見深藍的底端漏斗)這些漏洞代表三維的能量形貌,但實際的能量形貌是多維的;(a)低水合程度情形;(b)足夠高的水合度Fig.3.Schematic potential-energy funnels for the folding of proteins[10].The rim(red-orange)represents the high energy of the unfolded protein,with folding lowering the energy towards a minimum-energy structure that is at the bottom of the funnel(dark blue).It should be noted that these funnels represent three-dimensional landscapes,whereas the actual energy landscapes are multidimensional.(a)The foldingenergy landscape in the presence of low hydration;(b)a protein is sufficiently hydrated.

圖4 蛋白質聚集形成多形態纖維機理示意圖[43] 左側為溶劑化狀態下的多肽;水合層內水分子標記為紅色,體相水分子標記為藍色;N*為有聚合傾向的單體;Protein rich droplets,富含蛋白的液滴;Proto filaments,纖維原絲;Fibrils,成熟纖維Fig.4.Schematic of protein aggregation mechanisms leading to polymorphic fibrils[43].On the left are solvated peptides.Water in the hydration layer is in red and the bulk water is in blue.
此外,結合水也在蛋白質的錯誤折疊過程中起到很關鍵的作用[42,43].水分子除了通過水合作用來保護無規則的多肽鏈和幫助其折疊外,還能促進蛋白質的錯誤折疊,從而產生各種疾病.如圖4所示,在蛋白質聚集形成多形態纖維的過程中,由于多肽內疏水殘基之間的相互作用,即使是孤立的單體樣品也呈現出傾向于形成表面附著具有不同數目水分子的聚合構象N*,從而產生富含無規則蛋白質的液滴.聚集過程的驅動力主要來自水分子從水合層向體相的釋放.這一釋放過程對促進纖維的形成是熵有利的.富含蛋白質的液滴進一步聚集成核,形成原絲,進而自組裝形成各種成熟的、且禁錮有水分子的淀粉樣纖維.從這個角度來說,水分子直接參與了蛋白質的錯誤折疊過程.
2.2 在質子給予和遷移中的作用
質子傳輸通道是生物結合水最常見的一種用途,執行非常重要的生物功能.例如,A型流感病毒跨膜M2蛋白的作用主要是引導質子進入病毒內部,酸化病毒內部環境,從而使病毒釋放遺傳物質至宿主細胞,指導宿主細胞中病毒的復制[44,45].質子傳輸主要有兩種機理:Grotthuss跳躍機理和搬運機理[46-48].跳躍機理能夠在純水中產生異常快速的質子傳輸速度[46],因而最常見.傳輸過程中,水分子的氫鍵鏈由支持質子遷入和穿過蛋白質的水線組成[49].這種傳輸方式既能被動發生,也能通過蛋白質運動來控制進行.不過,需要指出的是,實際上質子的傳遞過程往往比Grotthuss機理復雜得多[50].最近Kaila研究組在研究參與線粒體和細菌呼吸過程的生物能量轉化酶復合體I的質子傳輸時發現[51],質子泵運依賴于煙酰胺腺嘌呤二核苷酸(還原型輔酶NADH)和醌類之間電子傳遞耦合的氧化還原反應來驅動,在三個類反向轉運蛋白亞基的水合作用協同下,形成復合物膜結構域中的瞬態質子傳輸水通道.由此可見,水門控轉變可能為生物能量轉化酶中質子泵送提供一個通用的機理.Goyal小組的研究則展示了水合作用如何調控和協助質子傳遞行為[52].他們發現谷氨酸殘基承擔了臨時質子供體的角色(圖5),其質子親和力的強弱受到內部疏水腔中水合程度的調控.相應地,該水合作用又受到10 ?以外的血紅素基團上取代基質子化程度的控制,其質子化后可觸發一段環結構的運動,由此守衛著通道的入口.最近,Bondar等[53]發現光系統II(PSII)亞基PsbO蛋白表面附近有參與質子傳遞過程的低遷移率水分子,并構成延伸水羧酸鹽網絡結構的一部分(圖6).其中一些水分子或許還會協助PsbO錨定到PSII絡合物中.這種絡合物本身就擁有一層能夠容納不少于1300個水分子的水合層[54].這些水分子有可能為質子傳遞提供多條氫鍵通道以及作光解之用.總的來說,蛋白質精心編排水合層水分子,并用以控制質子化反應,是生物體中相當普遍的一種現象.
水分子除了提供質子和協助質子轉移外,水合氫離子還能促進酸離子通道多肽分子跨越細胞膜[55],還能調控病毒蛋白質的通道結構[56].最近我們研究生物膜上A型流感病毒跨膜M2蛋白pH響應時發現,取決于不同的膜環境,M2蛋白可以通過解螺旋結構或旋轉自身的螺旋軸來實現質子通道的開放[56].

圖5 細胞色素c氧化酶疏水腔附近的關鍵殘基和從谷氨酸殘基出發和到達的質子通道示意圖[52] 其中,谷氨酸殘基E286被認為在質子運輸過程中扮演著關鍵性的角色;BNC(binuclear center)為雙核金屬活性中心,由高自旋的亞鐵血紅素a3與銅金屬催化中心(CuB)組成;PRDa3(propionate D of heme a3)為高自旋的亞鐵血紅素a3丙酸PRAa3;heme a為低自旋的亞鐵血紅素a;heme a3為高自旋的亞鐵血紅素a3;R481和W172分別為第481位的精氨酸和172位的色氨酸Fig.5.Illustration of key residues near the hydrophobic cavity in cytochrome c oxidase and general proton path ways to and from Glu286[52].BNC is the abbreviation of binuclear center which comprises heme a3 and CuB.
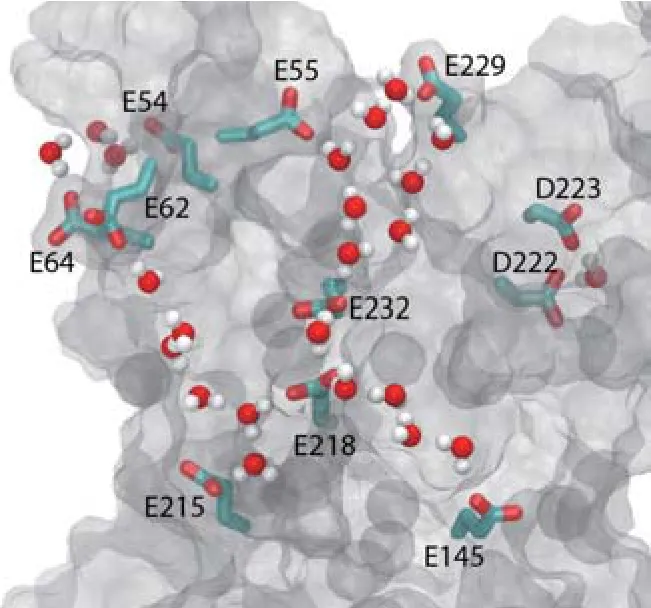
圖6 光系統II亞基PsbO蛋白表面上特定羧酸鹽/水連接橋示意圖[53] E和D分別代表谷氨酸和天冬氨酸Fig.6. Illustration of selected carboxylate/water bridges on the surface of PsbO[53].
2.3 在配體結合和藥物設計中的作用
結合水在生物分子識別中的結構參與,使得其在藥物設計中展現出非常大的潛在價值.一般情況下,水分子網絡會因配體結合而發生重排/取代作用.配體與生物分子結合的效率受到水合作用動力學的影響,遵循受體和配體結合的焓熵補償機理(enthalpy/entropy compensation)[30].例如,Krimmer等[57]研究蛋白質-配體復合物的水合特性時發現,優化覆蓋嗜熱菌蛋白酶疏水抑制劑的水層,可以提升焓對自由結合能的貢獻.太赫茲光譜研究結果也表明[58],膜型基質金屬蛋白酶(membrane type 1-matrix metalloproteinase,MT1-MMP)在底物靠近活性位點時可建立一個動力學梯度,形成“補水漏斗”,從而通過降低結合過程所需的熵來引導分子進行識別.這里,太赫茲光譜測量的是溶劑運動涉及的水分子集體振動模式,其測量的動力學可以延展到距離蛋白表面至少10 ?處的蛋白水合外層.需要指出的是,配體與生物分子結合過程比較復雜,目前尚難完全從熱力學角度進行精確分析.但在實際應用上,利用水介導的相互作用來進行合理的配體與藥物設計已經成為可能.例如,前面提到的A型流感病毒跨膜M2蛋白構成的離子通道中,一些親水的氨基酸殘基面向通道內部,使得通道內部的親水性增大,穩定通道中的結合水.這些水分子網絡把控著質子傳導的大門[49,59,60].一旦藥物與M2蛋白質通道特定位點結合,將阻礙質子的流動,從而無法形成病毒復制所必需的酸性環境.最近,Giant等[61]研究了抑制性藥物如何與質子通道進行靶向作用.他們的研究結果表明已知的抑制劑可以與通道結合,從而破壞用于質子傳輸的水分子簇.通過計算M2處于不同位點的孔阻滯劑的熱力學參數,他們發現有效的配體支架可模仿水分子簇的輪廓,并具有水簇與蛋白質之間的相互作用效果.通過分析2000多種水合與非水合的配體受體復合物的晶體結構(包括許多藥物),García-Sosa[62]發現,水分子的橋接是實現緊密結合的有效靶點.Neidle等[63]也發現DNA雙序列d(CGCGAATTCGCG)2小溝附近存在一個由11個水分子組成的水團簇,該團簇幫助三種不同的小分子配體與DNA小溝結合.
2.4 在變構效應中的作用
水分子不僅有助于蛋白-蛋白、蛋白-配體作用的識別與錨定,也在蛋白質變構效應中發揮關鍵作用.變構效應是寡聚蛋白與配基結合改變蛋白質構象,導致蛋白質生物活性改變的現象,其在調節生命活動中起很重要的作用[64].例如,不等殼毛蚶這種軟體動物的血紅蛋白亞基界面含有17個排列規整的水分子,氧合作用時會失去6個規整排列的界面水分子.這些水分子作為一種傳輸單元,在協同氧氣結合、促進亞基間變構通訊過程中扮演著重要角色.水分子簇能夠幫助蛋白穩定在低親和力的狀態,而缺少兩個來自該水簇的氫鍵的突變體則傾向于采取具有高親和力的構象.因此,由于氧氣與其中一個野生型亞基結合而導致界面水分子減少,有助于其過渡到另一個亞基的高親和力構象[65].又例如,在六聚體多疇結構的谷氨酸脫氫酶中,疏水口袋的開關伴隨著袋子的干濕變化,而在親水的縫隙中,水分子的結合與解離則伴隨著其長度的變化[66].這兩種水合作用的變化耦合在一起,為大規模的構象變化制造了一種“液壓”機構.Buchli等[67]探測到變構模型物質PDZ蛋白質水合作用過程中變構效應的時間依賴性.通過在蛋白質的結合溝中引入偶氮苯光開關,蛋白質能夠通過光誘導異構化來控制構象變化,如同配體結合方式一樣打開該結合溝.快速紅外光譜顯示,偶氮苯異構轉變后,光開關附近的水密度會立即發生變化,并且通過水網絡緩慢傳播100 ns左右,直到到達蛋白質的另一側(圖7).在這傳播過程中可能會引起蛋白質構象的遠距離變構傳輸.
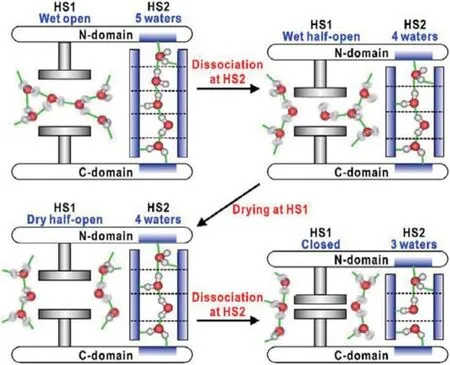
圖7 水合作用調控谷氨酸脫氫酶(GDH)中結構域運動機理示意圖 疏水和親水表面分別用灰色和藍色標出[66],每一個GDH的亞基都包含有一個核苷酸結合域(N域)與一個核心區域(C域),以便六聚結構的形成,兩個結構域間有一個大裂縫,它可以當作與底物結合的活性位點Fig.7.A schematic illustration explaining the mechanism of the hydration-regulated domain motion in glutamata dehydrogenase(GDH).The hydrophobic and hydrophilic surfaces are colored in grey and blue,respectively[66].Each subunit of GDH is composed of a nucleotide-binding domain(N-domain)and a core domain(C-domain)for hexamer formation.A large cleft between the two domains can work as a active site to which substrate binds.
2.5 其他影響
生物結合水可以通過多種方式來調節蛋白質的結構與功能.除了上面提到的幾種作用外,結合水對生物結構與功能還有許多影響.例如,作為抗凍蛋白質結構的組成元素[68]、參與生物酶催化[69]、介導電子和離子轉移過程[70,71]、改變蛋白質環境和動力學過程等.最近,第一性原理模擬結果表明生物結合水可以在催化不同磷酸鹽和硫酸鹽基質水解中讓堿性磷酸酶混雜.水分子不同的位置可導致堿性磷酸酶能夠在同一活性位點支撐不同類型的過渡態[72].另外,嗜鹽菌抽氯跨膜視網膜蛋白水合作用變化過程中,隨著氯離子的遷移,發色團附近的水和離子發生細微的重排,從而誘導發色團鍵長的變化,并影響其吸收光譜[73].此外,生物分子水合程度也可對蛋白質分子局域能量傳遞速率產生影響.我們利用飛秒抽運-探測技術研究了水合作用對血紅蛋白分子的能量傳遞的過程,發現能量傳遞速度在水合程度12.4%—16.5%和21.7%—23.5%處出現兩個變化轉折點[74].第一個變化對應于蛋白質彈性增加的開始,第二個變化對應于水合作用到達飽和水平.在水合程度6 16.5%時,隨著水合程度的增加,局域能量弛豫時間增加,但當水合作用到達飽和水平時,弛豫時間幾乎保持不變,并與溶液中的弛豫時間非常接近(圖8).
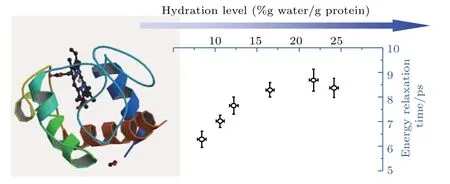
圖8 水合程度對蛋白質分子能量傳遞速率的影響(400 nm激發,800 nm探測)[74]Fig.8.Hydration dependence of relaxation time probed at 800 nm after pumping soret band at 400 nm[74].
3 生物結合水分子結構的研究
核磁共振、介電弛豫、中子散射、X射線和超快光譜等技術以及量子化學理論的迅速發展,大大增強了人們研究水微觀結構與性質的能力.研究水分子結構的兩種主要技術是X-射線衍射和中子散射實驗.X-射線衍射是一種有效測定分子晶體結構的方法.在早期的水科學研究中,經常被用來獲取水分子束縛結構的靜態圖像,主要集中在研究水分子角度分布,進而解釋相鄰水分子之間的關系.例如,1931年,Stewart等[75]用X-射線衍射研究了水在2—98?C的角強度的分布情況,并提出解釋模型.隨后,Katzo ff等[76]開始使用X-射線衍射方法定量分析和解釋水分子,提出水的四面體模型,該模型認為液態水中的每個水分子以氫鍵的形式平均綁定4個其他水分子,排列成正四面體結構,并按此排列方式延展到整個液體中,形成網絡狀結構[77].但在2004年,Stanford大學的Nilsson研究組在《Science》上發表了一篇挑戰“正四面體”水結構概念的文章[78].他們用X射線吸收光譜技術研究液態水的氫鍵作用模式,提出了氫鍵綁定的新模型:在室溫條件下,液態水分子的兩個OH基團形成不同的氫鍵結構,80%水分子中一個OH基團形成強氫鍵,另一個不形成氫鍵或僅形成弱氫鍵,而剩余的20%的水分子則按四面體結構的方式形成4個強氫鍵.不過,人們對“Nilsson”水結構概念質疑不斷.同年,UC Berkeley大學的Saykally研究組[79]利用相同的實驗方法研究液體水結構,認為傳統的四面體的排列方式仍是合理的.此外,基于第一性原理的理論計算結果也不支持Nilsson的水結構[80].與Nilsson等把氫鍵分為強、弱兩類處理方法不同,Tu和Fang[81]將氫鍵按照從弱到強連續分布的粗粒化處理方式研究了液態水的結構.他們的研究表明,液態水中可能存在兩種局域結構,強弱氫鍵間的轉換導致水局域結構之間的相互競爭,從而引起水的異常行為.目前,除對水分子的平均氫鍵數目存在爭論外,有關水的整體結構也是熱點爭論.例如,Huang等[82]通過小角X射線散射實驗認為水是由不同大小的團簇組成;而Smith等[83]通過自發拉曼光譜實驗和理論計算認為水實際上是一個連續介質.
近年來,X-射線衍射和中子散射也被用于研究生物分子周圍水分子的空間分布[29,84].X-射線衍射可以提供蛋白質或核酸相關原子在晶體中的平均位置信息,從而可以實現生物分子結構分子模型的構建.基于該技術獲得的靜態結構表明,一個完整的溶劑化層包括非常有序的位點和彌散的、部分無序的溶劑化殼層[85].在蛋白質中,極化和帶電荷的基團表面以及空腔內部觀測到排列有序的水分子[86].這些內部的水合位點經常保存于同一家族的蛋白質中[87].在所有的表面水合位點中,最穩定的是蛋白質和臨近水分子的氫鍵結合體[88].相比之下,疏水和大分子無序結構區域往往觀測到容易擴散的部分無序的溶劑結構存在.與蛋白質相似,DNA水合位點可以形成依賴于DNA結構和堿基序列的網絡結構[89,90].
中子散射實驗主要提供蛋白質中氫鍵的具體性質,包括氫鍵對酶功能的影響等信息[91].早期的工作集中于水結構的研究,如Bosio等[92]使用中子散射實驗研究了高密度無定型水的結構.近年來,由于中子散射技術的發展及其特殊的優點(對于較輕的元素有更精確的響應,如氫、氮、氧等,更適合研究生物水),中子散射實驗也被用來研究生物水的動力學性質.如Smith等[93]使用中子散射實驗和分子動力學模擬方法研究了球蛋白動力學的三種運動方式,即甲基基團的轉動、附近區域擴散和無甲基的跳躍.中子散射動力學實驗顯示水質子的均方位移時間發生在皮秒時間尺度[94].
此外,紅外、拉曼光譜等分子光譜技術作為現代分析技術的重要手段,其在標定物質結構中發揮著其他手段無法代替的作用,可以提供分子環境和運動行為的直接信息.人們采用紅外光譜、拉曼光譜等技術來研究無定形固體水結構,從多層次角度理解了無定形固體水結構,獲得了其不同相間的相圖,并在高密度無定形固態水與低密度無定形固態水轉換過程中觀測到液態水的存在[95].最近,非線性和頻光譜也被用于研究界面水分子的靜態結構[96,97].早在20多年前,沈元壤教授首先用他自己開創的和頻振動光譜技術研究了表界面水分子結構[98],目前和頻光譜技術已經發展成一種研究表面/界面水結構與動力學的強有力手段.沈元壤教授在此基礎上發展了相位敏感的和頻光譜技術,該技術可以給出水分子在界面上的取向信息,隨后沈元壤研究組、Allen研究組和Tahara研究組利用該技術成功測出表面水以及磷脂分子附近的水分子結構[99-101].研究結果表明,水分子的取向由表面磷脂分子頭部基團的電荷決定.帶正電荷和負電荷的磷脂分子界面上水分子分別采取氫朝下(H-down)和氫朝上(H-up)結構(圖9).但兩性離子的磷脂分子表面則存在三種水分子結構:與帶負電荷的磷酸基團結合的水分子氫鍵較強,采取氫朝上結構;與帶正電荷的膽堿基團結合的水分子氫鍵弱一些,采取氫朝下結構;與磷脂疏水區域有弱作用的水分子基本上采取氫朝上結構(圖10).
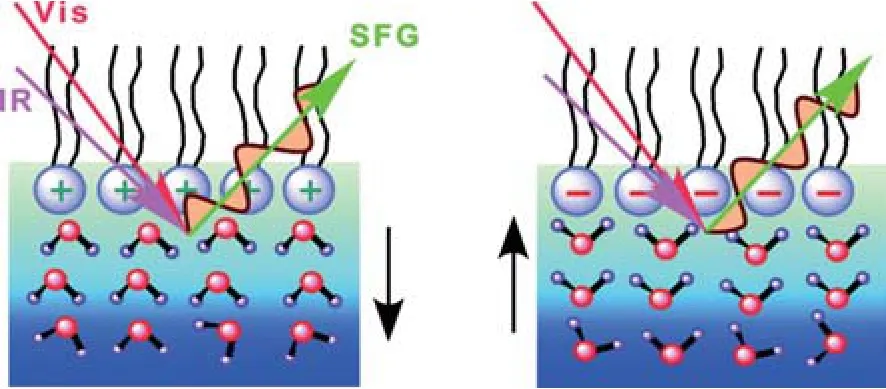
圖9 帶正電荷和負電荷的磷脂分子界面上水分子分別采取氫朝下(H-down)和氫朝上(H-up)結構[100]Fig.9.At charged lipid/water interfaces,the orientation of interfacial water is governed by the net charge on the lipid headgroup;at an anionic lipid/water interface,water is in the hydrogen-up orientation,and at the cationic lipid/water interface,water is in the hydrogen-down orientation[100].
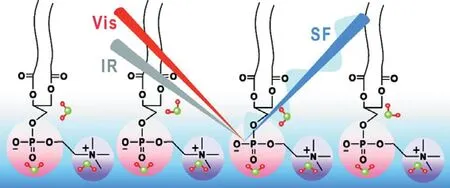
圖10 兩性離子的磷脂分子表面存在三種水分子結構[101]Fig.10.Schematic representation of the three distinct waters at the zwitterionic lipid/water interface[101].
4 生物結合水動力學研究
X-射線衍射和中子散射實驗可以提供豐富的水結構信息,但靜態信息不足以描述生物與水分子行為.許多生物過程涉及生物分子的電子和能量傳輸和構象轉變等復雜過程,而這些過程通常在不同時間尺度內發生(圖11)[102].因此,理解生物水本質的關鍵在于理解生物水的動力學狀態及其對生物大分子活性的影響.近年來,人們利用各種方法研究了生物分子的水合動力學,這些研究涉及的實驗和理論方法多種多樣,包括中子散射、介電弛豫、核磁共振、磁共振彌散、溶劑化動力學以及分子模擬[28,30,103-106]等.每個方法均提供了不同的信息(圖12)和重要的新見解.借助于這些技術,人們在不同時間和長度尺度上對結合水的結構與動力學有了許多新的認識.比如,與純水比較,結合水具有較高的局域密度[22]、較低的結冰溫度與極性[21,23],以及較慢的動力學特性[27].
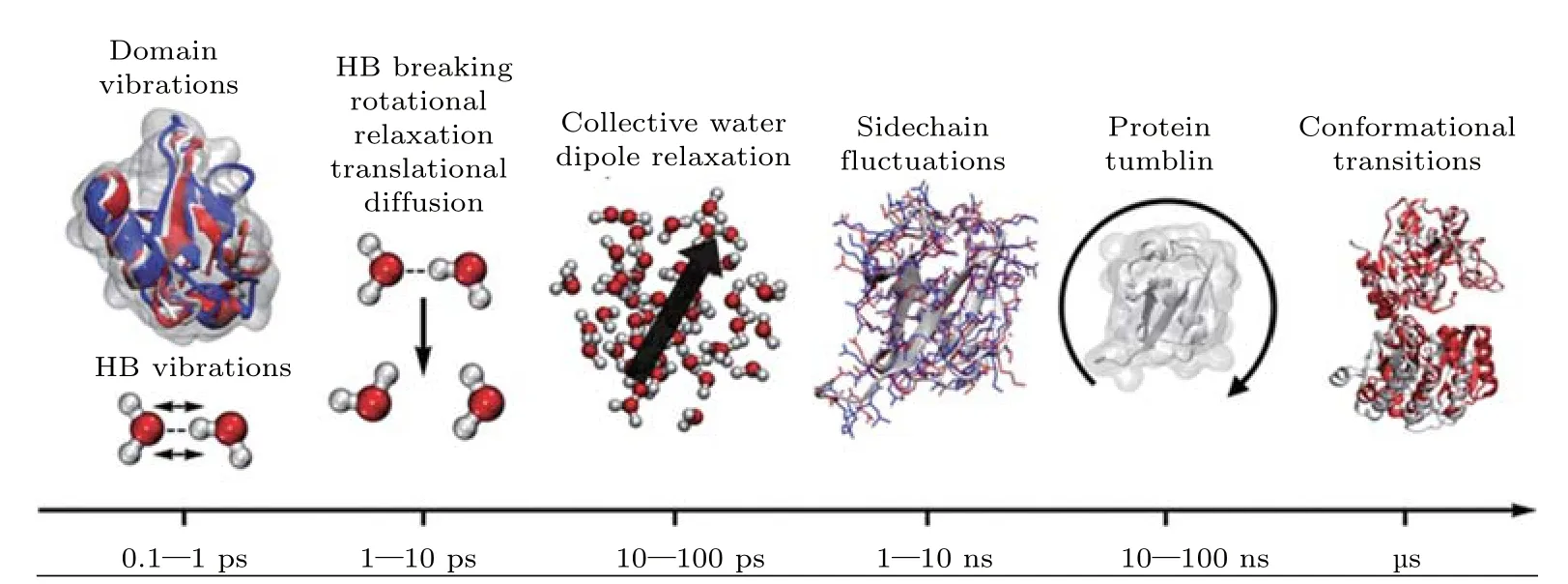
圖11 蛋白質行為不同時間尺度層次示意圖[102] Domain vibrations,域振動;HB vibrations,氫鍵振動;HB breaking rotational relaxation translation diffusion,氫鍵斷裂-轉動弛豫-平移擴散;collective water dipole relaxation,集體水偶極弛豫;sidechain fluctuation,側鏈波動;protein tumbling,蛋白質翻滾;conformational transitions,構象轉變Fig.11.The hierarchy of timescales for motion of proteins and their hydration environment[102].HB,hydrogen bond.

圖12 生物水的主要研究技術Fig.12.The major techniques used for the study of biological water.
4.1 基于介電弛豫與核磁共振技術的動力學研究
Oncley等[107,108]最早利用介電弛豫來測量蛋白質水系統的介電性能,并測出羧基血紅蛋白分子旋轉弛豫時間常數是84 ns.后來,Buchanan和Haggis等[109,110]在更高頻率段進行測量,結果發現三分之一的水合球與水分子緊密結合,且對介電色散沒有貢獻. Grant等[111,112]則全面地表征了蛋白質結合水,指出與蛋白質結合的水展現出一系列弛豫時間常數,這些時間常數與蛋白質和大體積水的轉動過程相關.隨后,Schwan[113],Takashima[114]以及Harvet和Hoekstra等[115]的研究成果也揭示了生物水明顯的弛豫時間,并證實了Grant等的結論.Pethig等[116]的研究進一步表明主要的水合層結合較緊密,微波介電質行為主要受熱激活的第二層生物水影響.總體而言,介電弛豫研究觀測到幾十皮秒到納秒時間尺度范圍內的動力學行為[117].
核磁共振也是一種研究水分子動力學的有效方法,可以揭示停留時間在亞納秒范圍的水分子行為[28].例如,基于奧弗豪塞爾核效應(NOE)的NMR技術測出的蛋白質表面水的停留時間為亞納秒(300—500 ps)[118];利用水2H和17O核磁弛豫色散(NMRD)技術測出的表面水的弛豫時間,在1996年報道為10—50 ps[119],而在2003年則變為3—7 ps[120],利用NMRD1H自旋點陣弛豫法測出的蛋白質表面水的平動時間為30—40 ps[121].表1給出了介電弛豫(DR)和NMR觀測到生物水不同的弛豫時間.

表1 介電弛豫和核磁共振觀測到生物水不同的弛豫時間[24]Table 1.Different relaxation time of biological water observed by dielectric relaxation(DR)and NMR.
4.2 基于熒光光譜技術的動力學屬性研究
綜上可見,介電弛豫和核磁共振等方法的研究結果存在明顯的分歧和爭議[17,122],特別是關于水分子溶劑化層內的動力學以及動力學屬性的細節方面.這些分歧和爭議的根源在于所使用研究方法的時間分辨率的限制,例如核磁共振研究揭示的是停留時間在亞納秒范圍的水分子的行為[28],介電弛豫研究則給出幾十到幾百皮秒的時間尺度[117].因為時間分辨率的限制,這些方法無法獲得飛秒和更長時間內的超快弛豫時間,以及真實的動力學時間響應.此外,這些技術報道的弛豫時間代表的是生物分子表面的平均行為,而不是特定位點的行為,因而不能反映出生物分子表面的非均質化學特性[28].因此,要闡明生物水的本質,關鍵在于對生物分子表面水分子的動力學行為進行空間(分子)與時間分辨率級別(特別是從飛秒到皮秒尺度內的水分子動力學)上的認知.這需要發展能在分子水平和飛秒時間分辨尺度上的新技術.
飛秒光譜的發展,為生物水的研究打開了一個全新的窗口.加州理工大學Zewail教授和俄亥俄州立大學仲冬平教授研究組應用飛秒熒光光譜技術[2,8,9,20,25,28,123-125],在該方面開展了大量的工作,并取得了突破性進展.例如,Zewail等[25]利用定點誘導色氨酸的飛秒時間分辨熒光技術研究了枯草桿菌嘉士柏酶蛋白水合動力學,觀察到了兩個獨立的動力學溶劑化時間0.8 ps和38 ps,在體相水中,則觀察到180 fs和1.1 ps.他們還研究了距離約7 ?的共價鍵探針處的溶劑化過程,該過程在1.5 ps內完成,38 ps成分幾乎消失.隨后,仲冬平研究組利用類似技術研究了蛋白質在原生和熔融球形狀態下的周圍水合動力學[123-125],發現蛋白質水合層上存在幾皮秒(1—8 ps)和幾十到幾百皮秒(20—200 ps)兩種很大差異的水動力學,分別代表最初的局部弛豫和隨后的集體網絡重構(圖13).他們的研究還表明,這兩個時間尺度與蛋白質的結構和化學性質密切相關.這些結果均表明蛋白質結合水動力學過程存在兩種軌跡.
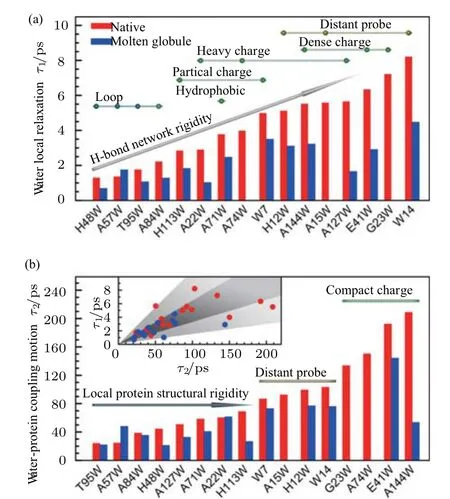
圖13 以各突變體原生狀態下的時間尺度為順序繪制出的水合動力學曲線τ1(a)及τ2(b) (a)在柱形條之上的小圓圈代表的是原生狀態下的突變體,根據它們的探針位置(黃色),局部電荷分布(綠色)以及局部二級結構(藍色)進行了分類;(b)原生狀態下的突變體被致密電荷面和遠距離探針簡單地分為兩欄,箭頭所指的方向代表著結構剛度的增加,其著色與圖(a)中的小圓圈一致,(b)圖中的插圖也同樣展現出這兩個水合動力學之間的關聯性[124];弛豫時間τ1超快動力學過程源于局部水分子的基本運動(主要包括平動及受阻轉動),而τ2水合動力學過程則是經歷了最初快弛豫過程后隨之而來的水分子網絡重構過程Fig.13.The hydration dynamics, τ1(a)and τ2(b),of all mutants plotted according to the order of their time scales in the native state.(a)The beads above the bars represent the native-state mutants and are classi?ed according to their probe positions(yellow),local charge distributions(green),and local secondary structures(blue).(b)The native-state mutants are simply grouped by two bars,dense charge surfaces and distant probe,and an arrow with the increased structural rigidity,colored with the same code for the beads in(a).(b)Inset also shows the correlation of two hydration dynamics[124].
4.3 生物分子與水分子之間動力學耦合作用研究
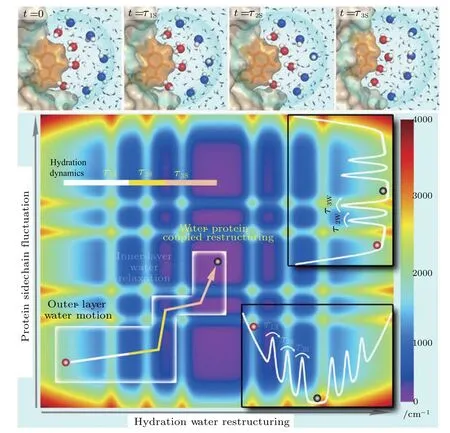
圖14 耦合的水-側鏈在勢能阱中的弛豫 上面4張圖展示的是通過分子動力學模擬獲得的幾種典型的內層(紅色)與外層(藍色)水分子的快照,其弛豫運動與觀察到的溶劑化動力學相對應;在τ1S(20 fs)時,僅有外層水分子發生局部弛豫;在τ2S(130 fs)時,所有水分子都在進行明顯的旋轉運動,但所有水分子都停留在各自的局部區域內,蛋白質并沒有發生顯著的位移;在τ3S(50 ps)時,所有水分子都參與顯著的重排,并與體相水進行交換;與此同時,蛋白質的表面拓撲也發生改變;需要注意的是,τ1S與τ2S的模擬值要比實驗值小得多;下圖展示的是具有構象底物的處于勢能阱中的水合水與耦合色氨酸側鏈的三個弛豫過程,白框里的箭頭所指的束縛弛豫路徑在一開始沒有與蛋白運動發生耦合,展現出超快的外層弛豫(τ1S),接著經歷了兩個受水驅動的水-側鏈弛豫 (τ2S和τ3S),后兩個弛豫過程只通過能阱的一小部分區域;插圖表示用于構建能量圖景輪廓的兩條水合水與蛋白質側鏈的勢能曲線[127]Fig.14.Coupled water/side-chain relaxations in a potential energy basin.(Upper)Four panels show the snapshots of MD simulations following several typical inner-layer(red)and outer-layer(blue)water molecules with the relaxation motion corresponding to the observed solvation dynamics.At time τ1S(20 fs),only the outer-layer water molecules locally relax.At time τ2S(130 fs),all water molecules proceed to signi ficant rotational motion.However,all water molecules remain in the local positions,and the protein does not move signi ficantly.At time τ3S(50 ps),all water molecules have made signi ficant rearrangements and also exchanged with bulk water.Meanwhile,the protein surface topology was also altered.Note that the simulated τ1Sand τ2Stimes are signi ficantly shorter than those observed in our experiments.(Lower)Shown are three relaxation processes of hydration water and coupled tryptophan side chain in a potential energy basin with conformational substrates.The arrow in the white box indicates the constrained relaxation pathway with the initial outer-layer ultrafast relaxation(τ1S),which is not coupled to the protein motion,and two water-driven water/side-chain relaxations(τ2Sand τ3S),which access only a limited region in the energy basin.(Insets)Two potential energy curves of hydration water and protein side chains used in construction of the contour energy landscape[127].
生物分子要維護其功能的正常運轉,必須處于水溶液環境之中.生物分子構象的變化通常與其功能息息相關,其過程會受到溶劑化層周圍水分子的影響.然而這種影響是雙向的.水分子繞著生物分子復雜表面“航行”時,其運動亦受到限制.事實上,分子動力學模擬在理論上已經預言了蛋白質和DNA等生物分子與其結合水之間耦合作用的存在和重要性,并提出了該作用的理論模型.例如,Frauenfelder等[126]基于肌紅蛋白配體相互作用的超低溫研究,提出了水驅動蛋白質漲落的從屬模型.然而,目前如何理順并區分生物分子與結合水兩者的動力學,并在實驗上直接觀測這種耦合作用還非常困難[127,128].結合水動力學對蛋白質等生物分子結構漲落的最終影響基本上沒有被挖掘出來.這主要是由于生理溫度下結合水和生物分子運動的超快特性,特別是界面上結合水與蛋白質相互作用的超快集體弛豫均發生在皮秒時間尺度[129].特別值得一提的是,仲冬平研究組利用色氨酸掃描飛秒熒光光譜技術在該科學問題上做了許多卓越的工作.他們在系統研究蛋白質和DNA等生物分子結合水動力學基礎上[28,123-125],2016年以來開始研究結合水動力學與蛋白質側鏈運動的耦合關系[127-130].通過測量葡萄球菌核酸酶等蛋白質結合水動力學和蛋白質側鏈運動的溫度依賴性,他們確定出三種結合水弛豫和兩種蛋白質側鏈運動.其中有兩種水動力學與蛋白質側鏈運動存在強耦合作用,分別是幾個皮秒的集合水與蛋白質側鏈再取向作用,和幾十個皮秒的合作水與側鏈再構作用.這兩種作用的時間尺度與蛋白質結構和化學性質密切相關.他們還發現蛋白質側鏈弛豫總是比結合水動力學慢,并有相同的能壘,表明兩種弛豫的來源相同,水合層表面的漲落驅動蛋白質側鏈在皮秒時間尺度內的運動(圖14)[127],從而在水與蛋白質耦合運動這個多年難題上取得了突破性進展.
4.4 基于飛秒非線性振動光譜的結構與動力學研究
紅外、拉曼等分子振動光譜是一種直接探測分子基團振動的非介入性分析技術,可提供分子環境和運動行為的直接信息[16,131].因為水及其周圍分子的振動光譜峰位置、寬度、強度、譜形及偏振特性等隨分子間相互作用的不同而改變,因而其能洞悉分子局部相互作用和微觀動力學,以及俘獲氫鍵的局部激發狀態.分子振動光譜技術已經發展成為研究氫鍵的重要工具.近年來,在紅外、拉曼等線性光譜基礎上發展的多維振動超快非線性光譜技術,因其不僅能對非均相環境中的分子提供選擇性的光譜探測,而且還能提供飛秒時間尺度上的復雜凝聚相分子結構與動力學方面的詳細信息[132],成為研究水氫鍵網絡結構及其超快動力學強有力的新手段[133],備受重視.例如,Tokmako ff研究組[134]利用二維紅外光譜技術,通過研究水分子超快動力學過程的頻率依賴特性,獲得了與局域分子運動和分子重排相關的時間尺度分布信息.他們還采用三脈沖振動回波和偏振選擇的抽運-探測技術,考察了體相水(HOD/D2O)超快分子間動力學對O—H振動的影響,獲取了與振動弛豫、振動消相干、分子再取向等動力學過程相關的特征時間:在短時間尺度上,振動弛豫表現為約180 fs的欠阻尼氫鍵振蕩,而觀測到的長時間尺度行為則表明,氫鍵網絡的集合結構重排時間約為1.4 ps;各向異性隨時間的衰變測量給出了50 fs和3 ps兩個時間參數,他們將其分別歸于低頻擺動和轉動彌散[134].利用相似的方法,Pshenichnikov研究組研究了四甲基尿素分子疏水基周圍水分子O—H伸縮振動的氫鍵強弱的變化,獲得了疏水溶質如何影響氫鍵網絡結構與動力學的詳細信息[135].Bagchi研究組采用二維紅外研究了不同水溶液體系中的異質性.他們發現異質性是通過水動力學的顯著改變體現出來的.在反膠束溶液中,研究發現增加體系的尺寸,不同層水分子的動力學行為改變很大.超臨界水熱力學誘導的異質性也能在二維紅外頻譜擴散響應中得以體現[136].Kubarych研究組利用二維紅外光譜成功研究了蛋白質水合層與溶劑之間的耦合情況,發現水合層水分子與蛋白質耦合很強,但與溶劑耦合很弱[137].
值得一提的是,最近發展起來的振動態選擇激發-和頻光譜探測的飛秒時間分辨測量技術能有效提供界面水分子的超快動力學以及界面水非均質化學特性等重要信息[138,139],為全面理解界面水的本質提供了新的條件.近兩三年來,這些超快非線性振動光譜技術已經開始應用到生物膜表面等生物水動力學的研究中[140-143],并取得了一些很好的進展.例如,Bonn研究組采用表面特異性二維和頻光譜研究界面水結構,他們觀察到水在水/空氣界面與水/磷脂界面處的結構差異很大[144];此外,他們采用和頻光譜手段結合從頭算分子動力學模擬研究了水與中性的PC磷脂分子界面、水與胺氮-氧化物表面活性劑單層水的結構和取向,結果發現因為水分子可以從體相到羰基基團形成連續的氫鍵網絡[145].他們最近還研究了抗凍蛋白的水分子結構,發現水/細菌接觸界面的氫鍵增強了鄰近水網絡結構的取向,丁香甲單孢菌的結冰活性位點通過獨特的親-疏水模式來增強冰成核[143].根據穩態和時間分辨的二維和頻光譜研究結果,Bonn研究組提出了十二烷基硫酸鈉表面活性劑和水之間、以及界面水分子之間的微觀模型,即接近表面活性劑頭部的水有獨立的O—H鍵(局域化的O—H伸縮振動),而除此之外的都是非局域化的O—H伸縮振動(共同的氫鍵).且這兩種情況是耦合的,在它們之間存在亞皮秒級的能量轉移,這與空氣/水界面的O—H鍵很不同.他們的結果還表明,與表面活性劑頭部作用的水分子的氫鍵性質和那些與其他水分子作用的氫鍵性質不同[146].最近我們成功利用具有特定能量的飛秒紅外脈沖選擇激發生物膜上蛋白質的N—H基團,然后用飛秒和頻光譜監控N—H基團和酰胺鍵C=O瞬態結構變化,發現氫鍵強弱直接影響到N—H到C=O的振動能量傳遞的途徑與速率[147,148].因為該技術可直接探測水層界面的生物分子和結合水的振動,提供界面生物分子和水分子的超快動力學等重要信息,但不改變水合層分子結構,因而有望發展成為闡明生物分子與其結合水之間耦合終極關系的強有力非介入性新技術.
4.5 蛋白質表面結合水次擴散運動研究
水分子在生物分子表面的擴散運動不僅有助于功能所需基本成分的運輸,而且為生物大分子提供實現其生理功能很關鍵的內在靈活性.最近上海交通大學洪亮研究組結合中子散射和分子動力學(MD)模擬技術,研究不同蛋白質表面結合水分數階的次擴散運動[149],勾勒出表面水分子跳躍情形的清晰圖像[150],為闡明蛋白質周圍表面水分子的反常動力學行為提供了有力證據.與體相水比較,實驗和理論研究結果均表明DNA和蛋白質表面的水合層上的水分子的擴散運動要滯后,表現出異常的次擴散行為[151,152].這種次擴散運動可以用原子均方位移時間的分數冪來描述((1)式).目前對于結合水的次擴散機理存在兩個貌似合理的物理圖像[153-155]:一個是空間無序模型,即生物大分子粗糙表面形成的分形滲透網狀結構阻礙了水分子的擴散;另一個是時間無序模型,即水分子在生物大分子表面陷阱之間跳躍,分子在下一次跳躍之前需要在陷阱里停留,停留時間服從較寬的冪律分布.通過中子散射實驗,他們測量出水分子沿著細胞色素P450與綠色熒光蛋白兩種不同蛋白質表面走過特定距離所花費的時間[149].結果表明,在約10—100 ps時間窗口內的結合水表現出次擴散行為,他們測出的反常擴散指數β的值約為0.8.此外,他們通過分子動力學模擬發現在更寬的時間尺度范圍內(10—103ps)還觀察到這種次擴散行為.不過,進行長時間模擬時水的運動變得越來越擴散,約105ps時擴散指數β值接近于1,也即由次擴散行為轉變到擴散行為.為解釋實驗與模擬中觀察到的異常動力學行為,他們提出了一個水分子在蛋白質表面小籠子(或是俘獲位點)間跳躍的模型.在該模型中,他們假設一次一個陷阱只能容納一個分子.隨著時間的流逝,深的陷阱被填滿了,從而迫使水分子主要在淺陷阱間進行跳躍.也就是說,在較長時間尺度內,處于蛋白質環境中的水可以分為兩類:一類是滯留在深陷阱內的無法動彈的分子,另一類是在淺陷阱間跳躍著的移動分子.通過分析蛋白質表面每個水分子的分子動力學軌跡,他們確認了俘獲事件的存在,并表明連續跳躍前后兩步之間沒有關聯;換言之,一個水分子上一次跳躍的距離與方向并不會對下一步跳躍造成任何影響.這一結論與空間無序模型不符.同時他們還發現分子在下一次跳躍之前需要在陷阱里停留的時間具有較寬的冪律分布,其中大多陷阱等待時間短,非常少量的陷阱等待時間長.這種“無標度”的等待時間分布與連續時間隨機游走模型相符合.他們的結果還表明,多體體積的排斥效應使水分子在淺的囚禁位點上優先跳躍,從而有效加速擴散.水分子更大的流動性最終可以傳遞到周圍蛋白質分子,以獲得蛋白質功能所需的靈活性,從而解釋了為什么酶需要一定的水合作用(約20%的重量)才能表現出明顯的非諧性動力學和生物活性.
5 結論與展望
生物結合水在維護生物大分子的結構、穩定性以及調控動力學性質和生理功能等方面起著決定性的作用.本文介紹了當前生物結合水相關的三個方面的研究進展:1)結合水對生物結構和功能的影響;2)生物分子周圍的水分子結構;3)生物分子水合動力學.整體而言,要闡明生物水的本質,關鍵在于對生物分子表面水分子動力學行為進行空間(分子)與時間分辨率級別(特別是從飛秒到皮秒尺度內的水分子動力學)上的認知.不過,目前在飛秒時間尺度內的生物水研究尚處于起步階段,尚有許多問題有待進一步解決.例如:蛋白質與其環境受碰撞的影響有多大?與蛋白質表面相關的水有幾層?當某個水分子被踢出表面層時它的替換過程是怎樣的?界面、界面幾何形狀、界面電荷、離子、生物分子如何影響生物水的結構與動力學行為?水分子的異質性和排列規整度如何影響生物分子功能?生物分子表面是否存在“剛性”結構的水?氫鍵在水中重排的機理是什么?水分子在蛋白質、細胞和組織等大分子周圍的效應與在小分子周圍的效應有何不同,是否為小分子周圍效應的簡單加和?生物分子與其結合水是如何發生耦合作用的?

