分子特征圖譜預測肌層浸潤型膀胱癌對PD-1/PD-L1抑制劑治療反應
蔡佳佳,石 達,郭廣武,吳 松※
膀胱癌是泌尿系統(tǒng)最常見的惡性腫瘤[1]。最新的統(tǒng)計數據預估2018年美國新發(fā)膀胱癌患者6.2萬例,其發(fā)病率位于男性癌癥的第4位[2];最新的中國癌癥統(tǒng)計學數據顯示,2014年中國新發(fā)膀胱癌7.8萬例[3]。膀胱癌可分為肌層浸潤型膀胱癌(muscle invasive bladder cancer,MIBC)和非肌層浸潤型膀胱癌,其中非肌層浸潤型膀胱癌的治療方式包括經尿道切除術和術后化療或術后膀胱內卡介苗灌注治療等[1]。灌注治療(免疫治療的一種方式)可降低疾病復發(fā)、侵襲和轉移的風險[4]。MIBC或轉移性膀胱癌的標準治療方式是根治性全膀胱切除術和盆腔淋巴結清掃術后輔以化療,對不能從一線化療中獲益或不符合化療標準的患者可選擇免疫治療的方案[5]。MIBC免疫治療具備顯著有效性、持續(xù)反應性和較低毒性的特點[6-8]。程序性死亡受體1(programmed cell death 1,PD-1)與對應的配體——程序性死亡配體1(programmed cell death ligand-1,PD-L1)結合時可抑制免疫系統(tǒng),形成腫瘤免疫逃逸的現(xiàn)象[9]。PD-1/PD-L1抑制劑是MIBC患者有效免疫治療藥物之一,能明顯延長患者總體生存期,但膀胱癌患者對非精準免疫治療的客觀緩解率僅為15%~21%,大部分患者不能從中受益[6,10-12]。因此,需尋找指導精準免疫治療的方案提高治療有效率。近年來,癌癥基因組學的發(fā)展為實現(xiàn)癌癥個性化治療提供了新方向,人類癌癥對藥物反應的分子特征也得到補充[13]。現(xiàn)從MIBC患者對PD-1/PD-L1抑制劑反應的分子特征圖譜方面進行總結分析。
1 MIBC分子特征圖譜與PD-1/PD-L1的關系
腫瘤抗原或被T細胞識別表位的缺乏、腫瘤組織中浸潤性T細胞過少和免疫抑制因子增多均可導致免疫治療失敗[14]。免疫系統(tǒng)激活的過程可分為以下7步:①腫瘤細胞抗原產生;②腫瘤抗原的呈遞;③免疫系統(tǒng)激活;④T細胞向腫瘤組織趨化;⑤腫瘤組織中出現(xiàn)浸潤性T細胞;⑥T細胞對腫瘤細胞識別;⑦T細胞殺傷腫瘤細胞[14]。腫瘤細胞表達的PD-L1與免疫細胞表面PD-1結合而激活的信號通路可抑制免疫活性,導致腫瘤免疫逃逸;PD-1/PD-L1抑制劑通過阻斷以上生物過程可增強免疫活性來殺傷腫瘤細胞[15]。PD-1/PD-L1抑制劑治療MIBC患者是否成功也取決于以上免疫系統(tǒng)激活的7個步驟,其中突變抗原、PD-L1的表達量和γ干擾素的表達量等均可影響免疫治療效果[16]。通過研究以上因素相關的基因突變和表達情況可間接預測PD-1/PD-L1抑制劑在MIBC治療中的反應情況[16]。基因組計劃產生的大量高通量基因組學的數據促進了膀胱癌分子層面的研究,使膀胱癌分子圖譜得到完善,有助于研究者們促進膀胱癌精準免疫治療的發(fā)展[17-18]。
2012年,Sj?dahl等[19]根據93例MIBC樣本中11種特定基因的RNA表達量將其分為5種亞型,分別為Urobasal A型、Urobasal B型、基因組不穩(wěn)定型、滲出型和鱗狀細胞癌樣型;其中浸潤型膀胱癌中表現(xiàn)出免疫細胞特征。2014年,Damrauer等[20]根據數據庫中MIBC基因表達數據的Meta分析結果將其分為管腔樣和基底樣兩個亞型,研究表明管腔樣亞型高表達UPK1B、UPK2、UPK3A和KRT20,而基底樣亞型則高表達膀胱癌基底細胞標志物,如KRT14、KRT5和KRT6B;建立的BASE47基因集可將MIBC亞型進行準確分類。Choi等[21]對73例MIBC樣本的mRNA數據進行聚類分析,將其分為3個不同的亞型,分別為基底型、管腔型和p53樣型,其中p53樣型膀胱癌對于大多化療藥物抵抗,且化療抵抗的樣本中均能發(fā)現(xiàn)p53樣亞型的癌細胞。
2014年癌癥基因組圖譜研究團隊對131例MIBC組織的分子特征(主要包括DNA、RNA、蛋白質)進行探索,將患者DNA突變情況分為A、B、C三個亞型,其中A型為集中擴增型,B型為乳突狀CDKN2A缺失-FGFR3突變型,C型為TP53/細胞周期突變型;根據mRNA表達量將MIBC分為4個亞型,分別為Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型,其中Ⅰ型和Ⅱ型高表達人表皮生長因子受體2和雌激素受體,為膀胱癌的靶向治療提供了理論基礎[18]。2015年,研究者根據MIBC組織的mRNA表達量、體細胞拷貝數變異和基因突變的綜合分型(consensus clusters,CC)將其劃分為CC1型、CC2型和CC3型三個亞型;研究發(fā)現(xiàn)該分型與其他分型的亞型具有相似的特征,如CC3型與基底型和管腔型具有相似的特征[22]。
2017年,Robertson等[17]則根據408例MIBC的mRNA數據將其分為5種不同的亞型,即管腔-乳頭狀型、管腔滲透型、管腔型、基底狀/鱗狀型和神經元型,同時發(fā)現(xiàn)管腔滲透型與2014年定義的Ⅱ型膀胱癌表達特征相似并均對基于順鉑的化療不敏感,但對免疫檢查點抑制劑敏感。另一項研究則發(fā)現(xiàn)2014年定義的Ⅱ型轉移性或不可手術的膀胱癌患者對atezolizumab(PD-L1抑制劑)敏感[6]。研究表明分子特征圖譜展示的信息與癌癥的臨床病理特征及藥物反應相關[10],根據藥物作用靶點和癌細胞基因組學改變情況可針對性地選擇癌癥治療有效的藥物[17]。因此,疾病分子特征圖譜成為輔助指導治療的新方法,有助于臨床醫(yī)師獲得更多基因組學信息并實行精準化醫(yī)療。
2 膀胱癌分子特征圖譜在PD-1/PD-L1抑制劑治療中的應用
美國食品藥品管理局批準5種免疫治療藥物用于化療失敗或者不符合化療標準的晚期膀胱癌患者的治療[6-8]。其中,atezolizumab(PD-L1抑制劑)和pembrolizumab(PD-1抑制劑)已被用作基于順鉑化療方案無效的晚期或轉移性膀胱癌患者的一線治療方案[23]。同時,另一項研究表明免疫檢查點抑制劑治療的反應性與基因組不穩(wěn)定性相關[24]。膀胱癌患者的分子特征可能也與免疫治療應答相關。
2.1基因突變與PD-1/PD-L1抑制劑反應效果的關系
2.1.1特定基因突變對療效的影響 研究發(fā)現(xiàn)超過30%的膀胱癌患者存在非同義突變[25],另一項研究則在膀胱癌中發(fā)現(xiàn)多個調控染色體重組的基因突變,如KDM6A、CREBBP、EP300和ARID1A[26-27]。基因組改變不僅可導致癌細胞信號通路發(fā)生改變(如p53/Rb細胞周期通路、受體酪氨酸激酶/磷脂酰肌醇-3-激酶/哺乳動物雷帕霉素靶蛋白增殖通路和組蛋白修飾染色質調控網絡),也會使腫瘤細胞產生新抗原[28]。在腫瘤發(fā)生過程中由體細胞突變產生的特異性新抗原已被證明能誘導高度選擇性的T細胞應答[29]。突變導致新抗原的產生可激活免疫系統(tǒng)的啟動,影響免疫系統(tǒng)激活的第一步[14]。研究表明腫瘤細胞因體細胞突變產生的新抗原與PD-1和細胞毒T淋巴細胞相關抗原4抑制劑治療療效呈正相關[30]。
2.1.2腫瘤突變負荷(tumor mutational burden,TMB)對療效的影響 TMB是指腫瘤基因組中每個編碼區(qū)的突變總數,在黑色素瘤和非小細胞肺癌中TMB與免疫檢查點抑制劑的應答率相關[24-31]。研究表明TMB高的患者抗細胞毒T淋巴細胞相關抗原4治療效果更好[32]。一項415例MIBC患者的Ⅱ期臨床試驗表明TMB不僅與患者的預后相關,也可用于預測atezolizumab的治療反應效果[6];同時,另一項374例膀胱癌患者的臨床研究也得到了同樣的結論。Balar等[7]則用公式表明兩者間的關系:客觀緩解率=10.8×log(X)-0.7(其中X表示DNA每兆編碼區(qū)突變數),該公式可用于預測腫瘤對PD-1抑制劑治療的反應效果。這些結果提示TMB對免疫治療反應結局的預測具有一定的應用前景,但關于TMB是來源于全外顯子測序還是特定某些基因的測序結果的觀點尚未統(tǒng)一,仍需更多樣本的前瞻性研究進行探索。
2.1.3高度微衛(wèi)星不穩(wěn)定性(microsatellite instability-high,MSI-H)和錯配修復缺陷(mismatch repair deficient,dMMR)對療效的影響 研究表明基因突變率高的患者具有特定DNA損傷反應缺陷,如MSI-H和dMMR[33]。臨床試驗表明具有MSI-H或dMMR特征的實體瘤患者對PD-1抑制劑的有效率更高[34]。這可能是因為dMMR特征腫瘤表達突變相關的新抗原進而識別腫瘤細胞,并激活抗腫瘤免疫[34]。美國食品藥品管理局基于149例實體瘤患者的臨床試驗結果批準默沙東公司生產的pembrolizumab用于治療診斷為MSI-H或dMMR的實體瘤患者[35]。5個KEYNOTE試驗結果表示具有MSI-H和dMMR特性的人群在經過pembrolizumab治療后生存期達到6個月甚至更長時間的反應比率達到78%[34]。MIBC、遺傳性非息肉病性結直腸和子宮內膜癌疾病的一個重要特征是MSI-H,其中MIBC患者中具有該類特征的概率為5%[36-37],表明MIBC患者的基因突變特征可用于預測免疫治療效果。
2.2表達異常與PD-1/PD-L1抑制劑療效的關系
2.2.1PD-L1表達對療效的影響 腫瘤細胞可通過表達PD-L1躲避免疫監(jiān)視進而促進腫瘤的發(fā)生發(fā)展,PD-L1抑制劑則可阻斷該生物過程[8]。在膀胱腫瘤中免疫組織化學實驗測量的PD-L1表達與切除術后病理分級增高和病死率增加有關,表明PD-L1的表達可作為預后因素[38-39]。臨床試驗表明膀胱癌中PD-L1表達量的改變與PD-L1抗體免疫療效相關[8],但以此作為評估免疫治療效果的生物標志物存在一些難以解決的問題:①檢測樣本時使用的實驗方法不同。如在檢測nivolumab(PD-1抑制劑)療效的臨床試驗中使用Dako實驗檢測PD-L1的表達量,但是在durvalumab(PD-L1抑制劑)的臨床試驗中則使用Ventana實驗方法檢測其表達量[40]。②檢測過程中使用的抗體不同。一項針對90例非小細胞肺癌隊列的研究中,比較22C3、28-8、SP263和SP142抗體檢測PD-L1的表達量,發(fā)現(xiàn)腫瘤細胞和免疫細胞使用SP142抗體檢測時得到的PD-L1表達量最少[41]。③檢測樣本的組織來源不同。在一項研究中,研究者選擇免疫細胞表達的PD-L1作為腫瘤組織PD-L1的表達量[42],而另一項研究檢測PD-L1的表達量卻來源于腫瘤細胞[43]。④腫瘤組織內PD-L1的表達量存在異質性,非小細胞肺癌檢測PD-L1表達量時,檢測腫瘤組織的不同部位得到的結果相差近25%[44]。這些研究表明PD-L1的檢測結果受實驗方法、抗體、組織來源和瘤內異質性的影響。
除此之外,關于PD-L1表達陽性的定義也尚未統(tǒng)一,部分研究者認為若有5%以上的腫瘤組織表達PD-L1則為PD-L1表達陽性[45],而另外一些研究者則定義12%以上膀胱癌細胞表達PD-L1才為PD-L1陽性[39]。為解決實驗方法帶來的檢測結果誤差,Huang等[46]通過檢測PD-L1信號通路mRNA的表達量來取代免疫組織化學方法檢測PD-L1蛋白表達水平。該研究納入3個不同的膀胱癌患者的隊列,共695個樣本,使用微陣列基因表達數據表明PD-L1的高表達導致患者的預后較差。這一研究方法從轉錄組水平對PD-L1的表達進行定量,避免了利用免疫組織化學方法所致的檢測結果不穩(wěn)定。
使用PD-L1狀態(tài)作為預測的生物標志物只參考了腫瘤微環(huán)境的一個因素,但腫瘤微環(huán)境還受很多其他因素影響[47-48]。Ock等[49]根據CD8A和PD-L1的表達量將腫瘤微環(huán)境免疫類型分為4種亞型,與其他亞型相比,CD8A和PD-L1表達量增高的Ⅰ型患者具有更高的TMB和更多的新抗原,這些特征導致其對PD-1和PD-L1抑制劑更加敏感。
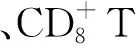
2.2.3基因表達譜對療效的影響 研究表明,基因表達譜是預測化療和免疫治療效果的有效生物標志物[52-53]。Rosenberg等[6]將膀胱癌據根據TCGA(腫瘤基因組圖譜)的分類方法進行分子分型后,發(fā)現(xiàn)該分型與PD-L1拮抗劑治療效果相關;其中,在基底型膀胱癌中表達PD-L1的腫瘤細胞比重達到39%,而在管腔樣膀胱癌中僅為4%;但基底型膀胱癌中PD-L1的表達量增加與PD-1/PD-L1反應性并不呈正相關[6]。與其他亞型相比,經過順鉑治療的管腔Ⅱ型膀胱癌患者對atezolizumab的反應更加靈敏[6],可能因為該亞型基因表達特征與活化T細胞表達相關。這一結論在對順鉑治療耐受的管腔型膀胱癌患者中也得到驗證[23]。管腔型可能是潛在的預測膀胱癌亞型對免疫治療有效的生物標志物,但仍需要更大的樣本對這一結論進行驗證。
以上研究結果強調了癌細胞、免疫系統(tǒng)和腫瘤微環(huán)境之間復雜的相互作用,這一現(xiàn)象在所有類型的癌癥中普遍存在,包括MIBC,提示在研究藥物治療反應過程中,對單方面因素進行預判存在結果偏差,故需對多種因素進行綜合考慮。
3 結 語
近30年來,關于MIBC的治療方案尚無重大進展[54]。免疫治療可延長MIBC患者生存期,療效具有持續(xù)性、低毒性等特點;但不同的患者對PD-1/PD-L1抑制劑的治療效果不同。因此,MIBC患者需更精確的用藥指導。通過對MIBC患者基因突變及表達等分子信息與藥物療效間的關系進行研究及明確MIBC患者的分子特征圖譜與PD-1/PD-L1抑制劑療效間的關系,研究結果表明腫瘤突變抗原、TMB情況、MSI-H或dMMDR特征、PD-L1表達情況、特定基因表達情況和基因表達譜與免疫治療應答情況相關。因此,根據分子特征圖譜針對性選擇藥物對指導患者進行精準免疫治療具有一定的意義。
但實現(xiàn)PD-1/PD-L1抑制劑對MIBC患者的精準免疫治療仍面臨一些問題。①目前尚沒有準確率特別高的單一生物標志物對藥效進行評估,這可能與免疫檢查點抑制劑的作用機制相關,免疫應答效果受多種因素的影響,如治療過程中腫瘤細胞不斷發(fā)展產生新突變抗原;腫瘤組織內存在異質性;PD-L1檢測方式尚未標準化。②獲取MIBC患者的分子特征圖譜的分析方法尚未統(tǒng)一,準確性最高的分子特征也未達成共識,MIBC的分子特征圖譜與MIBC免疫治療效果間的關系需更大的臨床隊列進行驗證。③特征圖譜的準確模式識別有待進一步優(yōu)化,提高其準確性。通過多種生物標志物對MIBC患者分子特征進行綜合評估可提高預測MIBC對PD-1/PD-L1抑制劑治療反應的準確性,同時也需要擴大臨床隊列研究對其進行驗證,實現(xiàn)對MIBC患者的精準免疫治療。

