化痰散結方對Graves病小鼠Th2細胞因子表達的影響*
湯 陽,朱曉云,馮 慧,余 悅,劉喜明**
(1. 中國中醫科學院廣安門醫院 北京 100053;2. 北京中醫藥大學研究生院 北京 100029)
Graves 病(Graves disease,GD)又稱彌漫性毒性甲狀腺腫,是一種常見的、多發的、自身免疫性內分泌代謝疾病,以彌漫性甲狀腺腫和甲狀腺分泌功能亢進為主要特征,其年發生率達2-3‰,女性高發,男女發病比例約為1∶4-1∶6[1]。當前GD的治療方式主要包括抗甲狀腺藥物治療、放射性碘治療、手術等。抗甲狀腺藥物是GD最為常見的治療手段,但停藥后1年復發率高達50%[2]。手術或放射性碘治療易造成甲狀腺功能減退,影響患者生活質量[3]。GD 的發病機制尚未完全揭示,目前公認機體自身免疫功能紊亂是導致本病的關鍵因素,與Th1/Th2,Treg/Th17 細胞等失衡有關[4]。Th2 細胞能夠激活B 細胞進而影響TSH 受體抗體(TSH receptor antibody,TRAb)的表達導致甲狀腺機能紊亂,在GD 是發病中起關鍵作用。細胞因子(IL-4、IL-5、IL-6、IL-10、IL-13 等)作為Th2 細胞發揮作用的關鍵媒介,能夠直接作用于B 細胞受體表面,是GD 發生、發生過程中的重要因子[5-7]。
中醫藥治療GD 雖具有副作用小,復發率低等優勢,但因治療作用機制不明確,一定程度上限制了其應用與發展[8]。GD 屬于中醫“癭氣”、“癭病”范疇,基本病機為氣痰凝結,化痰散結法是公認的治療GD 的基本法則[9]。課題組前期研究發現,化痰散結方能夠有效改善GD 小鼠甲狀腺形態與功能異常,上調脾臟Foxp3 的表達,提高Treg 細胞含量,提高機體免疫耐受能力[10]。但其深層作用機制與環節尚缺乏進一步驗證。本研究在既往研究的基礎上,探索化痰散結方對GD病小鼠Th2細胞相關因子的影響,闡明其免疫作用機制,為臨床應用提供實驗依據。
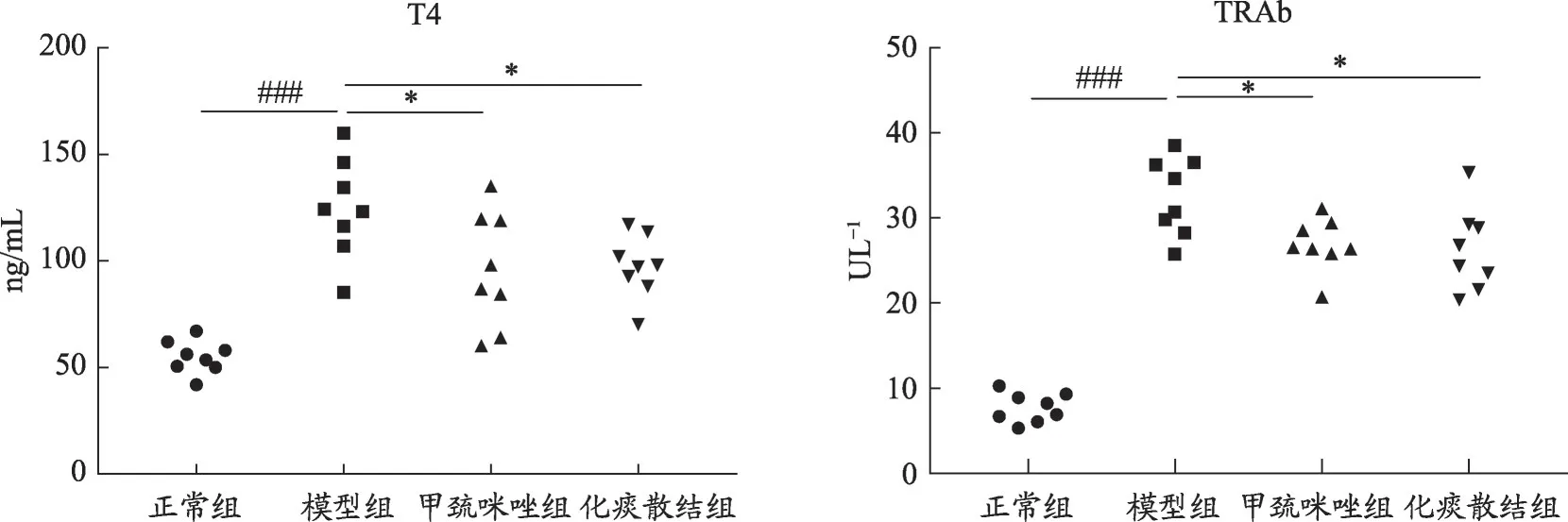
圖1 各組小鼠T4、TRAb水平
1 材料與方法
1.1 實驗動物
清潔級雌性BALB/c 小鼠32 只,體重17-20 g,購自北京華阜康生物科技股份有限公司(許可證號:SCXK(京)2014-0004),飼養于中國中醫科學院廣安門醫院動物實驗中心(許可證號:SYXK(京)2014-0041),適應性飼養1 周。環境:室溫22-25°C 自動控溫,12/12明暗。
1.2 主要試劑與藥物
重組腺病毒Ad-TSHR289 由北京東華坊生物科技有限公司包被;甲巰咪唑片(賽治),德國默克公司;化痰散結組方(夏枯草、土貝母、玄參等),北京豐泰金源藥業有限公司,由中國中醫科學院廣安門醫院藥房提供;T4 及TRAb 試劑盒,法國CIS 公司;Luminex 小鼠細胞因子液相懸浮芯片,上海華盈生物醫藥科技有限公司。
1.3 GD小鼠模型建立與分組
適應性飼養1 周后,根據Ad-TSHR289 誘導的GD小鼠模型方法[11],于第1、4、7 周,每次分別在小鼠脛前肌肉注射含2×109PFU AdTSHR-289 腺病毒的100 μL PBS緩沖液,共免疫3次。另設同周齡正常小鼠8只作為對照組,正常組注射100 μL PBS緩沖液。第10周時將模型小鼠隨機分為模型組、化痰散結組、甲巰咪唑組,每組8只。
1.4 藥物制備與干預
取化痰散結組方54 g,以適量純水浸過藥材2-3寸浸泡0.5 h,煎煮2 次,合并濾液,置于旋轉蒸發儀中減壓濃縮至稠膏(相當于3.05 g·mL-1生藥)備用。按照20 g 小鼠每天給予0.2 mL 液體,依據人與小鼠等效劑量換算,將中藥浸膏稀釋至相對生藥量0.702 g·mL-1,甲巰咪唑混懸于純水中配至0.39 mg ·mL-1。正常組和模型組給予純水,自第10 周開始灌胃給藥,每天灌胃1次,連續給藥6周。
1.5 血清T4、TRAb檢測
將小鼠麻醉后摘眼球取血,室溫靜置2 h,待血清析出后,3000 r·min-1離心5 min,吸取上層血清,-80℃保存。根據T4、TRAb試劑盒的說明,進行檢測。
1.6 HE染色
小鼠處死后,剝離甲狀腺組織,拍照稱重后置于4%多聚甲醛溶液中固定24 h 以上,依次進行脫水、浸蠟、石蠟包埋,切片、脫蠟、水化,經HE 染色觀察甲狀腺組織的病理形態學變化。
1.7 細胞因子檢測
取小鼠血清60 μL,采用Luminex 公司的xMAP 技術,基于微孔板的液相懸浮芯片同時進行Th2 細胞因子檢測,利用梯度稀釋的標準品檢測信號構建標準曲線,實現準確定量。
1.8 統計學方法
采用SPSS 17.0軟件進行統計學處理,計量資料以M±SEM方式表示,兩組均數比較用配對t檢驗分析,多個樣本均數間采用單因素方差分析,P<0.05 為差異有統計學意義。

圖2 各組小組病理HE染色(×400)

圖3 各組小鼠IL-4、IL-5、IL-6、IL-10、IL-13的表達
2 結果
2.1 化痰散結方對GD小鼠T4、TRAb的影響
如圖1 所示,與正常組相比,模型組T4 明顯升高(54.98 ± 2.76 Vs 124.60 ± 8.20,P <0.001);與模型組相比,化痰散結組與甲巰咪唑組T4 水平均明顯下降,差異有統計學意義(97.42±5.20 Vs 124.60±8.20,P<0.05;95.94±9.58 Vs 124.60±8.20,P<0.05)。化痰散結組與甲巰咪唑組之間無統計學差異(P>0.05)。
與正常組相比,模型組TRAb 明顯升高,有顯著性差異(32.57 ± 1.62 Vs 7.71 ± 0.61,P<0.001);與模型組相比,化痰散結組與甲巰咪唑組TRAb 水平均明顯降低(26.27 ± 1.72 Vs 32.57 ± 1.62,P<0.05;26.86 ±1.10 Vs 32.57 ± 1.62,P<0.05);化痰散結組與甲巰咪唑組之間無統計學差異(P>0.05)。
2.2 化痰散結法對GD小鼠形態學的影響
如圖2 所示,各組小鼠甲狀腺HE 染色可見:正常組小鼠的甲狀腺濾泡上皮細胞呈扁平狀,排列整齊,濾泡腔光滑,濾泡腔內充滿均勻、深紅色膠質;GD 組出現甲狀腺細胞濾泡上皮細胞增生明顯,管腔內出現乳頭狀凸起,腔內膠質明顯減少。經過治療后,甲巰咪唑組小鼠甲狀腺的濾泡上皮細胞增生減輕,管腔內乳頭狀凸起輕度縮小,膠質輕度增多;化痰散結組小鼠甲狀腺濾泡上皮細胞增生明顯減輕,排列整齊,局部濾泡腔內充滿均勻、深紅色膠質。
2.3 化痰散結法對GD小鼠Th2細胞相關因子的影響
如圖3 所示,各組小鼠細胞因子水平比較:IL-4、IL-5 組間兩兩比較無明顯差異(P>0.05)。與正常組相比,模型組IL-6 的含量顯著上升(10.05 ± 1.71 Vs 5.56±0.91,P<0.05),經化痰散結方與甲巰咪唑干預后,GD 小鼠血清中IL-6的含量均降低,有統計學差異(6.04 ± 0.74 Vs 10.05 ± 1.71,P<0.05;6.19 ± 0.68 Vs 10.05±1.71,P<0.05)。
IL-10的含量,模型組較正常組顯著上升(145.50±12.40 Vs 91.68 ± 9.94,P<0.05);與模型組比較,化痰散結組和甲巰咪唑組含量降低,但均無統計學差異(115.20 ± 12.47 Vs 145.50 ± 12.40,P>0.05;117.30 ±14.63 Vs 145.50 ± 12.40,P>0.05),而經藥物干預后,IL-10的含量降低,差異無統計學意義。
與正常組相比,模型組IL-13 明顯提高(87.01 ±6.57 Vs 136.70±5.44,P<0.001);與模型組相比,中藥組IL-13 水平有下降趨勢(114.00 ± 7.23 Vs 136.70 ±5.44,P>0.05),西藥組IL-13表達下調,但差異無統計學意義(120.90±13.93 Vs 136.70±5.44,P>0.05)。
3 討論
GD 作為常見的器官特異性自身免疫性疾病,其發病機制與自身免疫失調密切相關。近年來發現多種免疫細胞(Th1、Th2、Th17、Treg)與GD 的發病有關,同時這些免疫細胞間又存在著相互作用[4]。大量研究發現,GD 發病與Treg 比例下降相關[12]。本課題組在GD 模型小鼠脾臟中也同樣發現Treg 比例下降,Foxp3表達下調[11]。Treg 細胞是維持機體免疫耐受,抑制效應性T 細胞活性的重要因子,能夠抑制Th17細胞、Th1細胞、Th2 細胞等促炎作用[13,14]。而Th1 細胞與Th2 細胞作為Th家族的重要因子,相互間又存在著拮抗作用以維持機體免疫平衡[15]。目前認為,Treg/Th17、Th1/Th2失衡是導致GD發病的重要因素,但確切的免疫機制仍在不斷探索驗證。TRAb 是導致GD 自身免疫失常的關鍵因子,其能夠與TSH 受體結合,激活腺苷酸環化酶信號系統,導致甲狀腺細胞增生和甲狀腺激素合成、分泌增加。TRAb 可由B 細胞活化產生,而Th2細胞是激活B 細胞增殖分化的重要因子[14]。Th2 細胞可能在GD 發病中起到最為關鍵的作用。IL-4、IL-5、IL-6、IL-10 與IL-13 等是Th2 細胞合成,在調控體液免疫應答中發揮重要作用[14]。研究發現,這些Th2 細胞因子在GD 患者體內均存在不同程度的異常表達[5,16]。
本研究采用Luminex液相懸浮芯片法進行IL-4等Th2 細胞因子的檢測,是基于該方法是目前檢測細胞因子常用手段,其具有靈敏度高、需血量少等優點,尤其適用血量偏少的動物(小鼠等)進行多個細胞因子的檢測[17,18]。本研究發現GD模型小鼠中Th2細胞相關因子IL-4、IL-5 與正常小鼠比較無顯著性差異(P>0.05),而細胞因子IL-6、IL-10、IL-13則存在著不同程度高表達,提示在本模型中并非所有Th2 細胞因子均是導致疾病的關鍵靶點。
IL-6 作為Th2 細胞分泌因子,能夠促進B 細胞增殖分化,激活自身反應性T細胞,進而導致甲狀腺免疫功能紊亂,誘發GD[19]。IL-6在GD中存在著高表達,經治療后,IL-6 的水平可隨之下降[20,21]。本研究發現化痰散結方與甲巰咪唑可降低GD 模型IL-6 的高表達,與上述結論一致,進一步驗證了IL-6 可能是GD 的關鍵靶點,可作為評價疾病進展與診療效果的衡量指標之一。
IL-10 是多細胞分泌并具有多功能的細胞因子。早期認為IL-10主要由Th2細胞合成,抑制Th1發揮作用,近些年研究發現單核巨噬細胞、T 輔助細胞、樹突狀細胞,Treg 細胞等受特定刺激后均可分泌IL-10[22]。一方面,IL-10 能夠抑制促炎性因子的分泌,同時又能促進B 細胞的增殖、分化和MHCII 類分子表達[23]。目前,IL-10在GD 中的表達狀態尚存爭議,可能與IL-10生成的多來源有關。大量報道發現GD 患者外周血中IL-10 水平明顯高于正常組,并與甲狀腺激素水平呈正相關,經治療后IL-10 水平可隨之降低[5,24-27]。但胡希紅等[28]發現GD 患者IL-10 水平均低于健康體檢者,而經治療后IL-10水平可顯著提高,其認為GD中廣泛存在Treg 細胞比例降低,導致Treg 分泌的抗炎因子IL-10 的水平相應降低。本研究發現,IL-10 在GD 模型小鼠中存在高表達,因此在本模型中,Th2細胞可能是IL-10的主要來源。化痰散結組方與甲巰咪唑均能使其表達下調,但均無統計學意義(P>0.05)。課題組前期發現化痰散結組方能夠提高GD 模型小鼠脾臟Treg 比例[10]。而IL-10 作為Treg 分泌的抗炎因子可能隨之增加。本研究中,化痰散結組方可能在抑制Th2分泌的IL-10 的同時,促進Treg 細胞分泌了IL-10,從而影響了其總含量的測定。
與IL-10相似,IL-13也是具有多種來源與功能的因子,與Th2 細胞關系密切。作為重要的抗炎因子,IL-13 在發揮抑制炎性細胞的同時,能通過激活B 細胞,進而產生IgG 抗體TRAb 從而導致GD 的發生。報道發現,GD 患者外周血中存在IL-13 的高表達[29],證明IL-13在GD發病中具有一定作用。但目前關于IL-13 與GD 的相關性的研究較少,其確切作用與機制仍有待進一步揭示。本研究發現,在GD 模型中,IL-13表達增高(P<0.001),經過藥物干預后,IL-13 水平不同程度降低。
本研究以化痰散結方作為研究對象開展中醫藥干預GD 的實驗研究,具有較強的現實意義。一方面,甲狀腺彌漫性腫大與甲狀腺功能亢進是GD 的核心特征,“痰結于頸”是甲狀腺彌漫性腫大的關鍵病理狀態。化痰散結法是中醫治療GD的最基本的法則,被臨床工作者廣泛應用。開展化痰散結方干預GD 的實驗研究,對闡明中醫藥治療GD 的核心機制有重要意義。另一方面,從中醫證候特征角度出發,Ad-TSHR289重組腺病毒構建的GD 模型存在著明顯的甲狀腺腫大,具有中醫“痰結”的證候特征。因此,采用化痰散結方開展實驗研究符合中醫辨證論治診療特點,其方藥更具有精準性。而GD 其他常見證型(肝氣郁滯、陰虛火旺等)則難以依據動物模型的體征及指標特點找到其相應證候特征,導致了臨床方藥與實驗模型間的應用脫節,為實驗開展帶來一定的不可預知的問題。
本研究發現,化痰散結方能夠抑制甲狀腺濾泡上皮細胞增生,進而減輕甲狀腺腫大,其作用優于甲巰咪唑;同時發現其能夠降低GD 小鼠T4 和TRAb 水平,與甲巰咪唑療效接近,表明化痰散結組方能夠改善甲狀腺分泌功能與形態學異常。同時發現,化痰散結組方能夠不同程度降低IL-6、IL-10、IL-13等Th2細胞分泌因子的表達。既往研究證實,化痰散結組方能夠上調GD 模型中Treg 的含量。而Treg 是維持機體免疫耐受的關鍵因子,能夠抑制Th2細胞的表達,進一步佐證了化痰散結方對Th2細胞及其相關因子的調控作用。
綜上所述,IL-6、IL-10、IL-13 作為Th2 細胞分泌的關鍵因子,參與GD 的發病過程。而化痰散結方可能是通過降低IL-6、IL-10、IL-13 等的表達,進而改善機體免疫應答反應,從而起到治療GD 甲狀腺功能與形態異常的作用。

