基于血管新生探討活血化瘀中藥對腫瘤轉移的影響*
王愛云,韋忠紅,余蘇云,錢 程,鄒 偉,楊春媚,張 珊,吳媛媛,李曉曼,陳文星,陸 茵,3**
(1. 南京中醫藥大學藥學院,江蘇省中藥藥效與安全性評價重點實驗室 南京 210023;2. 南京中醫藥大學,江蘇省中醫藥防治腫瘤協同創新中心 南京 210023;3. 南京中醫藥大學,中藥品質與效能國家重點實驗室(培育) 南京 210023)
1 腫瘤血管新生在腫瘤轉移中起著至關重要的作用
1971 年,哈佛大學Juda Folkman 教授提出腫瘤生長和轉移都依賴于血管新生(Angiogenesis)[1],認為抑制血管新生可以抑制腫瘤生長,從而“餓死腫瘤”。血管新生是指活體組織已存在的微血管床上芽生出新的以毛細血管為主的血管系統的過程[2]。諸多重大疾病均由血瘀而致血管異常新生,而在腫瘤組織環境下,新生血管的結構及功能有別于正常的血管(見圖1),腫瘤血管形成呈持續、失控性的過程,造成血管呈現結構紊亂、迂回曲折、粗細不等、分支過多、局部膨大等情況;血管內皮細胞形態還會出現層疊生長、伸入管腔,細胞間縫隙加大,形成較多開口;血液滲漏增多,血管滲出和淋巴回流間平衡被破壞,組織間流體靜壓增高等。從而導致腫瘤血流異常,酸性物質累積,血流灌注受損,妨礙藥物輸送與擴散,腫瘤細胞更容易入血向遠端轉移。因此,血管新生對腫瘤的發展和轉移過程起重要作用,抑制這一過程或許可以阻止腫瘤的發展與轉移[3]。恩度及人參皂苷Rg3 就是在該學說的指導下,作為治療藥物應用于臨床所研發的。
活血化瘀中藥是否對血瘀所致血管新生異常有調控作用,其內在機制是什么?這個問題激起了課題組探求的欲望。
血瘀所致凝、黏、濃、聚的病理狀態,會打破抑制血管新生和促進血管新生因子之間的均衡(見圖2)。血瘀證可導致血循環障礙、血小板活化及黏附聚集、血液高黏狀態、血栓形成等多種病理變化[5],并釋放缺氧誘導因子1α(HIF-1α)、環氧酶-2(COX-2)、抗凝血酶III(ATIII)、血小板活化因子(PAF)、干擾素(INF)、白介素(IL)、血管抑素(Angiostatin, AS)、內皮抑素(Endostatin,ES)、血管內皮生長因子(VEGF)、血小板衍生因子(PDGF)、成纖維細胞生長因子(FGF)、表皮細胞生長因子(EGF)等多種因子,INF、IL、AS、ES 等血管生成抑制因子導致血管生成不足,而VEGF、PDGF、FGF、EGF 等促血管生成因子最終導致血管新生過度(見圖2)。
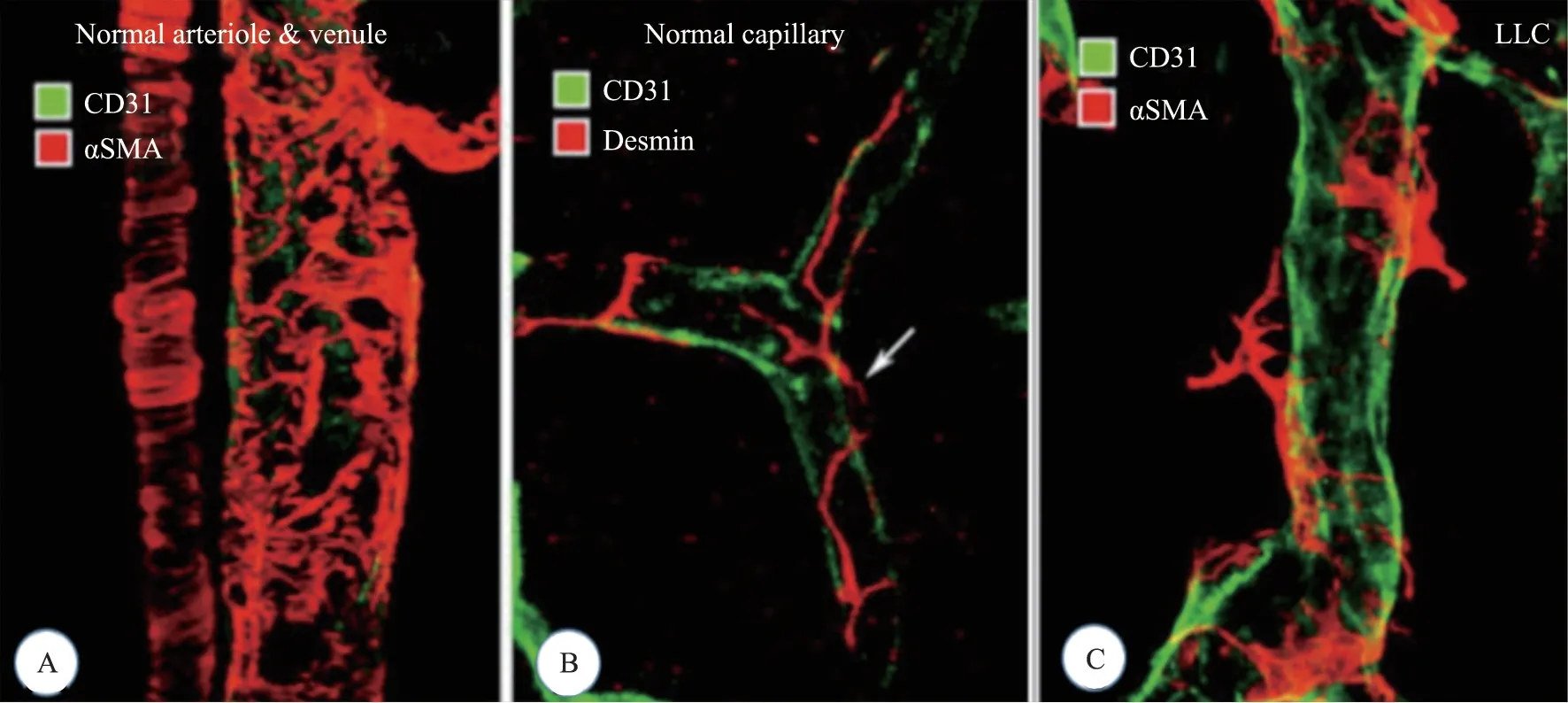
圖1[4] 正常血管與腫瘤血管結構比較:A正常血管動靜脈;B正常的毛細血管;C腫瘤血管,周細胞與內皮連接松散

圖2 血瘀狀態打破抑制血管新生和促進血管新生因子之間的均衡
在腫瘤組織中,由于腫瘤的快速增殖,分泌大量促血管新生因子,刺激內皮細胞增殖、遷移,形成新生血管。腫瘤的血管新生是腫瘤細胞和微環境中其他細胞相互作用產生的各種因素所致,如生長因子(VEGF、FGF、PDGF 等)和相關受體(Notch 信號受體、整合素等)[6]。VEGF 特異性作用于血管內皮細胞,具有強大的促進內皮細胞增殖和遷移的能力,實體瘤內的缺血、缺氧導致大多數腫瘤細胞過表達VEGF,從而誘導腫瘤血管的新生[7]。在纖維肉瘤模型中,PDGF 與FGF 存在高表達情況,兩者可相互作用,促使內皮細胞與周細胞的分離,導致腫瘤內部紊亂的血管形成[8]。DLL4 和Jag1 在調控血管新生中具有相反的功能,內皮細胞中DLL4 和Jag1 表達的平衡對腫瘤血管結構的形成具有重要的意義,用Notch1 類似物干擾Jag/Notch相互作用,能夠減少血管生成的萌芽和周細胞的覆蓋,而干擾DLL4 則導致腫瘤血管增生高度萌芽[9]。此外,整合素integrin作為一類具有信號轉導功能的細胞表面黏附分子,幾乎參與腫瘤轉移的全過程,研究發現,integrin αvβ3 在肺癌、結腸癌、胰腺癌和乳腺癌的血管生成時表達增強[10]。
2 活血化瘀中藥對腫瘤血管生成是促進還是抑制?
有報道認為,活血化瘀藥促進腫瘤血管新生,如2006 年有報道[11]丹參、赤芍或莪術煎劑能提高動物腫瘤組織微血管密度,使VEGF蛋白表達增加,腫瘤血管新生增多。2014 年閔亮等[12]報道,活血方大黃蟄蟲丸能抑制原位移植瘤的生長,但促進了腫瘤血管新生和腫瘤肺轉移,而活血方血府逐瘀湯和桂枝茯苓丸對移植瘤的生長、轉移及腫瘤血管新生沒有明顯的影響。
也有研究顯示,活血化瘀藥對腫瘤血管新生有抑制作用。如Zhang L 等[13]報道隱丹參酮能通過調節MMP/TIMP 系統、PI3K/Akt/mTOR 信號傳導和HIF-1α核轉位來抑制炎癥和腫瘤血管新生,從而抑制結腸癌的生長和侵襲。姜黃素通過下調VEGF和FGF抑制致癌過程[14],其抗血管新生主要基于抑制NF-κB 轉錄,還能抑制基質金屬蛋白酶和纖溶酶原激活以及細胞黏附分子。
本課題組研究發現,丹參素和隱丹參酮都能抑制腫瘤血管新生和腫瘤侵襲[15-16],β-欖香烯通過抑制血管內皮生長因子介導的血管新生來抑制黑色素瘤的生長和轉移[17]。我們總結了包含課題組在內近幾年報道的關于抗血管新生特性活血化瘀中藥的藥理作用環節(見表1),證明活血化瘀藥不同成分調控的靶點參與血管新生及腫瘤轉移的不同過程。
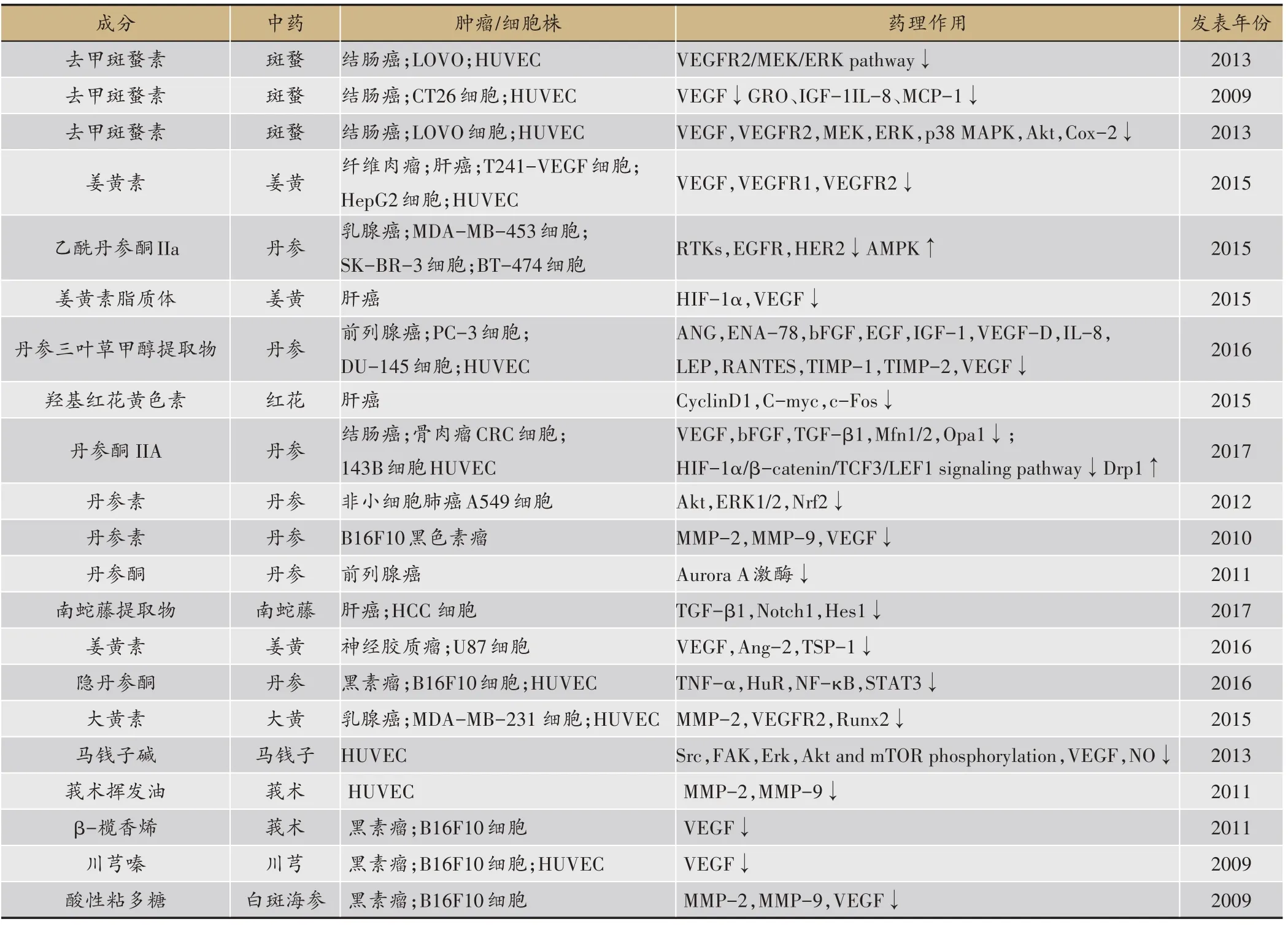
表1 近幾年報道的抗血管新生特性活血化瘀中藥藥理作用環節小結[18-29]
那么具有活血化瘀作用的中藥及復方對腫瘤轉移是抑制還是促進?課題組率先在國內建立從血管出芽、重構及血管網狀結構的體內外血管新生模型,及血管新生的生物調控網絡系統,并基于所構建活血化瘀中藥成分靶點網絡數據庫,發現活血化瘀藥不同成分調控的靶點參與血管新生及腫瘤轉移的不同過程[30],對腫瘤轉移發揮促進或抑制的正反調控作用:如富含芳酸類成分的赤參、紅花、川芎等因結構類阿司匹林而作用于環氧合酶COX,抑制癌栓導致血管新生受抑,腫瘤轉移減少[31];含肝素類成分的水蛭等作用于抗凝血酶Ⅲ,抑制血管新生而促轉移;含尿激酶樣功能基團的地龍等促進血管芽生從而促轉移。調控血管芽生的生物網絡是一個雙向開關,調控方向取決于血管新生所處的微環境,其更深入的機制還有待進一步探討。
課題組總結分析文獻資料并通過近十四年的研究認為,活血化瘀中藥整體藥效表征并不是單一成分藥效的簡單加和,而是中藥多成分、多環節、多靶標的整合調節作用。活血化瘀中藥多組分之間“同類相須、異類協同、多類整合”的調節機制,共同構成了活血化瘀法抑制血行轉移作用機制的重要內涵[32]。
活血化瘀中藥在中醫抗腫瘤方劑中使用頻率極高,長期以來,人們對活血化瘀中藥是促進腫瘤轉移,還是抑制腫瘤轉移存在爭議,從而使得臨床醫生感到困惑,我們的研究可以為臨床提供一個重要參考,但腫瘤轉移是一個復雜的、多步驟的分子病理過程,因此僅從血管新生角度來闡釋還不夠全面,比如腫瘤細胞的外滲過程也會影響腫瘤轉移[33]。我們希望通過一步步積累,從點到面,能充分利用現代科學技術闡釋活血化瘀治則治法的本質。

