麥粒灸對抑郁大鼠ERK-Nrf2通路海馬神經保護作用機制的研究*
覃美相,粟勝勇,母 葉,蔣香玉,黃小珍,黃 梅,蔡慧倩
(1. 廣西中醫藥大學研究生學院 南寧 530001;2. 廣西中醫藥大學第一附屬醫院 南寧 530023)
抑郁癥是由多種原因引起的,以情緒持續低落、興趣下降或煩躁不安等心境及情感性障礙為主要癥狀的一組臨床癥候群[1]。其發病率高,僅次于心臟病[2-4]。研究發現,抑郁癥的發病與海馬神經受損密切相關,其最主要致病機制之一是炎癥反應與氧化應激[5-7]。絲裂原活化蛋白酶(MAPKs)是介導細胞內反應的重要信號通路,參與生物活動的生理病理過程,細胞外調節蛋白激酶(extracellular signal-regulated kinase,ERK)屬于MAPK 家族中的一員,是重要的信號轉導途徑之一,其對神經細胞具有生長、分化、增殖及抑制凋亡的調節作用,并在行為和認知方面如學習、記憶等起關鍵作用[8,9];核因子E2 相關因子2(nuclear factor erythroid-2-related factor 2,Nrf2)是抗氧化系統及免疫炎癥反應中最重要的共同轉錄因子[10,11],Nrf2信號通路系細胞內氧化應激最重要的防御環節,當細胞發生氧化應激即可激活Nrf2,引發于其調控下抗氧化物及相關酶類的大量表達,從而抵御氧化應激,避免細胞損傷凋亡[12]。
彭希等[13]研究發現,提高大鼠腦內ERK 信號通路關鍵分子的功能和表達,可以有效地改善大鼠抑郁行為。Senthil 等[14]報道稱ERK1/2 磷酸化可以激活Nrf2和轉錄因子活化蛋白-1,誘導多種下游基因如血紅素氧合酶-1 表達,避免神經元凋亡。目前關于ERKNrf2 信號通路對抑郁癥的神經保護作用的研究缺乏,故本實驗旨在構建抑郁癥大鼠模型,通過與空白組、麥粒灸組、氟西汀組對照,觀察大鼠Open-Field 行為學、糖水偏愛、體質量改變情況,運用透射電鏡觀察海馬神經元形態結構,WB 檢測海馬中P-ERK、Nrf2蛋白的變化,探討基于ERK-Nrf2 信號通路“通督調氣法”麥粒灸對抑郁癥模型大鼠海馬神經元的影響,以揭示麥粒灸治療抑郁癥的可能作用機制,為臨床麥粒灸治療抑郁癥提供實驗依據。
1 材料與方法
1.1 實驗動物與分組
SD 大鼠32 只,SPF 級,體重250±20 g,雌雄各半,動物來源:廣西壯族自治區食品藥品檢驗所實驗動物中心(動物生產許可證號:SCXK 桂2003-0001)。適應性飼養1 周后,按隨機數字表將性別、質量分層,隨機分為4組:空白組、模型組、麥粒灸組、氟西汀組,每組8只。實驗遵照《關于善待動物的指導性意見》,并嚴格遵守生物安全制度及相關規章。
1.2 造模方法
所有大鼠購買放置實驗室動物房后,適應性飼養1 周,使其機體恢復正常代謝水平,稱重記錄;適應性飼養后對其進行初始Open-Field 行為學測定、糖水偏愛試驗及體質量測量,記錄留檔。
1.2.1 造模方法
參考文獻[15]造模方法并做相應改進,采用孤養結合長期不可預見性溫和刺激模型(CUMS),予模型組、麥粒灸組、氟西汀組3組大鼠21 d不同的應激,包括冰水游泳(4℃,5 min),24 h 禁水、禁食,1 min 夾尾,搖晃(1 次·s-1,15 min),晝夜顛倒,束縛(5 min·次-1)等刺激,每種刺激各進行3 次,相鄰2 d 采用的刺激方式不同。空白對照組:自由攝食飼養,不接受任何刺激。
1.2.2 模型評價
參照文獻[16]對抑郁癥模型的評價:大鼠接受21 d慢性綜合應激后進行Open-Field 行為學測定、糖水消耗量實驗及體質量測量,各項分值均下降,并表現出精神運動遲鈍、興趣下降或喪失、快感缺乏等特征時,提示造模成功。
1.3 干預方法及療程
1.3.1 空白組
在相同環境下正常飼養,不予任何處理。
1.3.2 模型組
共接受21 天CUMS 造模后繼續孤養,不給予任何治療。
1.3.3 麥粒灸組
參照大鼠穴位圖譜[17]選取百會、大椎、至陽、合谷(雙)、太沖(雙)穴,每日上午9:00 進行麥粒灸治療。治療操作:用電動刀片將穴區皮膚刮凈,穴區皮膚涂少許石蠟油,將直徑約0.2 cm,高約0.2 cm 的圓錐形艾炷置于大鼠穴位皮膚上點燃施灸,灸至以大鼠出現掙扎、撕叫、逃避等行為時用鑷子將艾炷取下,此為1壯,每穴每日6壯,連續治療10 d。
1.3.4 氟西汀組
每日上午9:00 給予氟西汀藥物治療。操作:按1.8 mg·kg-1劑量用生理鹽水調配氟西汀,使用灌胃針灌胃給藥,每日1次,連續干預治療10 d。
1.4 主要試劑及儀器
1.4.1 實驗主要試劑
Anti-Phospho-ERK1 (T202) + ERK2 (T185)Antibody(廠家:博士德生物,貨號:BM5446);Anti-Nrf2(NFE2L2) Antibody(廠家:博士德生物,貨號:PB9290);山羊抗兔的二抗(廠家:北京博奧森,貨號:ZB2301)等。
1.4.2 實驗主要儀器
電泳儀(廠家:北京六一,儀器型號:DYCZ-24DN);半干轉膜儀(廠家:日本ATTO,型號:WSE-4040));稱量天平:(廠家:Sartorius 公司,型號:BP310P);低溫離心機:(廠 家:eppendorf,型號:Centrifuge 5417R)UVP凝膠成像系統:(廠家:thermo公司,型號:CA91786 U.S.A UVP GDS-8000 System)等。
1.5 療效性指標評價
1.5.1 階段評分變化
造模前、造模后、接受10 d 干預治療后分別進行3次Open-Field 行為學測定、糖水消耗量實驗及體質量測量,對比3個階段的評分變化。
①敞箱測試得分反映大鼠活動度及對周圍事物的興趣高低。Open-Field 行為評分實驗記分方法:以大鼠穿越底面格數為水平活動得分,大鼠四只腳均在同一格子內為一格,穿越1 格記1 分,如大鼠沿線直走,以每10 cm 為1 分;以大鼠直立次數為垂直活動得分,雙足離開底面為標志(兩前爪騰空或攀附墻壁1次記1分)。兩項之和為敞箱實驗總得分。
②糖水消耗試驗反映大鼠對獎賞的快感反應。糖水消耗量實驗:大鼠進行1%蔗糖水攝取實驗,第一個24 h,每籠同時放置2個均裝有1%蔗糖水水瓶;隨后的24 h,放置裝有同等容量1%蔗糖水、純凈水各1 瓶,記錄各個消耗量;1%蔗糖水消耗量:禁食禁水24 h后,測定1 h大鼠飲用1%蔗糖水和純凈水的量,以計算糖水偏愛度(糖水偏愛=糖水消耗量/總液體消耗×100%)。
③體質量測量結果反映其體重增長趨勢。體重測量:分別用電子秤測量各大鼠體重,記錄比較各組大鼠體重增減趨勢。
1.5.2 主要檢測方法
通過透射電鏡觀察海馬神經元形態結構;WB 檢測海馬組織中p-ERK、Nrf2 的蛋白水平,以觀察ERKNrf2信號通路的活化情況。
1.6 標本采集及檢測方法
1.6.1 標本采集
各組大鼠共32 只,干預結束后禁食12 h,以脫臼法處死后。分組快速取出大鼠腦組織,并迅速分離出海馬組織。取部分海馬組織,放入2%戊二醛中固定,作為電鏡標本,放入4℃冰箱保存備用。另一部分大鼠海馬組織,用生理鹽水沖洗分裝后迅速置入液氮中保存,而后將標本置于-80℃冰箱保存,待提取其蛋白,用于WB檢測。
1.6.2 透射電子顯微鏡檢測
電鏡標本制作:①固定:用PBS 漂洗4 次,停留15 min,再用1%鋨酸固定1 h。②脫水:梯度丙酮脫水。③滲透:100%丙酮:環氧樹脂(1:1)滲透放入恒溫箱(60℃)聚合12 h;③切片:半薄切片,染色,在光鏡下觀察,選定區域,修塊,進行超薄切片。染色:20K醋酸鈾染色15 min,檸檬酸鉛染色5 min,晾干;④透射電鏡觀測及拍照,觀察大鼠海馬神經元細胞的結構變化。
1.6.3 蛋白免疫印跡(Western Blot)檢測
p-ERK、Nrf2 的蛋白水平檢測:①組織研磨及蛋白提取:取30-100 mg組織用液氮進行研磨,加入裂解液,冰上裂解1 h,4℃,13000 r·min-1,離心10 min,將上清轉移到新的離心管中。②蛋白濃度測定及樣本制備:用考馬斯亮藍試劑盒測定樣本蛋白濃度,并記錄;將樣品加入相應4*loading buffer,100℃煮沸10 min,12000 rpm 離心1 min,準備上樣。③SDS-PAGE 電泳:按照目的蛋白分子量大小調配不同濃度的SDS-PAGE膠,其操作步驟如下:制作10%SDS-PAGE凝膠電泳分離膠10 mL;制作5%SDS-PAGE凝膠電泳成層膠5 mL;上樣:等膠凝固好后,拔去梳子,電泳緩沖液清洗上樣孔,將準備好的樣品上樣。電泳:起初,恒壓80 V,30 min之后恒壓調至120 V,持續1 h。④免疫印跡:電泳操作結束后,從玻板上卸下PAGE 膠,裝配轉膜三明治,恒流,300 mA轉60 min,將蛋白轉移到PVDF膜上。⑤免疫發光:封閉:用含5%脫脂奶粉的PBST 溶液室溫封閉膜2 h;孵育一抗:一抗孵育過夜;洗膜:用TBST洗膜3 次:每次5 min;孵育二抗:用封閉液稀釋各蛋白一抗對應的二抗。室溫下孵育膜1 h。洗膜:用TBST 洗膜3 次:每次5 min;X 光顯影:在暗室中將膜置于平鋪好的保鮮膜上,按照同等比例混合A液和B液,將混合液均勻滴加于膜上,等待反應60 s。吸水紙上瀝干膜上多余的ECL 底物反應液,置于平板上,鋪上保鮮膜,用保鮮膜包裹PVDF 膜,此時注意避免產生氣泡,放入暗盒中,而后放上適當大小的X 光片,關閉暗盒,曝光。取出X 光片,放入顯影液中,待條帶顯好后取出,在清水中漂洗一下,放入定影液中定影。取出X 光片,晾干,拍照。
1.7 統計學處理采用
采用SPSS17.0 統計軟件進行統計學處理,計量資料用均數±標準差(± S)表示,組間均數的兩兩比較采用t檢驗;多個樣本間的比較采用單因素方差分析。以P<0.05為差異具有統計學意義的標準。
2 結果
2.1 麥粒灸對抑郁癥模型Open-Field 行為學(敞箱試驗)影響
表1 結果顯示,造模前,空白組、模型組、麥粒灸組、氟西汀組各大鼠的敞箱試驗總得分差異無顯著性意義(P>0.05);造模后,與空白組比較,模型組、麥粒灸組及氟西汀組各大鼠的敞箱試驗總得分均明顯下降(P<0.05);治療后,麥粒灸組、氟西汀組各大鼠的敞箱試驗總得分對比模型組均明顯升高(P<0.05);麥粒灸組與氟西汀組比較無顯著性差異(P>0.05)。
表1 各組大鼠敞箱試驗總得分的比較(± s,n = 8)

表1 各組大鼠敞箱試驗總得分的比較(± s,n = 8)
注:Δ表示與造模前比較,P <0.05;#表示與空白組比較,P <0.05;*表示與模型組比較,P <0.05;a表示與氟西汀組比較,P >0.05.
干預后/分60.00±2.67 25.75±3.77#50.00±5.15*a 54.88±3.68*分組空白組模型組麥粒灸組氟西汀組造模前/分63.50±3.34 60.38±1.41 61.50±2.83 61.50±3.34造模后/分50.13±5.49 44.88±3.29Δ 42.75±2.96Δ 38.25±3.73Δ
2.2 麥粒灸對抑郁癥模型大鼠糖水偏愛度的影響
表2 結果顯示,造模前,空白組、模型組、麥粒灸組、氟西汀組各大鼠的糖水偏愛度差異無顯著性意義(P>0.05);造模后,與空白組比較,模型組、麥粒灸組及氟西汀組各大鼠的糖水偏愛度明顯下降(P<0.05)。治療后,麥粒灸組、氟西汀組各大鼠的糖水偏愛度對比模型組均明顯升高(P<0.05);麥粒灸組與氟西汀比較無顯著性差異(P>0.05)。
表2 各組大鼠糖水偏愛度的比較(± s,n = 8)
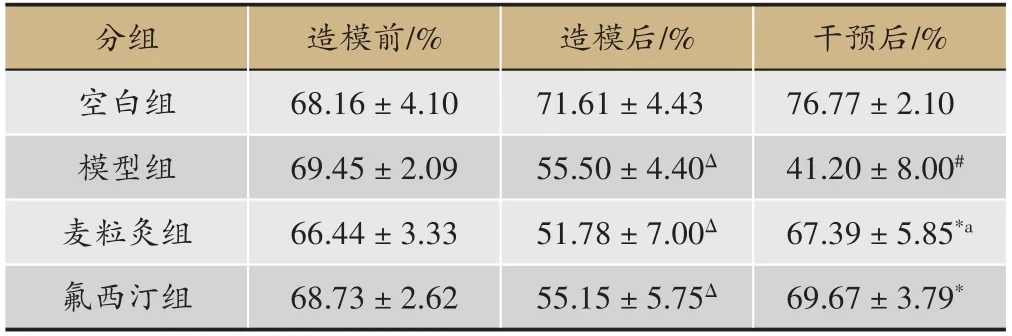
表2 各組大鼠糖水偏愛度的比較(± s,n = 8)
注:Δ表示與造模前比較,P <0.05;#表示與空白組比較,P <0.05;*表示與模型組比較,P <0.05;a表示與氟西汀組比較,P >0.05.
干預后/%76.77±2.10 41.20±8.00#67.39±5.85*a 69.67±3.79*分組空白組模型組麥粒灸組氟西汀組造模前/%68.16±4.10 69.45±2.09 66.44±3.33 68.73±2.62造模后/%71.61±4.43 55.50±4.40Δ 51.78±7.00Δ 55.15±5.75Δ
2.3 麥粒灸對抑郁模型大鼠體質重的影響
表3 結果顯示,造模前,空白組、模型組、麥粒灸組、氟西汀組各大鼠的體質重差異無顯著性意義(P>0.05);造模后,空白組大鼠體質重顯著高于其他三組(P<0.05)。治療后,與模型組比較,麥粒灸組、氟西汀組大鼠體質重均明顯升高(P<0.05);麥粒灸組與氟西汀比較無顯著性差異(P>0.05)。
表3 各組大鼠體質量測量的比較(± s,n = 8)
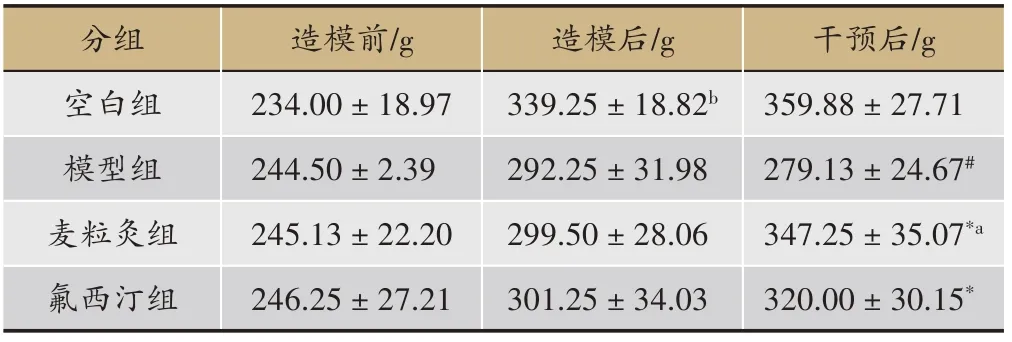
表3 各組大鼠體質量測量的比較(± s,n = 8)
注:b表示造模后與模型組、麥粒灸組、氟西汀組比較,P <0.05;#表示與空白組比較,P<0.05;*表示與模型組比較,P <0.05;a表示與氟西汀組比較,P >0.05.
干預后/g 359.88±27.71 279.13±24.67#347.25±35.07*a 320.00±30.15*分組空白組模型組麥粒灸組氟西汀組造模前/g 234.00±18.97 244.50±2.39 245.13±22.20 246.25±27.21造模后/g 339.25±18.82b 292.25±31.98 299.50±28.06 301.25±34.03
2.4 干預后抑郁模型大鼠海馬神經元細胞的結構變化
透射電鏡觀察發現(圖1),空白組:海馬組織神經元細胞核結構正常,神經細胞核呈橢圓形,核膜清晰完整,核仁位于核中間,胞漿內細胞器豐富,未見線粒體腫脹壞死。模型組:海馬組織神經元細胞核異常,可見神經元細胞腫脹,核內核仁完全溶解消失,可見細胞胞漿疏松,胞漿內細胞器數量明顯減少。麥粒灸組:海馬組織神經元細胞核輕度異常,神經細胞核呈橢圓形,核膜不清晰,染色質散在分布于核膜上,胞漿內細胞器豐富,未見線粒體腫脹壞死。氟西汀組:海馬組織神經元細胞核輕度異常,神經細胞核呈橢圓形,核膜不清晰,可見核仁完全溶解,胞漿內細胞器豐富,未見線粒體腫脹壞死。
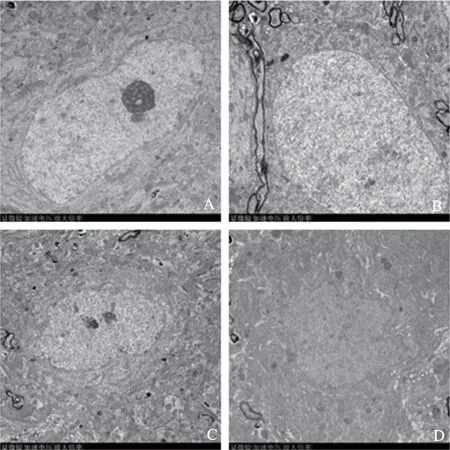
圖1 各組海馬神經元結構變化
2.5 干預后抑郁模型大鼠P-ERK、Nrf2蛋白表達情況
與空白組比較,模型組P-ERK、Nrf2 蛋白表達明顯下降(P<0.05);與模型組比較,麥粒灸組、氟西汀組p-ERK、Nrf2蛋白表達均明顯升高(P<0.05);麥粒灸組與氟西汀組比較P-ERK、Nrf2 蛋白表達無明顯差異(P>0.05)(圖2,表4,)。
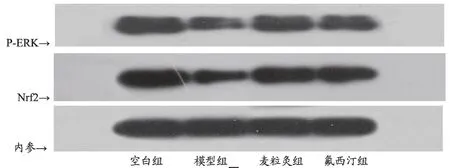
圖2
表4 各組大鼠P-ERK蛋白含量的比較(± s,n = 8)
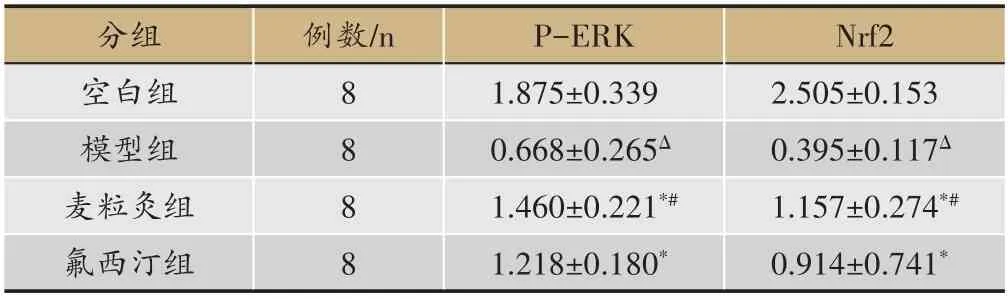
表4 各組大鼠P-ERK蛋白含量的比較(± s,n = 8)
注:Δ與空白組比較,P <0.05;*與模型組比較,P <0.05;#與氟西汀組比較,P >0.05.
分組空白組模型組麥粒灸組氟西汀組例數/n 8 8 8 8 P-ERK 1.875±0.339 0.668±0.265Δ 1.460±0.221*#1.218±0.180*Nrf2 2.505±0.153 0.395±0.117Δ 1.157±0.274*#0.914±0.741*
3 討論
抑郁癥歸屬于中醫“郁證”、“百合病”等范疇,祖國醫學認為憂思等情志過極為本病的主要原因,情志抑郁使氣機不暢,氣機疏泄失常,陽氣舒發不利,清陽不展系發為本病的關鍵。百會乃足太陽、手足少陽、督脈、足厥陰肝經之交會穴,屬督脈,乃經脈交會之最,刺激此穴,具有溫經,升陽固脫,安神健腦,清熱開竅等作用;《素問·骨空論篇》曰:“督脈者,起于少腹以下骨中央……上額交顛上,入絡腦。”灸取百會可通調督脈,調動機體陽氣生發,疏通肝經之氣;《甲乙經》述“大椎……三陽督脈之會。”灸取大椎能溫陽推動陽氣生化運轉;至陽,至,有至極之意,穴屬督脈,位于背部,當第七椎之下,督脈為陽經,背亦屬陽,七乃陽數,三陽為極,結合艾灸溫通之性,可升提一身之陽氣;太沖為足厥陰肝經原穴,屬陰主血,主“胸脅支滿, ……終日不得太息”,合谷乃手陽明大腸經之原穴,屬陽主氣,兩穴相配,可氣血、臟腑同調;諸穴合用意有“通督調氣”之旨,治可疏肝理氣,調養心神,協調臟腑,鼓動氣機,宣發陽氣,調節情志。
慢性應激能夠激活免疫系統,刺激產生炎性細胞因子,系誘發抑郁癥發生的重要因素[18]。而心理應激是抑郁癥發生或復發的另一危險誘因,其可激活交感神經系統釋放兒茶酚胺,進而使大腦耗氧量增加;激活HPA 軸大量釋放的糖皮質激素激活免疫應答與炎性反應系統,導致炎性細胞因子增多,且細胞因子與炎癥細胞相互作用可引起自由基的產生增加[19-20]。MAPK 通路是生物體內重要的信號轉導系統之一,參與細胞生長、發育、分化、凋亡及細胞間的功能同步等多種生理反應。而ERK 屬于MAPK 的一員,其可通過直接或間接活化作用,抑制細胞凋亡,促進細胞存活[21]。MAPK 激活可促進ERK 發生磷酸化從而激活下游轉錄因子,Nrf2 轉錄因子是細胞抗氧化還原的核心環節,在氧化應激反應中起關鍵作用,可驅動自由基陽離子通道發揮內源性穩態,在抑制炎癥、避免細胞凋亡、保護神經等方面起著重要的作用[22,23],而提高ERK1/2活性可有效減少神經細胞凋亡[24]。
研究發現[25],ERK 信號通路能被抗抑郁藥及情緒穩定劑激活,對大腦中神經產生、突觸可塑性起調節作用,也有報道指出,氟西汀治療能促進大鼠內側前額葉皮質邊緣下區ERK1/2 的活化,對恐懼記憶具有促消退的作用[26]。既往研究發現,氟西汀干預治療,能減少肺炎球菌性腦膜炎大鼠海馬凋亡比例,相關實驗表明,氟西汀可抑制抑郁大鼠海馬凋亡信號,上調細胞存活信號通路mTOR及下游靶分子磷酸化水平及突觸重塑相關蛋白的表達,下調自噬蛋白對突觸重塑的降解作用,從而起到抗抑郁作用[27,28]。表明氟西汀對不同的神經系統疾病具有不同的調控作用,本研究結果顯示:氟西汀干預治療后,大鼠的活動度、對周圍事物的興趣、對獎賞的快感升高等,均表明其抑郁癥狀改善,這可能與ERK磷酸化水平P-ERK蛋白表達升高,激活下游轉錄因子,上調Nrf2蛋白表達,改善海馬神經元細胞結構,從而起到抗抑郁作用的協同效應有關。
研究表明,灸法治療抑郁癥可提高患者的生活質量[29-31]。相關動物實驗研究發現,灸法可通過增加腦源性神經營養因子,從而改善抑郁癥大鼠的記憶力[32]。亦有報道指出,ERK1/2 磷酸化可以激活Nrf2,誘導多種下游基因表達,從而避免神經元凋亡[33]。本實驗研究結果顯示:治療后,與空白組比較,模型組行為學評分、糖水偏愛度、體質量顯著下降(P<0.05),海馬神經元細胞結構不完整、胞漿內細胞器數量減少(P<0.05),p-ERK、Nrf2 蛋白表達降低(P<0.05);與模型組比較,麥粒灸組及氟西汀組行為學評分、糖水偏愛度、體質量顯著上升(P<0.05),海馬神經元細胞結構改善、胞漿內細胞器數量增多(P<0.05),p-ERK、Nrf2蛋白表達顯著升高(P<0.05);與氟西汀組比較,麥粒灸組行為學評分、糖水偏愛度、體質量、海馬神經元細胞結構及胞漿內細胞器數量無顯著差異(P >0.05)。表明麥粒灸可有效改善抑郁癥大鼠的抑郁癥狀,其作用機制可能與通過上調海馬組織ERK 的磷酸化水平P-ERK,促進誘導Nrf2 蛋白表達上升,抑制炎癥反應及氧化應激,減少細胞凋亡,修復神經損傷來發揮抗抑郁作用有關。
綜上分析,“通督調氣法”麥粒灸治療具有明顯的抗抑郁作用,其作用機制可能與通過上調大鼠海馬組織ERK 的磷酸化水平P-ERK,促進誘導Nrf2 蛋白表達上升,激活神經元的生物學效應,抑制炎癥反應及氧化應激而發揮抗抑郁作用有關。而對比氟西汀治療,麥粒灸治療具有安全、經濟、無毒副作用等優點,值得臨床推廣運用。

