多巴胺D3受體多態性與抑郁癥患者快感缺失的關系
段黎明
【摘要】 目的:分析多巴胺D3受體的多態性與抑郁癥患者快感缺失的關系。方法:選取抑郁癥患者96例為觀察組,健康查體的健康人98例為對照組。觀察組使用抗抑郁藥物常規治療,提取兩組基因組DNA,采用RT-PCR方法檢測多巴胺D3受體rs6280基因的多態性,比較兩組及不同程度快感缺失者的多巴胺D3受體rs6280等位基因頻率及基因型分布,比較觀察組不同基因型者SHAPS評分。結果:觀察組HAMD、SHAPS評分均明顯高于對照組(P<0.05);兩組及不同程度快感缺失者的多巴胺D3受體rs6280等位基因頻率及基因型分布比較,差異均有統計學意義(P<0.05);觀察組不同基因型者的SHAPS評分比較,差異無統計學意義(P>0.05)。結論:多巴胺D3受體rs6280基因多態性與抑郁癥快感缺失具有一定關系,但抑郁癥快感缺失患者不同基因型分布與其快感缺失程度未發現顯著差異。
【關鍵詞】 多巴胺D3受體 基因多態性 抑郁癥 快感缺失
[Abstract] Objective: To analyze the relationship between dopamine D3 receptor polymorphism and anhedonia in patients with depression. Method: A total of 96 patients with depression were selected as the observation group and 98 healthy persons with physical examination as the control group. The observation group was treated with antidepressants. Genomic DNA was extracted from the two groups, the dopamine D3 receptor polymorphism rs6280 gene was detected by RT-PCR. The allele frequency and genotype distribution of dopamine D3 receptor rs6280 between the two groups and those with different degrees of anhedonia were compared, the SHAPS scores of different genotypes in the observation group were compared. Result: The HAMD and SHAPS scores in the observation group were significantly higher than those in the control group (P<0.05). The allele frequency and genotype distribution of dopamine D3 receptor rs6280 between the two groups and those with different degrees of anhedonia were compared, the differences were statistically significant (P<0.05). There was no significant difference in SHAPS scores among different genotypes in the observation group (P>0.05). Conclusion: The polymorphism of the dopamine D3 receptor rs6280 gene is related to the anhedonia in depression, but there is no significant difference between the distribution of different genotypes and the degree of anhedonia in patients with depression.
[Key words] Dopamine D3 receptor Gene polymorphism Depression Anhedonia
First-authors address: Mental Health Center of Inner Mongolia Autonomous Region, Hohhot 010010, China
doi:10.3969/j.issn.1674-4985.2019.30.044
抑郁癥是一種常見的精神障礙性疾病,主要表現出思維遲緩、情緒低落和意志行為減退等,其核心的癥狀表現為患者的快感缺失[1]。抑郁癥的發病率、復發率和致殘率均較高,給該類疾病的患者及家庭、甚至社會帶來沉重的精神和經濟負擔。重癥抑郁癥患者最常見的兩種內表現型是對壓力的敏感性和快感缺失[2]。快感缺失指對愉快的刺激缺乏反應,缺乏期待、主觀體驗或者學習快樂的能力,當患者有快感缺失的表現時,大多意味著疾病的預后較差[3]。部分抑郁癥患者在解除抑郁情緒之后,仍然缺乏對事物的興趣,體會不到生活的快樂和激情,并且這一表現在該類患者中持續存在[4],可見快感缺失也是部分抑郁患者的一種殘留癥狀。關于抑郁癥的發病機制,目前研究表明是由單胺類神經遞質功能失調、免疫及炎癥機制、遺傳學機制、應激因素和環境因素等多種因素共同作用[5]。關于快感缺失這一抑郁癥核心癥狀的發病機制,目前尚未明確,有免疫及炎癥機制、神經解剖學機制及分子遺傳學機制等多種研究[6]。有研究證實中樞神經系統的多巴胺能神經通路的異常與抑郁癥快感缺失有關[7],有學者指出抑郁癥動機缺乏和快感缺失的病理基礎之一是中腦邊緣系統的多巴胺能神經通路異常,其中中腦邊緣系統的伏隔核中多巴胺濃度降低能減輕機體對成癮性物體的趨向性及對獎賞等刺激的反應性[8]。多巴胺受體包括D1和D2兩大家族,其中D1家族有D1和D5兩種亞型、D2家族有D2、D3、D4三種亞型,當多巴胺與其D3受體結合后可使細胞內環磷酸腺苷(cAMP)水平明顯降低、抑制多巴胺的生成、從而影響多巴胺能神經通路的正常功能[9-10]。多巴胺D3受體在中腦邊緣系統的伏隔核內多巴胺能神經元中可大量表達,該受體基因為DRD3基因,該基因的表達具有多態性,研究發現該基因mRNA的第九密碼子內鳥嘌呤(G)可替代腺嘌呤(A),導致多巴胺D3受體細胞外的N-末端由甘氨酸替代絲氨酸,使D3受體的活性受到影響[11]。本研究旨在分析多巴胺D3受體的多態性與抑郁癥患者快感缺失的關系,現報道如下。
1 資料與方法
1.1 一般資料 選取2015年8月-2017年8月在內蒙古精神衛生中心就診的抑郁癥患者。納入標準:患者符合DSM-5對于抑郁癥的診斷標準,且使用抗抑郁藥品治療時無禁忌證,為保證診斷無誤可由兩名以上的精神科醫師進行確診;24項漢密頓抑郁量表評分(HAMD)≥21分;快感缺失量表評分(SHAPS)≥3分。排除標準:伴有其他精神性疾病;抑郁癥反復發作4次及以上;孕婦、產后抑郁癥或哺乳期女性;有躁狂癥、人格障礙等精神疾病家族史;濫用精神活性藥物。根據上述標準共納入96例抑郁癥患者為觀察組,另選取來本院進行健康查體的健康人98例(HAMD<8分,且無精神病史和家族史)為對照組。研究對象均簽署本研究知情同意書,本研究已經院倫理委員會審核批準。
1.2 方法 對兩組研究對象的基本臨床資料進行統計收集,記錄性別、年齡、HAMD及SHAPS評分(評分范圍0~14分,SHAPS評分越高快感缺失程度越高,評分≥3分提示有快感缺失,評分>7分則提示為重度快感缺失)等。觀察組使用抗抑郁藥物常規治療,以單一用藥為主,必要情況下可聯合使用多種抗抑郁藥物,對于藥物治療期間發生的副作用及時對癥處理。兩組均抽取5 mL靜脈血,注入有EDTA抗凝劑的離心管內,使血液與EDTA混勻,使用天根生物科技有限公司的中量血基因組DNA提取試劑盒,提取兩組基因組DNA。本研究使用合成的多巴胺D3受體rs6280基因引物,將引物稀釋至20 pmol/L使用。采用RT-PCR法進行擴增,95 ℃條件下進行預變性1 min,95 ℃條件下變性反應5 s,53 ℃條件下退火15 s,72 ℃條件下延伸反應20 s,共循環反應35次,72 ℃條件下最終延伸反應10 min。RT-PCR擴增后取10 μL產物,加入3 μL Buffer以及2 μL限制性內切酶,加入去離子水,使總體積達到30 μL。混合均勻后在37 ℃水浴條件下過夜,反應結束后,將酶切產物進行1%瓊脂糖凝膠電泳。應用chromas軟件進行基因型讀取及分析。
1.3 觀察指標及判定標準 比較兩組及不同程度快感缺失者的多巴胺D3受體rs6280等位基因頻率及基因型分布,等位基因頻率=[(2×純合子+雜合子)/(2×受檢人數)]×100%;將抑郁癥患者中SHAPS評分>7分者納入重度快感缺失組,3~7分納入輕度快感缺失組,比較觀察組不同基因型者的SHAPS評分。
1.4 統計學處理 使用SPSS 22.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,組間比較采用t檢驗;計數資料以率(%)表示,比較采用字2檢驗。以P<0.05為差異有統計學意義。
2 結果
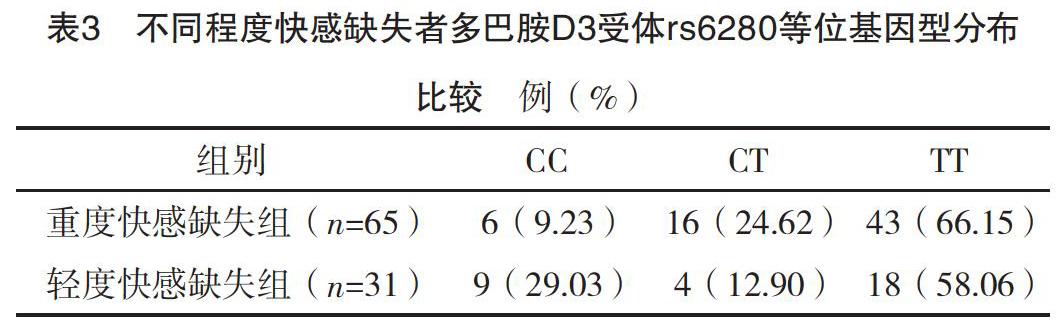
2.1 兩組基本資料比較 兩組年齡、性別資料比較,差異均無統計學意義(P>0.05),具有可比性;觀察組HAMD、SHAPS評分均明顯高于對照組,差異均有統計學意義(P<0.05)。見表1。
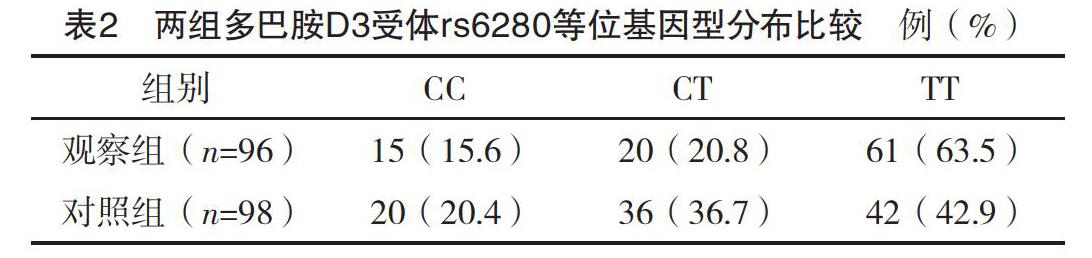
2.2 兩組多巴胺D3受體rs6280等位基因頻率及基因型分布比較 觀察組多巴胺D3受體rs6280等位基因C、T頻率分別為26.04%(50/192)、73.96%(142/192),對照組多巴胺D3受體rs6280等位基因C、T頻率分別為38.78%(76/196)、61.22%(120/196),兩組多巴胺D3受體rs6280等位基因頻率比較,差異有統計學意義(字2=7.172,P=0.007);兩組多巴胺D3受體rs6280等位基因型分布比較,差異有統計學意義(字2=8.771,P=0.012)。見表2。
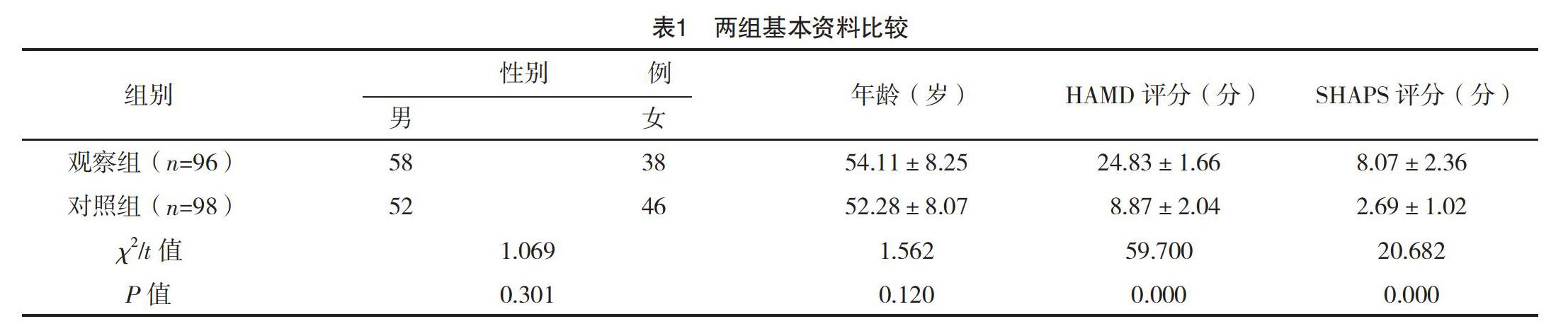
2.3 不同程度快感缺失者多巴胺D3受體rs6280等位基因頻率及基因型分布比較 本研究重度快感缺失組65例,輕度快感缺失組31例;重度快感缺失組多巴胺D3受體rs6280等位基因C、T頻率分別為21.54%(28/130)、78.46%(102/130),輕度快感缺失組多巴胺D3受體rs6280等位基因C、T頻率分別為35.48%(22/62)、64.52%(40/62),不同程度快感缺失者多巴胺D3受體rs6280等位基因頻率比較,差異有統計學意義(字2=4.239,P=0.040);不同程度快感缺失者多巴胺D3受體rs6280等位基因型分布比較,差異有統計學意義(字2=6.865,P=0.032)。見表3。
2.4 觀察組不同基因型者的SHAPS評分比較 基因型CC、CT、TT的SHAPS評分分別為(7.11±1.79)、(8.13±2.64)、(8.57±2.44)分,觀察組不同基因型者的SHAPS評分比較,差異無統計學意義(F=2.264,P=0.110)。
3 討論
抑郁癥是一種常見的精神障礙性疾病,其核心的癥狀表現為患者的快感缺失。快感缺失的定義最初局限于主觀體驗快樂的能力缺失,神經學家將其定義為人體愉悅系統功能失調。快感缺失的形成機制和獎賞機制有關[12],如人體愉悅系統的消費、滿意或欲望等過程受到損害,則會導致期待性快感缺失、決策性快感缺失或消費性快感缺失等。快感缺失是抑郁癥的一種常見內表現型,也是部分抑郁患者的一種殘留癥狀。研究證實,中樞神經系統的多巴胺能神經通路的異常與抑郁癥快感缺失有關,中腦邊緣通路、黑質紋狀體通路、中腦皮層通路和結節漏斗通路是四條多巴胺能系統通路[13-15],其中,包括紋狀體、杏仁核、伏隔核、海馬及中隔的中腦邊緣通路異常與抑郁癥動機缺乏和快感缺失關系密切。研究發現,在快感缺失的實驗動物模型中,伏隔核內多巴胺D3受體的反應性明顯降低[16],經抗抑郁藥物治療后實驗動物的快感缺失癥狀得以緩解、多巴胺D3受體的反應性升高[17]。
多巴胺D3受體的基因即DRD3基因[2,7],在第3號染色體的長臂1區3帶3亞帶位置(3q13.3),5個內含子和6個外顯子構成該基因,其第1個外顯子mRNA的第九密碼子內G可替代A,又稱rs6280多態性,導致多巴胺D3受體細胞外的N-末端由甘氨酸替代絲氨酸,改變了D3受體的活性、影響了能調節人體動機和情緒的多巴胺能信號。研究發現,多巴胺D3受體的多態性使抑郁癥的患病風險提高[18],在抑郁癥患者中甘氨酸等位基因及其基因型的頻率高于健康人群[19]。本研究結果顯示,兩組多巴胺D3受體rs6280等位基因頻率及基因型分布比較,差異均有統計學意義(P<0.05);不同程度快感缺失者多巴胺D3受體rs6280等位基因頻率及基因型分布比較,差異均有統計學意義(P<0.05);觀察組不同基因型者的SHAPS評分比較,差異無統計學意義(P>0.05)。
抑郁癥快感缺失是一種多基因遺傳的疾病,且受免疫及炎癥因素、環境和應激等因素的影響,雖然本研究證實了多巴胺D3受體rs6280基因多態性與抑郁癥快感缺失具有一定關系,但D3受體基因具有多個變異位點、且樣本量和地區、種族差異等對研究結果均有影響[20],因此,多巴胺D3受體基因其他變異位點與抑郁癥快感缺失的相關性仍有待進一步研究。
綜上所述,多巴胺D3受體rs6280基因多態性與抑郁癥快感缺失具有一定關系,但抑郁癥快感缺失患者不同基因型分布與其快感缺失程度未發現顯著差異。
參考文獻
[1]劉文華,陳楚僑,黃敏兒.抑郁癥的內表現型:快感缺失及其測量方法[J].心理科學進展,2010,18(2):271-281.
[2] Treadway M T,Zald D H.Reconsidering anhedonia in depression:Lessons from translational neuroscience[J].Neurosci Biobehav Rev,2011,35(3):537-555.
[3]盛蓉榮.抑郁癥患者快感缺失的行為學及事件相關電位研究[D].合肥:安徽醫科大學,2019.
[4] Miller A H,Maletic V,Raison C L.Inflammation and its discontents:the role of cytokines in the pathophysiology of major depression[J].Biol Psychiatry,2009,65(9):732-741.
[5] Admon R,Pizzagalli D A.Dysfunctional Reward Processing in Depression[J].Curr Opin Psychol,2015,4:114-118.
[6] Sharma S,Powers A,Bradley B,et al.Gene x Environment Determinants of Stress-and Anxiety-Related Disorders[J].Annu Rev Psychol,2016,67:239-261.
[7] Der-Avakian A,Markou A.The neurobiology of anhedonia and other reward-related deficits[J].Trends Neurosci,2012,35(1):68-77.
[8] Kringelbach M L,Stein A,Van Hartevelt T J.The functional human neuroanatomy of food pleasure cycles[J].Physiol Behav,2012,106(3):307-316.
[9] Russo S J,Nestler E J.The brain reward circuitry in mood disorders[J].Nat Rev Neurosci,2013,14(9):609-625.
[10] Saunders B T,Robinson T E.The role of dopamine in the accumbens core in the expression of Pavlovian-conditioned responses[J].Eur J Neurosci,2012,36(4):2521-2532.
[11] Nakonezny P A,Morris D W,Greer T L,et al.Evaluation of anhedonia with the Snaith-Hamilton Pleasure Scale(SHAPS) in adult outpatients with major depressive disorder[J].J Psychiatr Res,2015,65:124-130.
[12] Liu W H,Wang L Z,Zhu Y H,et al.Clinical utility of the Snaith-Hamilton-Pleasure scale in the Chinese settings[J].BMC Psychiatry,2012,12:184.
[13]胡存昆,耿德勤,黃穎.多巴胺D3受體基因Ser9Gly多態性與抑郁癥的相關研究[J].徐州醫學院學報,2011,31(8):536-538.
[14] Savitz J,Hodgkinson C A,Martin-Soelch C,et al.The functional DRD3 Ser9Gly polymorphism(rs6280) is pleiotropic,affecting reward as well as movement[J].PLoS One,2013,8(1):e54108.
[15] Dannlowski U,Domschke K,Birosova E,et al.Dopamine D(3) receptor gene variation:impact on electroconvulsive therapy response and ventral striatum responsiveness in depression[J].Int J Neuropsychopharmacol,2013,16(7):1443-1459.
[16] Lempert K M,Pizzagalli D A.Delay discounting and future directed thinking in anhedonic individuals[J].J Behav Ther Exp Psychiatry,2010,41(3):258-264.
[17] Treadway M T,Bossaller N A,Shelton R C,et al.Effort-based decision -making in major depressive disorder:A translational model of motivational anhedonia[J].J Abnorm Psychol,2012,121(3):553-558.
[18] Vijayaraghavan L,Vaidya J G,Humphreys C T,et al.Emotional and motivational changes after bilateral lesions of the globus pallidus[J].Neuropsychology,2008,22(3):412-418.
[19] Pizzagalli D A,Iosifescu D,Hallett L A,et al.Reduced hedonic capacity in major depressive disorder:Evidence from a probabilistic reward task[J].J Psychiatr Res,2008,43(1):76-87.
[20] Forbes E E,Hariri A R,Martin S L,et al.Altered striatal activation predicting real-world positive affect in adolescent major depressive disorder[J].Am J Psychiatry,2009,166(1):64-73.
(收稿日期:2019-06-14) (本文編輯:董悅)

