骨髓間充質干細胞移植在兒童腎病綜合征鼠模型中的實驗研究
黃青 凌志杰 鄒毓華 鐘小明 楊赟 張明海 羅開源

【摘要】 目的:觀察骨髓間充質干細胞(BMSCs)在兒童腎病綜合征(NS)鼠模型中作用,探討BMSCs移植治療兒童NS的可能性。方法:分離、純化、擴增和鑒定BMSCs。21日齡剛斷奶的SD大鼠適應性喂養后,篩選尿蛋白濃度<0.8 g/L作為實驗用鼠。隨機選取5只實驗用鼠作為正常對照稱A組,其余實驗鼠按照Bertani法尾靜脈注射鹽酸阿霉素制作MCNS鼠模型。成模后隨機分成B、C、D組,每組5只,分別按計劃注射生理鹽水、潑尼松灌胃和注射BMSCs細胞懸液。各組大鼠按計劃進行24 h尿蛋白定量和血肌酐檢測。結果:造模前,各組24 h尿蛋白和血肌酐水平比較,差異均無統計學意義(P>0.05);造模后,B、C、D組24 h尿蛋白和血肌酐水平均升高,且A組24 h尿蛋白和血肌酐水平均低于其他三組(P<0.05);干預后1、4、8周,B、C、D組24 h尿蛋白和血肌酐水平均持續升高,C、D組24 h尿蛋白和血肌酐水平均低于B組(P<0.05),且D組干預后8周血肌酐水平低于C組(P<0.05)。結論:BMSCs移植可改善阿霉素誘導的腎損傷,降低蛋白尿和血肌酐水平。
【關鍵詞】 骨髓間充質干細胞 腎病綜合征 阿霉素
[Abstract] Objective: To observe the role of bone mesenchymal stem cells (BMSCs) in the rat model of nephrotic syndrome (NS) in children, and to explore the possibility of BMSCs transplantation in the treatment of NS in children. Method: Separation, purification, amplification and identification of BMSCs. After adaptive feeding of 21-day-old newly weaned SD rats, urinary protein concentration <0.8 g/L was selected as experimental rats. Five experimental mice were randomly selected as control group A. The other experimental mice were injected adriamycin hydrochloride into tail vein according to Bertani method to make MCNS mice model. The rats were randomly divided into groups B, C and D, with 5 rats in each group, and they were given normal saline injection, Prednisone intragastric administration and BMSCs cell suspension injection respectively according to the plan. The 24-hour urinary protein and serum creatinine were measured in each group. Result: Before modeling, there were no significant differences in 24-hour urinary protein and serum creatinine levels among the groups (P>0.05). After modeling, 24-hour urinary protein and creatinine levels in groups B, C and D increased, and 24-hour urinary protein and creatinine levels in group A were lower than those in other three groups (P<0.05). At 1, 4 and 8 weeks after intervention, the 24-hour urinary protein and creatinine levels in groups B, C and D increased continuously, while the 24-hour urinary protein and creatinine levels in groups C and D were lower than those in group B (P<0.05), the serum creatinine level in group D was lower than that in group C after intervention 8 weeks (P<0.05). Conclusion: BMSCs transplantation can ameliorate adriamycin-induced renal injury and reduce the levels of proteinuria and creatinine.
[Key words] Bone mesenchymal stem cells Nephrotic syndrome Adriamycin
First-authors address: First Affiliated Hospital of Gannan Medical University, Ganzhou 341000, China
doi:10.3969/j.issn.1674-4985.2019.30.010
腎病綜合征(nephrotic syndrome,NS)是兒童泌尿系統的常見病,多為原發性,微小病變型居多[1]。微小病變型腎病綜合征(minimal change nephrotic syndrome,MCNS)病因不明,目前兒科臨床多采用以糖皮質激素為主的綜合治療。兒童正處于生長發育關鍵期,大量蛋白尿和長期服用激素等藥物會影響患兒的生長發育和心身健康。骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)具有增殖、分化、分泌和免疫調節等功能。近年來有研究發現,BMSCs在損傷修復、再生、免疫調節等方面具有重要作用[2]。本研究采用體外擴增的大鼠BMSCs經尾靜脈途徑注入阿霉素誘導MCNS鼠模型體內,觀察其療效并探索其可能作用機制。現報道如下。
1 材料與方法
1.1 BMSCs提取及鑒定 60~80 g雄性SD大鼠(購于贛南醫學院動物實驗中心)頸椎脫臼處死,取出雙股骨和脛骨。PBS沖洗骨髓腔,經大鼠淋巴細胞分離液分離單個核細胞,用貼壁法純化培養BMSCs。培養基為含10%胎牛血清(Hycolne),100 U/L青、鏈霉素,2 mmol/L谷胺酰胺的DMEM-LG(Hycolne)完全培養基。BMSCs鑒定:(1)表型。P5代對數生長期的BMSCs,按試劑盒說明書要求加入抗體(Biolegend),避光孵育,充分洗滌后制成單細胞懸液后用流式細胞儀檢測。(2)分化。P5代對數生長期的BMSCs種板后,用成脂和成骨誘導液培養(成脂誘導劑包括DMEM-HG、10%胎牛血清、10-6 mol地塞米松、0.5 mmol 3-異丁基-1-甲基黃嘌呤、10 μg/mL胰島素、0.2 mmol吲哚美辛;成骨誘導劑包括DMEM-HG、10%胎牛血清、10-7 mol地塞米松、10 mmol β-甘油磷酸鈉、50 mg/L維生素C;主要試劑均購于Sigma)。成脂誘導2周、成骨誘導3周后分別進行油紅O和Von Kossa 染色[3]。
1.2 造模與分組 斷奶日齡21 d的雄性SD大鼠,平均體重(40.0±8.5)g,適應性喂養7 d,測尿蛋白值<0.8 g/L者作為實驗用鼠。隨機抽取5只實驗用鼠作為正常對照命名為A組,其余實驗用鼠按Bertani法進行造模[4]。鹽酸阿霉素粉針劑10 mg(輝瑞制藥)用生理鹽水配成2 mg/mL的溶液,非麻醉下尾靜脈一次性按7.5 mg/kg劑量注射阿霉素,14 d后尿蛋白定量>30 mg/24 h表示造模成功,認定為NS模型鼠并隨機分成B、C、D組,各5只。
1.3 實驗各組干預 將P4~P5代BMSCs,配成濃度約1×106個/mL的細胞懸液,在D組(干細胞治療)大鼠成模后的第2天和第8天分別經尾靜脈注射2 mL BMSCs懸液[內含(1~2)×106個BMSCs];與D組干預相同時間,A組(正常對照)、B組(空白對照)大鼠經尾靜脈注射等量生理鹽水;C組(激素治療)大鼠在成模后第2天開始給予潑尼松5 mg/(kg·d)灌胃給藥,連續給藥8周。
1.4 標本收集與檢測
1.4.1 尿標本收集及檢測 將實驗鼠置入代謝籠中,代謝籠下置干凈空瓶。為防止尿液變質,空瓶中預先加入1 mL的甲醛。24 h后,收集尿液送檢驗科測量尿液總體積和尿蛋白濃度,計算得出24 h尿蛋白量。收集次數與時間如下,第一次:購買回SD大鼠適應性培養第7天;第二次:模型鼠注射阿霉素第14天;第三次:以D組干細胞治療首次干預后第1周;第四次:以D組干細胞治療首次干預后第4周;第五次:以D組干細胞治療首次干預后第8周。
1.4.2 血標本收集及血肌酐的檢測 用乙醚麻醉后,經眶靜脈采血用抗凝管收集,立即送至檢驗科檢測血肌酐水平。采血次數與時間如下,第一次:造模鼠注射阿霉素第14天;第二次:以D組干細胞治療首次干預后第1周;第三次:以D組干細胞治療首次干預后第4周;第四次:以D組干細胞治療首次干預后第8周。
1.5 統計學處理 使用SPSS 25.0軟件對所得數據進行統計分析,計量資料用(x±s)表示,多組間比較采用單因素方差分析,兩組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 BMSCs培養與純化 原代培養的BMSCs貼壁生長,呈星形或多角形,含有一定量的懸浮圓形雜質細胞,見圖1;經傳代培養,雜質細胞逐漸減少變純、BMSCs大量擴增;傳至P3代時,鏡下觀察幾乎未見懸浮培養的雜質細胞,見圖2。
2.2 BMSCs表型鑒定結果 P5代對數生長期的BMSCs經用流式細胞儀檢測后,BMSCs表型為CD90+、CD29+、CD45-、CD34-,其中CD90、CD45、CD34、CD29陽性細胞群的熒光吸收峰分別為98.2%、1.32%、1.01%、99.1%,見圖3。
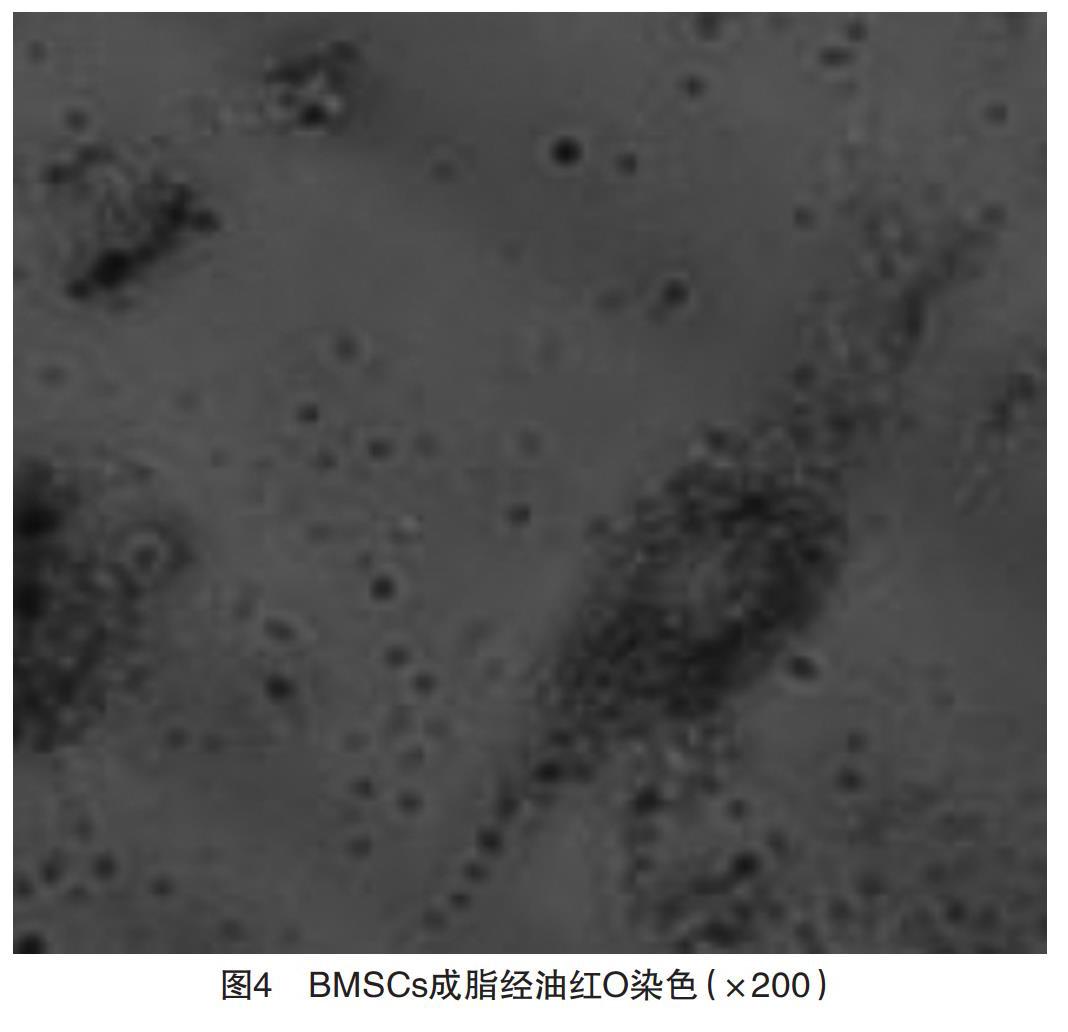
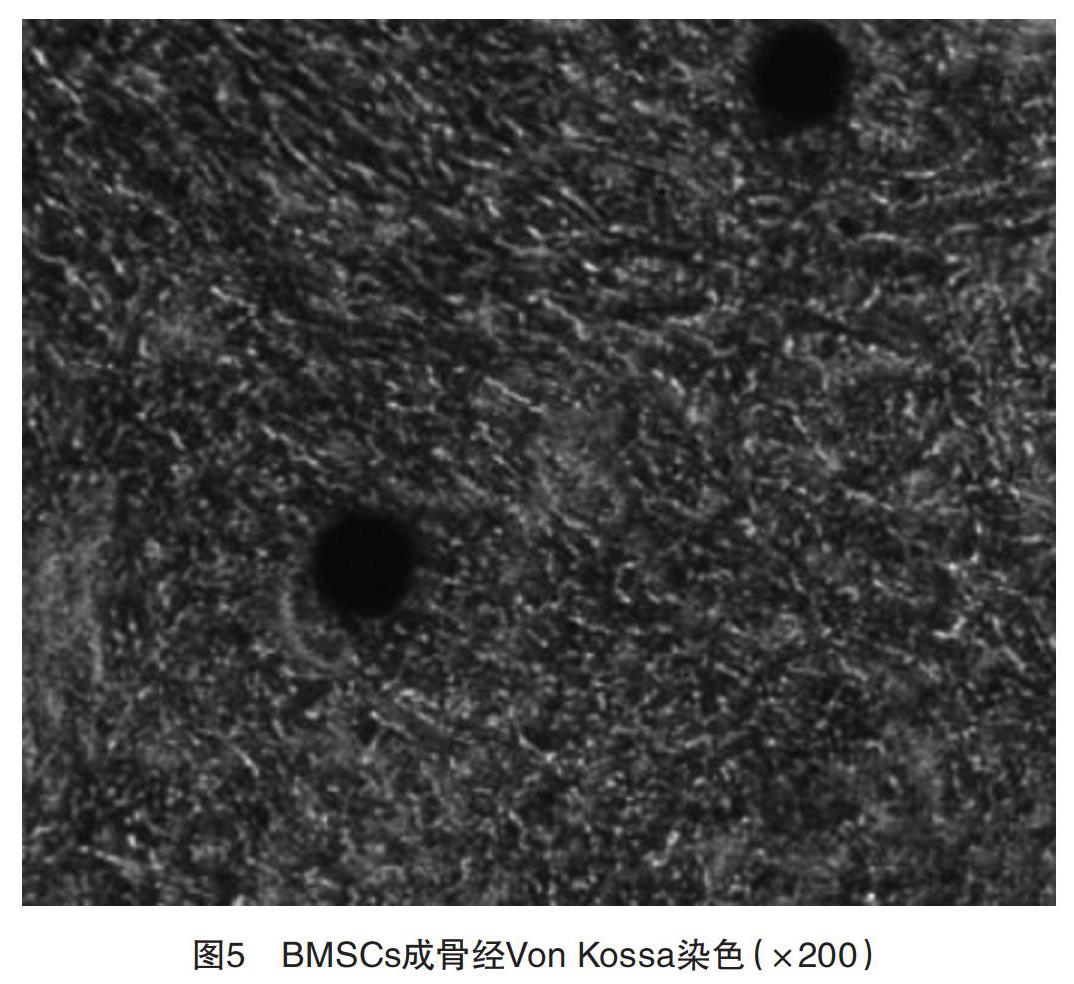
2.3 BMSCs分化結果 成脂誘導2周進行油紅O染色,結果陽性可見染成紅色的脂肪細胞,見圖4;成骨誘導3周后進行Von Kossa染色,結果陽性可見成骨細胞包漿內有黑色物質沉淀物,見圖5。
2.4 各組24 h尿蛋白比較 造模前,各組24 h尿蛋白比較,差異均無統計學意義(P>0.05);造模后,B、C、D組24 h尿蛋白均數高于30 mg/24 h,B、C、D組的組間兩兩比較,差異均無統計學意義(P>0.05),但A組24 h尿蛋白均低于其他三組(P<0.05);干預后1、4、8周,B、C、D組24 h尿蛋白均持續升高,C、D組24 h尿蛋白均低于B組(P<0.05),但C、D組24 h尿蛋白比較,差異均無統計學意義(P>0.05)。見圖6、表1。
2.5 各組血肌酐水平比較 造模前,各組血肌酐水平比較,差異無統計學意義(P>0.05 );造模后,B、C、D組血肌酐水平均升高,B、C、D組的組間兩兩比較,差異均無統計學意義(P>0.05),但A組血肌酐水平均低于其他三組(P<0.05);干預后1、4、8周,B、C、D組血肌酐水平均持續升高,C、D組血肌酐水平均低于B組(P<0.05);干預后1、4周,C、D組血肌酐水平比較,差異均無統計學意義(P>0.05),干預后8周,D組血肌酐水平低于C組(P<0.05)。見圖7、表2。
3 討論
NS是由多原因引起的腎小球基底膜通透性增高,導致大量血漿蛋白從尿中丟失的一種臨床綜合征,以大量蛋白尿、低蛋白血癥、高膽固醇血癥和水腫為主要臨床表現[5-6]。兒童NS以微小病變型居多,多為3~5歲的學齡前兒童。MCNS的病理表現為:光鏡下腎小球基本正常,電鏡下彌漫性腎小球臟層上皮細胞足突消失[7]。目前認為MCNS發病主要與腎小球濾過膜靜電屏障減弱或消失有關,使帶負電荷的白蛋白大量漏出形成蛋白尿。
阿霉素是一種含醌式結構具有抗腫瘤作用的抗生素,在體內酶的作用下可形成半醌型自由基。半醌型自由基氧化反應后可生成活性氧物質,誘發腎小球上皮系部脂質過氧化,破壞腎小球濾過膜,導致屏障功能障礙從而引起蛋白尿。阿霉素NS鼠模型于1982年Bertani等率先報道,具有造模簡便、成功率高、穩定性好等優點,是公認較好MCNS鼠模型[8]。本實驗采用Bertain法,尾靜脈一次性大劑量(7.5 mg/kg)注射鹽酸阿霉素進行造模,注射后14 d后尿蛋白定量均>30 mg/24 h,成模率達100%。
BMSCs是一類來自骨髓的多能干細胞,具有大量增殖、多向分化、旁分泌、免疫調節、低免疫源性和損傷修復等功能,是組織工程的理想種子細胞。目前研究發現,BMSCs在體外誘導培養下可分化為骨細胞、軟骨細胞、神經細胞等[9-11]。本實驗通過體外誘導培養,成功誘導BMSCs分化成骨細胞和脂肪細胞。BMSCs在培養中可分泌多種細胞因子,如胰島素樣生長因子-1、肝細胞生長因子、血管內皮生長因子、神經生長因子等[12-15]。Zhuo等[16]在BMSCs移植治療孤立腎缺血再灌注鼠模型的實驗中發現:BMSCs可通過調節抗氧化/氧化平衡來改善缺血再灌注導致的腎損傷。Yang等[17]在BMSCs移植治療局灶節段性腎小球硬化鼠模型的實驗中發現:BMSCs移植可能通過上調MMP/TIMP和下調IL-6、TNF-α來降低尿蛋白、血肌酐和尿素氮水平。Jiao等[18]在體內外實驗中發現:BMSCs移植能通過激活Wnt/β-Catenin通路減少順鉑誘導的腎損傷。
在本實驗采用尾靜脈注射的方式將BMSCs移植入阿霉素誘導的MCNS鼠模型體內,通過比較同期各組大鼠24 h蛋白尿定量和血肌酐水平觀察療效,結果顯示,BMSCs移植和激素均能降低MCNS鼠模型的蛋白尿和血肌酐水平,且差異均有統計學意義(P<0.05)。BMSCs移植能改善阿霉素誘導的MCNS鼠模型腎損傷且無長期使用激素引起的感染、代謝異常等并發癥。吳悠等[19]研究發現阿霉素誘導的MCNS模型鼠Th17/Treg免疫失衡程度與腎臟損傷成正比,早期應用潑尼松可通過下調腎臟局部Th17水平保護腎臟。劉倩等[20]發現脂肪干細胞移植能減輕阿霉素誘導的NS鼠模型蛋白尿水平。根據實驗結果和文獻報告,本課題認為,干細胞可能通過其免疫調理作用保護阿霉素誘導的MCNS模型鼠的腎損傷。
綜上所述,BMSCs移植可改善阿霉素誘導的MCNS模型鼠的腎損傷,降低蛋白尿和血肌酐水平,其具體機制有待進一步研究。
參考文獻
[1]單文婕,龔瑩靚,朱亞菊,等.兒童腎病綜合征腎組織病理免疫熒光分型和病理類型與激素療效關系[J].臨床兒科雜志,2017,35(2):111-114.
[2] Sargent A,Miller R H.MSC Therapeutics in Chronic Inflammation[J].Curr Stem Cell Rep,2016,2(2):168-173.
[3] Guo J,Gao X,Lin Z,et al.BMSCs reduce rat granulosa cell apoptosis induced by cisplatin and perimenopause[J].BMC Cell Biology,2013,14(1):18.
[4] Guo J,Zou Y,Wu Z,et al.Protective effects of mesenchymal stromal cells on adriamycin-induced minimal change nephrotic syndrome in rats and possible mechanisms[J].Cytotherapy,2014,16(4):471-484.
[5] Dwivedi S,Sharma P.Stem Cell Biology:A New Hope in Regenerations and Replenishments Therapy[J].Indian J Clin Biochem,2018,33(4):369-371.
[6]保睿,陳朝英.兒童原發性腎病綜合征中microRNAs的研究進展[J]中國醫刊,2018,53(8):872-874.
[7]馮小倩,王墨.兒童微小病變腎病免疫發病機制研究進展[J].兒科藥學雜志,2017,23(1):53-56.
[8]包玉龍,楊瑞,劉禾,等.阿霉素大鼠腎病綜合征模型最佳劑量的篩選[J].動物醫學進展,2018,39(5):61-63.
[9] Zhang J,Jiang N,Yu H,et al.Requirement of TGFβ Signaling for Effect of Fluoride on Osteoblastic Differentiation[J].Biological Trace Element Research,2019,187(2):492-498.
[10] Bai X,Li G,Zhao C,et al.BMP7 induces the differentiation of bone marrow-derived mesenchymal cells into chondrocytes[J].Med Biol Eng Comput,2011,49(6):687-692.
[11] Hong R,Renshun X,Xinghai J,et al.Biofunctionalized self-assembly of peptide amphiphile induces the differentiation of bone marrow mesenchymal stem cells into neural cells[J].Mol Cell Biochem,2018,450(1-2):199-207.
[12] Gao S,Zhao Z,Wu R,et al.Bone marrow mesenchymal stem cell transplantation improves radiation-induced heart injury through DNA damage repair in rat model[J].Radiat Environ Biophys,2017,56(1):63-77.
[13]王勁,陳燕,王琳.骨髓間充質干細胞的旁分泌作用研究進展[J].中國小兒急救醫學,2016,23(1):57-61.
[14]邱紀玲,王曉彤,周灝雯,等.間充質干細胞條件培養液修復多種疾病損傷的潛能[J].中國組織工程研究,2019,23(29):4743-4748.
[15]李淑華,高麗蓮,陳系古,等.表達肝細胞生長因子的大鼠骨髓間充質干細胞分化為肝樣細胞[J].中國病理生理雜志,2019,35(6):1118-1123.
[16] Zhuo W,Liao L,Xu T,et al.Mesenchymal stem Cells Ameliorate ischemia-reperfusion-induced renal dysfunction by improving the antioxidant/oxidant balance in the ischemic kidney[J].Urol Int,2011,86(2):191-196.
[17] Yang R C,Zhu X L,Wang J,et al.Bone marrow mesenchymal stem cells attenuate the progression of focal segmental glomerulosclerosis in rat models[J].BMC Nephrol,2018,19(1):335.
[18] Jiao X,Cai J,Yu X,et al.Paracrine Activation of the Wnt/β-Catenin Pathway by Bone Marrow Stem Cell Attenuates Cisplatin-Induced Kidney Injury[J].Cell Physiol Biochem,2017,44(5):1980-1994.
[19]吳悠,李昊,陳婉冰,等.潑尼松對阿霉素腎病小鼠腎臟Th17/Treg免疫平衡的影響[J].重慶醫科大學學報,2019,44(5):568-576.
[20]劉倩,張玉靜,劉靜,等.脂聯素與鼠脂肪干細胞移植治療大鼠腎病綜合征[J].中國組織工程研究,2018,22(13):2109-2113.
(收稿日期:2019-07-22) (本文編輯:董悅)

