慢性心力衰竭患者應用血清三項檢測的臨床價值分析
王雪玲
(徐州醫科大學附屬第三醫院心內科,江蘇 徐州 221000)
心力衰竭指的是炎癥、心肌病、血流動力學過重負荷等造成的心肌損傷,引起心肌功能及結構出現變化,屬于多種心臟病終末表現[1]。心力衰竭呈持續存在狀態則為慢性心力衰竭(CHF),臨床對其進行診斷主要是觀察患者體征、檢測其心功能及心臟結構情況等。CHF患者不但伴隨心泵功能衰退,而且還具有神經內分泌激素異常以及其余器官功能,
如腎臟、肝臟等異常情況,對疾病預后產生嚴重影響[2]。CHF發病期間,腎功能損傷可成為獨立危險因素,因而可早期對其激素及其余器官異常狀況進行診斷[3]。本研究為明確血清BUN(尿素氮)、UA(尿酸)、Cr(肌酐)檢測的臨床價值,本院針對性選取110例患者及110例健康者臨床資料進行分析,并作報告如下。
1 資料與方法
1.1 臨床資料 選取2017年1月~2018年1月收治的110例CHF患者作研究組,另選同期健康體檢正常者110例作對照組,將經超聲心動圖、臨床癥狀等檢查確診者納入,將急性心內膜炎、心肌炎者排除。對照組(110例),男女比例60:50,年齡40~75歲,平均年齡(59.41±9.41)歲;體質量45~76 kg,平均體質量(56.74±6.74)kg。研究組(110例),男女比例62:48,年齡41~76歲,平均年齡(59.53±9.53)歲;體質量44~77 kg,平均體質量(56.83±6.83)kg;NYHA分級:Ⅳ級28例,Ⅲ級50例,Ⅱ級32例。兩組臨床資料比較差異無統計學意義,具有可比性。
1.2 方法 所有研究對象均進行血清BUN、UA、Cr檢測,于入院清晨取肘靜脈血4 ml,常規分離后取血清備用;應用紫外-谷氨酸脫氫酶法測定血清BUN水平;應用氧化酶法測定血清UA水平;應用肌氨酸氧化酶法測定Cr水平;所用儀器為德國西門子生產的ADVIA2400全自動生化分析儀,操作均嚴格遵循試劑盒說明書進行。針對CHF組,予以強心劑、利尿劑、β受體阻滯劑、血管緊張素轉換酶抑制劑以及他汀類調脂藥物進行治療,持續用藥4周,再次檢測血清UA、Cr、BUN水平。
1.3 統計學方法 均用SPSS 17.0統計軟件行本研究數據統計學分析,采用“x±s”表正態計量資料,組間比較用t檢驗;計數資料用[n(%)]來表示,組間率比較采用χ2檢驗;P<0.05表差異具有統計學意義。
2 結果
2.1 比較兩組血清Cr、UA、BUN水平 研究組血清Cr、UA、BUN水平與對照組相比均更高(P<0.05),見表1。

表1 比較兩組血清Cr、UA、BUN水平(x±s)
2.2 比較不同NYHA分級者血清Cr、UA、BUN水平 NYHA分級為Ⅱ級、Ⅲ級者血清Cr、UA、BUN水平均較Ⅳ級者低(P<0.05),且隨分級降低而水平減少(P<0.05),見表2。
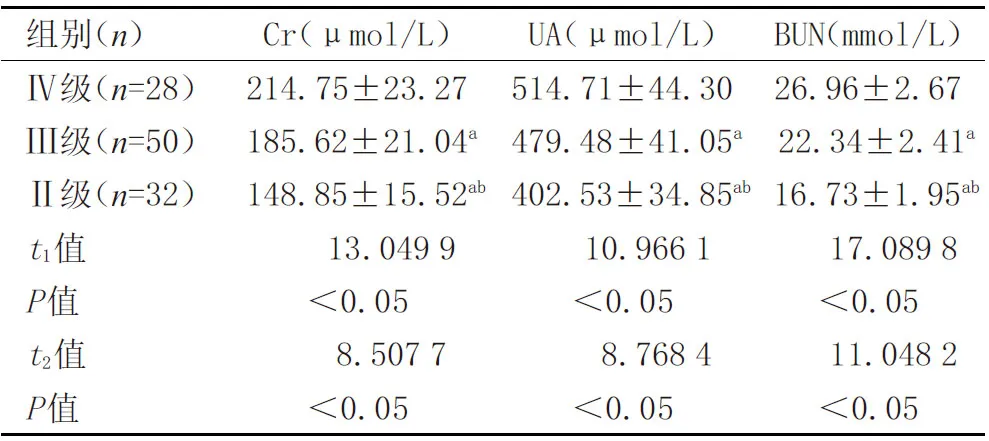
表2 比較不同NYHA分級者血清Cr、UA、BUN水平(x±s)
2.3 比較治療前后CHF患者檢測結果 治療后,CHF患者體內血清Cr、UA、BUN水平較治療前均顯著低(P<0.05),見表3。

表3 比較治療前后CHF患者檢測結果(x±s)
3 討論
CHF患者因受損部位不同,其臨床癥狀表現亦存在差異。如左CHF患者常表現出咯血、失眠、呼吸困難、少尿、咳嗽等癥狀;而右CHF患者則多表現為惡心嘔吐、上腹明顯疼痛、四肢腫大、嗜睡及神經過敏等癥狀;全CHF患者臨床癥狀主要為排血量降低、呼吸困難等[3-4]。臨床早期進行CHF診斷對于預防疾病進展具重要意義,可有效提升臨床治療效果,促患者預后改善。
本次研究中,研究組血清Cr(184.14±21.94)μmol/L、UA(485.03±41.56)μmol/L、BUN(21.84±2.16)mmol/L水平與對照組相比均更高;NYHA分級為Ⅱ級、Ⅲ級者血清Cr、UA、BUN水平均較Ⅳ級者低,且隨分級降低而水平減少;治療后,CHF患者體內血清 Cr(127.63±16.22)μmol/L、UA(303.16±32.95)μmol/L、BUN(11.73±1.83)mmol/L水平較治療前均顯著降低;此次研究結果與李婷婷、孫玉真等人[5]相似,表明CHF患者血清Cr、BUN及UA等指標水平較健康者高,且NYHA分級為Ⅳ級者顯著高于Ⅱ級、Ⅲ級者,而經臨床治療后能夠有效降低以上檢測指標水平。CHF患者因血流動力學紊亂、神經體液異常等因素影響,極易引起自身內分泌激素分泌異常以及腎功能受損[6]。CHF患者腎功能損傷的主要機制為CHF患者交感系統被異常激活,導致腎血管呈現持續性收縮的狀態,從而引起腎臟組織出現纖維化或死亡化,其中血管緊張素、去甲腎上腺素等激活可直接產生毒性作用于腎組織[7-8]。血清Cr及血清BUN屬于臨床常用檢測腎功能的指標,據本次研究結果可知CHF患者Cr、BUN水平顯著高于正常人群,提示CHF患者顯著出現腎功能損傷。Cr分成內源性與外源性兩類,前者源自磷酸肌酸及肌酸代謝,后者源自膳食。因此,Cr水平受膳食結構、肌肉量、性別等因素影響,臨床需結合其他指標進行CHF腎功能損傷鑒別[9]。
UA屬于嘌呤代謝最終產物,是經黃嘌呤氧化還原酶在嘌呤代謝中催化形成的,其可作為高胰島素和血管功能、氧化代謝、免疫活性損傷等的標志[10-11]。機體正常情況下,UA水平約為1 200 mg,生成與代謝量處于相對平衡一種狀態,而若機體存在過多UA未有效排泄,將導致體內UA滯留,引起UA水平升高[12]。有研究[13]表明,高水平UA出現的主要原因為腎臟清除功能下降。CHF患者隨疾病進展,將導致腎小球濾過量逐漸減少,或者小管排泄尿酸鹽功能逐漸衰退,從而引起UA排泄不暢,導致高尿酸血癥發病率升高[14]。此外,CHF患者由于交感神經的興奮性表達,導致患者腎素血管緊張素-醛固酮系統激活,從而影響機體兒茶酚胺、腎血流量等水平,進而對UA表達產生影響,使UA水平增加。同時,CHF程度愈嚴重,則患者機體最大耗氧量將愈低,造成三磷酸腺苷生成量減少,促使嘌呤降解為尿酸、黃嘌呤等過程增加,UA表達增加[15]。因此,NYHA分級增加而患者血清UA水平亦增加。據本次研究結果可知,治療后血清UA水平較治療前顯著低,提示CHF病情緩解后,患者腎血流灌注將增加,從而有助于氧代謝恢復,進而達到UA水平下降目的。本次研究受多種因素影響,尚未對檢驗效果予以詳盡分析,需行進一步研究。
綜上所述,CHF患者機體內血清BUN、Cr、UA等水平呈顯著升高狀態,且隨NYHA分級增高而逐漸增加,腎功能損傷愈加嚴重,臨床通過以上指標水平測定可有效掌握患者疾病嚴重程度,指導臨床治療方案的調整,具推廣價值。

