焦脫鎂葉綠酸甲酯介導光動力抑制人乳腺癌細胞MCF-7遷移
黃禮義,林海丹,虞樂華,白定群
(1. 重慶醫科大學附屬第一醫院康復醫學科,重慶 400016;2. 重慶醫科大學附屬第二醫院康復醫學科,重慶 400010)
乳腺癌是女性最常見的惡性腫瘤,其發病率和死亡率在女性癌癥中居首位[1-2]。造成乳腺癌患者死亡的主要原因是腫瘤轉移[3],因此,控制腫瘤轉移是治療乳腺癌的主要目標之一。光動力療法(photodynamic therapy, PDT)是一種結合光敏劑(photosensitizer, PS)和特定波長光的新型療法,通過活性氧(reactive oxygen species, ROS)的產生發揮光化學作用,其安全性高、副作用小,廣泛應用于臨床各種腫瘤治療[4]。焦脫鎂葉綠酸甲酯(pyropheophorbide-a methyl ester,MPPa)是一種葉綠素衍生物,屬于第二代光敏劑。本課題組前期實驗表明,MPPa介導光動力可以誘導人乳腺癌細胞和人卵巢癌細胞凋亡[5-6],從而發揮治療作用,但是MPPa介導光動力對乳腺癌細胞遷移能力的影響尚未見報道。本研究擬探討MPPa介導光動力對人乳腺癌細胞MCF-7遷移能力的影響,以期為乳腺癌的治療提供新的思考。
1 材料與方法
1.1材料
1.1.1細胞與試劑 人乳腺癌細胞MCF-7由重慶醫科大學生命科學研究院惠贈。光敏劑MPPa(美國 Sigma-Aldrich 公司),以二甲亞砜(DMSO)溶解至10 mmol·L-1,避光儲存于-80 ℃冰箱;LED光源(重慶京渝激光科技有限公司);胎牛血清FBS(德國PAN公司);RPMI 1640培養基(美國Gibco公司); CCK-8(日本同仁公司);DCFH-DA(美國 Sigma-Aldrich 公司);Transwell小室(美國Millipore公司);E-鈣黏蛋白(E-cadherin)抗體、PTEN抗體、Akt抗體、p-Akt 抗體(美國CST公司)。
1.1.2儀器 細胞培養箱、全波長酶標儀(美國 Thermo Scientific 公司);高速離心機(美國 Sigma 公司);生物顯微鏡(日本 Olympus 公司);倒置熒光顯微鏡(德國Zeiss公司);電泳儀(美國 Bio-Rad 公司);化學發光成像系統(法國Vilber Lourmat公司)。
1.2方法
1.2.1細胞培養及分組 人乳腺癌細胞MCF-7于37 ℃、5% CO2條件下,在含10%胎牛血清和1%雙抗的RPMI 1640培養基中培養。將處于對數生長期的MCF-7細胞隨機分為對照組、單藥組(僅MPPa處理)、單光組(僅光照處理)和MPPa-PDT組(MPPa和光照處理)。細胞貼壁后,單藥組和MPPa-PDT組更換為含2 μmol·L-1MPPa 的培養基避光培養,對照組和單光組更換為等體積的完全培養基。24 h后,去除MPPa并接受光照處理,連續輸出方式,功率密度30 mW/cm2。
1.2.2CCK-8檢測MCF-7細胞活性 MCF-7細胞以5×103個/孔接種于96孔板中,待其貼壁后進行分組,并進行光動力處理,光敏劑濃度為0、0.5、1、2、4 μmol·L-1,光照時間為0、30、60、90、120 s,光照能量為0、0.9、1.8、2.7、3.6 J/cm2(光照能量=光照時間×功率)。24 h后,更換培養基為含10% CCK-8試劑的無血清培養基,將細胞放入孵箱中繼續培養,酶標儀檢測450 nm波長下各孔的吸光度。按公式計算細胞存活率:存活率=(實驗組OD值-空白對照組OD值)/(陰性對照組OD值-空白對照組OD值)×100%。空白對照組為含CCK-8培養基而不含細胞的孔,陰性對照組為含CCK-8培養基和細胞的孔,實驗組為含CCK-8培養基和細胞且受處理的孔。
1.2.3DCFH-DA染色檢測MCF-7細胞內ROS的產生 MCF-7細胞以5×103個/孔接種于96孔板中,待其貼壁后,隨機分組進行光動力處理,1 h后去掉原培養基,PBS洗滌細胞2次,加入10 μmol·L-1DCFH-DA無血清培養基,在孵箱中繼續培養30 min。棄培養基,PBS洗滌細胞2次,熒光顯微鏡下觀察并拍照。
1.2.4Transwell實驗觀察MCF-7細胞遷移能力 MCF-7細胞以1×105個/孔接種于6孔板中,隨機分組后接受相應處理。Transwell小室放置于24孔板中,光動力處理后12 h消化細胞,無血清培養基重懸,以1×105個/孔接種于Transwell小室中,下室加入750 μL完全培養基,在孵箱中繼續培養24 h。取出細胞,PBS洗2遍,棉簽刮去上室中未遷移的細胞,多聚甲醛固定上室及下室30 min,三蒸水清洗小室2次,結晶紫染色5 min,三蒸水清洗2次,晾干后于顯微鏡下觀察并拍照。
1.2.5細胞劃痕實驗觀察MCF-7細胞遷移能力 MCF-7細胞以1×105個/孔接種于6孔板中,光照前使用100 μL槍頭在孔板中劃痕,PBS洗2遍,更換培養基為無血清培養基后接受光照處理。于孵箱中繼續培養,并于0、24、48 h在顯微鏡下觀察并拍照。
1.2.6Western blot 檢測E-cadherin、PTEN、Akt、p-Akt蛋白的表達變化 MCF-7細胞接受相應處理后,于冰上加入裂解液(RIPA ∶PMSF=100 ∶1)裂解10 min,細胞刮刮下細胞,超聲粉碎5次,12 000×g離心15 min,BCA法測定蛋白濃度,最終配平為等濃度、等體積的蛋白樣品。SDS-PAGE后,濕轉法將蛋白轉移至PVDF膜,5% 脫脂奶粉封閉2 h,孵育一抗4 ℃過夜,孵育二抗后顯影。
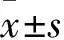
2 結果
2.1MPPa-PDT抑制MCF-7細胞活性如Fig 1所示,低濃度的MPPa(0~2 μmol·L-1)和單純光照對MCF-7細胞活性無明顯影響,高濃度的MPPa(4 μmol·L-1)對MCF-7細胞活性有較明顯的影響(P<0.05),因此,選擇2 μmol·L-1MPPa 用于后續實驗。MPPa聯合光照處理對細胞活性有明顯的抑制作用,其抑制作用呈劑量依賴性。光能量密度為0.9 J/cm2時,細胞存活率為(52.8±2.20)%,后續實驗即采用該能量密度。

Fig 1 Effect of MPPa-PDT on MCF-7 cell
Energy density(J/cm2)=Power density(30 mW/cm2)×Illumination time(s).*P<0.05vscontrol group.
2.2MPPa-PDT誘導MCF-7細胞內ROS產生如Fig 2所示,ROS可將不帶熒光的DCFH-DA氧化為帶綠色熒光的DCF,DCF的量可以反映細胞內ROS的量。MPPa-PDT處理后,細胞內ROS明顯增加,熒光強度高于對照組、單藥組和單光組(P<0.05),三組間差異無統計學意義。上述結果表明,MPPa-PDT可誘導MCF-7細胞產生ROS。
2.3MPPa-PDT抑制MCF-7細胞遷移Fig 3的Transwell結果顯示,與對照組、單藥組、單光組相比,MPPa-PDT組MCF-7細胞遷移數量明顯低于其他3組(P<0.05),三組間差異無統計學意義。Fig 4的劃痕實驗結果顯示,24 h時,MPPa-PDT組與對照組之間細胞遷移差異不明顯,48 h時,對照組細胞遷移面積明顯大于MPPa-PDT組,差異有統計學意義。上述結果表明,MPPa-PDT可以抑制MCF-7細胞的遷移能力。

Fig 2 Production of ROS and quantification in MCF-7 cells(×400)


Fig 3 Migration of MCF-7 cells inhibited by MPPa-PDT(×400)

2.4MPPa-PDT對E-cadherin、PTEN、Akt、p-Akt蛋白表達的影響如Fig 5所示,MPPa-PDT組E-cadherin、PTEN蛋白表達高于空白組、單藥組和單光組(P<0.05),p-Akt蛋白表達低于空白組、單藥組和單光組(P<0.05),且3個對照組間差異無統計學意義,Akt蛋白表達4組間無明顯差異。
3 討論
腫瘤轉移是腫瘤治療效果不佳和腫瘤相關性死亡的主要原因之一[7]。目前,乳腺癌的治療主要以外科手術和藥物為主[8],但外科手術和化療藥物會帶來嚴重的副作用,因此,尋找安全有效、毒副作用低的治療方法顯得尤為重要。研究表明,MPPa-PDT可以誘導腫瘤細胞凋亡、壞死和自噬,但MPPa-PDT對腫瘤遷移的研究尚未見報道。本研究探討MPPa-PDT對人乳腺癌細胞MCF-7遷移能力的影響及其可能的機制,期望為臨床治療乳腺癌提供思路。實驗結果表明,2 μmol·L-1MPPa 聯合0.9 J/cm2光能量密度可以明顯抑制MCF-7的細胞活性。
單獨應用一定濃度的光敏劑或者光照通常對細胞無明顯毒性,但當二者結合時所產生的ROS會對細胞造成明顯的影響。ROS是PDT治療效應的核心部分,它參與廣泛的細胞信號轉導,研究表明,PDT通過ROS產生,抑制腫瘤細胞侵襲遷移[9-10]。本實驗結果表明,MCF-7細胞經光動力處理后,ROS水平明顯升高,可能抑制乳腺癌細胞的遷移能力。Du等[11]發現,結合藻青蛋白和血卟啉介導光動力治療,抑制MCF-7細胞的增殖和遷移。本實驗Transwell遷移實驗和劃痕實驗結果也表明,MPPa-PDT明顯抑制了MCF-7細胞的遷移能力,而單純使用MPPa或單純光照對細胞的遷移能力無明顯影響。

Fig 4 Migration of MCF-7 cells inhibited by MPPa-PDT(×50)

上皮-間充質轉化(epithelial mesenchymal transition ,EMT)在腫瘤轉移中起重要作用,EMT發生時,細胞-細胞連接和細胞極性消失,肌動蛋白細胞骨架重組失敗,紡錘樣間質形成,導致細胞運動及遷移能力增強[8]。E-cadherin是EMT中一個關鍵因子,其功能失調導致腫瘤細胞侵襲、遷移和轉移傳播。研究發現在乳腺癌病人中,E-cadherin水平與腫瘤轉移、不良預后、腫瘤復發有關[8]。本實驗結果表明,MPPa-PDT上調MCF-7細胞的E-cadherin水平,表明MPPa-PDT可能通過上調E-cadherin,抑制腫瘤細胞發生EMT,進而抑制腫瘤細胞遷移。
Akt是細胞內重要的信號轉導通路,涉及細胞的存活、生長、轉移和代謝,發生EMT的細胞中可檢測到Akt的激活,Akt激活與腫瘤侵襲遷移密切相關。PTEN作為一種抑癌基因,可使三磷酸磷脂酰肌醇(phosphatidylinositol trisphosphate,PI3P)脫磷酸化,抑制Akt的激活[12],阻礙EMT的發生。實驗結果表明,MPPa-PDT處理后,MCF-7細胞中PTEN蛋白表達量增加,p-Akt蛋白表達量降低,提示MPPa-PDT可能通過PTEN/Akt信號通路,降低MCF-7細胞遷移能力。
綜上所述,MPPa-PDT可明顯降低MCF-7細胞的遷移能力,其作用機制可能與E-cadherin上調和PTEN/Akt信號通路有關。基質金屬蛋白酶類(matrix metalloproteinases,MMPs)在腫瘤的侵襲遷移中起關鍵作用,其中MMP-2和MMP-9可降解胞外基質和Ⅳ型膠原[13],促進腫瘤轉移,而且MMP-9可誘導EMT的發生,因此,MMP-2和MMP-9常作為腫瘤進展的標志物[14]。MPPa-PDT是否通過抑制MMP-2和MMP-9表達來抑制腫瘤的侵襲遷移有待進一步研究。

Fig 5 Effect of MPPa-PDT on relativeprotein expression in MCF-7
*P<0.05vscontrol group;#P<0.05vsMPPa group;△P<0.05vslight group
(致謝:本實驗在重慶醫科大學附屬第一醫院重大代謝性疾病轉化醫學重慶市高校重點實驗室完成,在此感謝在實驗中給予指導和幫助的各位老師和同學。)

