線性探針技術診斷HIV/結核分枝桿菌感染者結核菌耐藥性效能評價
韋善求,麻秋英,羅順達,倪祖彥,韋善君
結核病是HIV感染者最常見的機會性感染疾病,也是艾滋病患者死亡的重要原因之一。WHO數據顯示,2015年約35%的艾滋病相關死亡病例是由于結核病所致,在資源受限地區有近50%患者死亡前沒有得到診斷[1-2]。臨床研究顯示早期診斷和有效的抗結核治療是降低HIV/結核分枝桿菌(Mycobacterium tuberculosis, MTB)感染者病死率的重要措施[3]。目前傳統分離培養和藥物敏感(藥敏)試驗仍然是我國診斷和評判結核病療效的主要手段與金標準,但過程長達2~3個月,不能滿足臨床快速診斷需要。近年來DNA測序技術在MTB及其耐藥性診斷中得到推廣應用,其檢驗結果直觀可靠,能在1周內完成檢測,但對實驗室設施及技術要求高,難以在基層醫療機構推廣應用。線性探針技術(line-probe assay, LipA)是基于核酸雜交的一種檢測技術,通過檢測MTB耐藥特定基因rpoB的8l bp核心區域、katG密碼子和inhA啟動子的基因突變,預測RFP、INH耐藥表型。常用的試劑盒是GenoType MTBDRplus,可以對涂陽痰標本或分離株進行檢測,在6 h內獲得結核病及耐多藥結核病的診斷。該技術操作難度不大,具有二級以上生物安全資質的普通基因檢測實驗室均可以開展。LipA應用于肺結核病患者的耐藥性檢測具有較高的敏感度和特異性,是WHO推薦應用的分子生物學方法之一[4]。
HIV感染者免疫系統嚴重受損,繼發MTB感染的病理改變與HIV陰性MTB感染者的表現差異顯著。LipA應用于HIV/MTB感染者的MTB耐藥檢測是否與結核病總體人群一致值得探討。本研究采用GenoType MTBDRplus試劑盒對HIV/MTB感染者涂陽痰標本及臨床分離株進行檢測,以評價LipA對HIV/MTB感染者的檢測效能,同時進一步了解廣西地區HIV/MTB感染者耐藥MTB的基因型特征,為抗結核治療和耐藥防控提供理論依據。
1 材料與方法
1.1 標本來源 檢測標本取自2012年1月—2017年12月在南寧市第四人民醫院、柳州市龍潭醫院及廣西疾病預防控制中心治療的HIV/MTB感染者148例,其中107例為藥敏試驗的臨床分離株,41例為涂陽痰標本(金銨“O”或萋爾-尼爾遜染色),質控菌株H37Rv(ATCC27294)由中國疾病預防控制中心結核病參比實驗室提供。納入標準:①HIV感染的診斷依據《艾滋病診療指南(第三版)》[5];②MTB的診斷依據《肺結核診斷和治療指南》[6]。排除標準:排除非結核分枝桿菌感染的患者。
1.2 儀器與試劑 萋爾-尼爾遜及金銨“O”染色液、改良羅氏培養基、藥敏試驗及菌型鑒定采用的培養基均購自珠海BASO公司,培養基內藥物終濃度為異煙肼(isoniazid, INH)1 μg/ml和10 μg/ml, 利 福 平(rifampicin, RFP)50 μg/ml和250 μg/ml,對硝基苯甲酸 500 μg/ml,GenoType MTBDRplus試劑盒購自德國Hain Lifesciences公司;RCR擴增儀購自Biometra;TwinCubator雜交儀購自Hain Lifesciences公司。
1.3 檢測方法
1.3.1 分離培養、藥敏試驗和菌型鑒定依據《結核病實驗室標準化操作與網絡建設》操作[7],LiPA依據GenoType MTBDRplus試劑盒說明書進行。
1.3.2 耐藥判定及其相關定義 rpoB+katG和/或inhA突變判定為耐多藥(multi drug resistant,MDR);katG 或inhA突變判定為耐INH;rpoB突變判定為耐RFP;無rpoB、katG和inhA突變判定為敏感;MDR是指對一種以上的抗結核藥物至少包括RFP和INH同時耐藥。
1.3.3 耐藥基因擴增及測序 測序DNA制備與LipA核酸制備方法一致, H37Rv的katG、inhA基因序列來自GeneBank數據庫(http://www.ncbi.nlmnih.gov),根據基因序列設計引物(表1)。引物的合成、DNA擴增和測序由上海生工生物公司完成。采用DNAman 8.0軟件中的Multiple Alignment將測序結果與H37Rv株基因序列進行比對,確定基因突變位點。

表1 katG、inhA基因片段PCR擴增用的引物序列Table 1 Primers used to amplify fragment of katG and inhA
1.4 質量控制 每批號試劑檢測均用H37Rv標準株和陰性對照隨標本一起檢測。
1.5 統計學處理 運用SPSS 19.0軟件對數據進行處理。以藥敏試驗結果作為參考,2種檢測方法的一致性分析采用kappa一致性分析,kappa值表示不同級別的一致性:0~0.20,極低的一致性;0.21~0.40,一般一致性;0.41~0.60,中等一致性;0.61~0.80,高度一致性;0.81~1,幾乎完全一致。P<0.05為差異有統計學意義。
2 結 果
2.1 涂陽痰標本及臨床分離株耐藥MTB檢測 在41例涂陽痰標本中,LipA檢出MTB 37例,2例陰性,2例結果無法判讀;LipA檢出的MTB株中,11株顯示突變信號,其中MDR 5株、單耐INH 3株、單耐RFP 3株。對痰凃陽標本進行傳統培養與鑒定,37例檢出MTB,1例檢出非結核分枝桿菌,3例無細菌生長,藥敏試驗檢出MDR 5株、單耐INH 3株、單耐RFP 3株。2種耐藥檢測方法的結果見表2。

表2 37株MTB LipA檢測及藥敏試驗結果(株)Table 2 Results of LipA results and drug sensitivity test from 37 MTB samples(strains)
107株臨床分離菌中LipA檢出MTB 98株,7例陰性,2例結果無法判讀;98株MTB中,24株顯示突變信號(MDR 9株、單耐INH 12株、單耐RFP 3株),74株敏感。藥敏試驗檢出MDR 8株,單耐INH 11株,單耐RFP 4株,敏感75株,見表3。

表3 98株MTB LipA檢測及藥敏試驗結果(株)Table 3 Results of lipA and drug sensitivity test from 98 MTB samples(strains)
2.2 LipA與藥敏試驗結果比較 從臨床分離株和涂陽痰標本中均檢出MTB 135株。LipA和藥敏試驗均檢出RFP耐藥20株。RFP耐藥株中,LipA檢出MDR 14株、單耐RFP 6株,與藥敏試驗結果完全一致;INH耐藥株中,LipA檢出相關突變29株(包括MDR 14株、單耐INH 15株),藥敏試驗檢出耐藥菌27株,見表4。
2種檢測方法結果不一致4株,其中各有1株LipA檢測為rpoB+inhA、inhA及katG突變株而藥敏試驗顯示為INH敏感,1株藥敏試驗顯示INH耐藥而LipA未檢出katG或inhA突變。2者的一致性分析,LipA檢測INH耐藥、敏感的邊際頻率分別是0.21、0.78;藥敏試驗檢測INH耐藥、敏感的邊際頻率分別是0.20、0.80,kappa=0.969(μ=64.17,≥95%標準正態分位數1.96,故P<0.05)。依據一致性強度的參考判斷指標,認為2種檢測方法結果一致性極高。
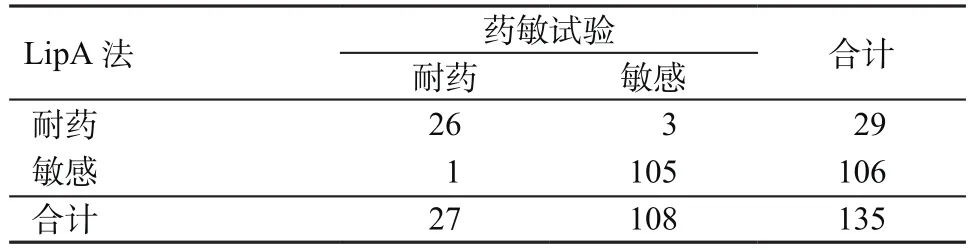
表4 LipA和藥敏試驗檢測135株MTB的INH耐藥性(株)Table 4 INH-resistance from 135 MTB detected by LipA and drug sensitivity test(strains)
在臨床分離株中,LipA檢出3株INH耐藥相關突變,而藥敏試驗顯示INH敏感(圖1)。進一步采用基因測序法進行驗證,結果顯示12號菌株katG在315位點發生了點突變, AGC>ACC(圖2A);13和14號株在inhA啟動子-15位點存在C>T突變(圖2B)。測序結果表明LipA檢測突變基因可信度高。
2.3 耐藥菌株基因突變類型、位點與頻率 2批標本中,LipA共檢測到rpoB突變20株(14.81%),katG或inhA突變29株(21.48%)。rpoB、katG及inhA突變類型、位點與頻率見表5。
3 討 論
LipA是WHO新推薦應用相對快速的耐多藥結核病診斷方法。有研究以藥敏試驗結果為標準,同時用LipA檢測武漢地區MTB對RFP和INH的耐藥性,2者的kappa值分別為0.94和0.85(P<0.05)[8],說明LipA與藥敏試驗結果差異無統計學意義。本研究結果顯示:LipA檢測涂陽痰標本和臨床分離株中MTB對RFP的耐藥性與藥敏試驗結果完全一致,對INH耐藥的檢測一致性強度也達到極高級(kappa=0.969),與文獻所報道的結核病總體人群的檢測結果一致。說明LipA對HIV/MTB雙重感染中MTB的耐藥性也具有良好的檢測效能,特別是檢測痰標本不須要經過分離培養程序,可以提高診斷速度,這對于HIV/MTB雙重感染的及時診斷和治療具有更重要意義。
在結核病總體人群中,INH耐藥株中約有34.6%~94.3%與katG 315位點突變相關,2.9%~21.5%在inhA啟動子區域發生突變;RFP耐藥株中超過95%是在rpoB耐藥決定區發生突變[9]。例如,云南和河南省INH耐藥株中katG 315、inhA及katG 315+inhA突變的頻率是92.80%、11.20%、4.00%和73.50%、35.64%、9.20%[10-11],徐州市、浙江省rpoB突變株中,S531L位點的突變頻率是61.0%和64.66%[12-13]。本研究中INH耐藥株中katG 315位點和inhA的突變頻率分別占82.76%和17.24%,katG 315位點的突變頻率與云南省相近,而inhA突變頻率遠低于河南省,未見katG 315+inhA突變型;在20株 RFP耐藥菌中,全部突變均發生于rpoB耐藥決定區,其中S531L占80.00%,高于徐州市和浙江省。本研究中INH、RFP耐藥的主要基因突變型與結核病總體人群基本一致,但突變類型少于結核病總體人群,可能與樣本量少有關;其次HIV/MTB感染者抗結核治療時間一般較HIV陰性MTB感染者短,發生耐藥突變的比率也相對低;此外還可能與不同地區MTB耐藥的基因突變類型差異有關。鑒于HIV/MTB感染者MTB耐藥性與結核病總體人群相近,當臨床難以獲得其病原菌耐藥性診斷時,治療用藥可適當參考當地結核病總體人群的耐藥參數。
本研究中有3例INH耐藥相關突變而藥敏試驗顯示INH敏感,1例INH耐藥而未檢測到katG或inhA突變。MTB對INH產生耐藥與多個功能基因(如inhA、kasA、ndh、katG等)和調控因子(如mabA-inh啟動子和oxyR-ahpC)的突變、缺失及插入有關,此外還有外排泵機制以及其他未知的機制等。LipA只是針對katG和inhA啟動子區域的基因突變檢測INH的耐藥性,所以出現藥敏試驗與基因型耐藥結果不一至的情況也可以理解。目前使用的基因測序法僅能檢測出耐藥亞群比例為20%以上的耐藥MTB,遠不及表型耐藥檢測達到1%的敏感度[14]。由此推測當耐藥亞群比例低于20%時,LipA也同樣存在漏檢的可能。
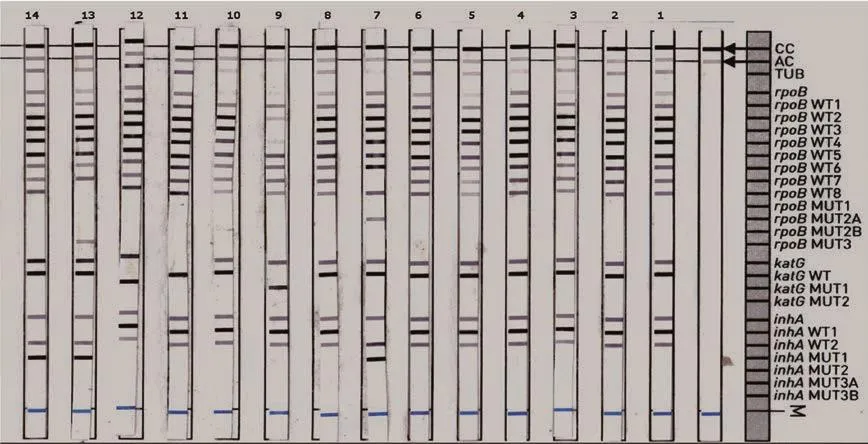
圖1 LipA檢測顯示突變信號的INH敏感標本12為katG突變(藥敏試驗INH敏感);14為inhA突變(藥敏試驗INH敏感);13為rpoB+inhA突變(藥敏試驗RFP耐藥而INH敏感)Figure 1 Mutation signals of INH-sensitive isolates by LipA

圖2 藥敏試驗與LipA法檢測結果不一致菌株的測序結果katG-12株系代表第12號菌株,pinhA-13/14株系代表13和14號菌株Figure 2 Sequencing results of isolates that are inconsistent between LipA and drug sensitivity test
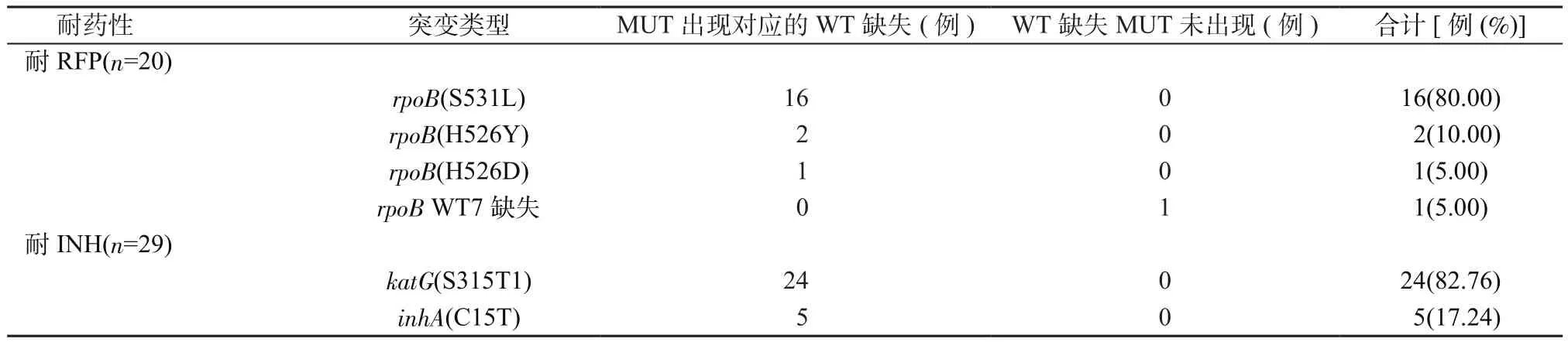
表5 INH和RFP耐藥突變位點Table 5 Mutation sites in the INH- and RFP-resistant MTB
而另一項研究發現,在藥敏試驗中通常耐藥性MTB的生長速率較慢,在體外培養中容易被生長速率快的非變異群體掩蓋[15],導致耐藥株在群體中的比例變小或消失,使藥敏試驗顯示敏感。在分子水平檢測的LipA則可以探測到被掩蓋的突變基因型,對藥敏試驗有補充作用。而僅采用一種方法評價MTB耐藥特征會存在漏檢或評價不全面的可能。
對于HIV/MTB雙重感染者而言,及時治療至關重要,可先采用LipA檢測菌株對一線抗結核藥物的耐藥性,隨后還是要采用藥敏試驗進一步診斷,以指導合理及正確用藥。對于具有典型耐藥相關基因(如katG和inhA)突變而暫時保持藥物敏感性的菌株,要多關注其耐藥變化,以便指導及時調整治療。
由于本研究樣本量有限,能觀察到的耐藥基因突變類型和位點相對欠缺,有待增大標本量進一步觀察。本研究中有7株經培養初步鑒定為MTB而LipA檢測為陰性的標本,我們未采用其他檢測方法進一步驗證。由于艾滋病合并結核病患者中非結核分枝桿菌感染的占比可達到40%~50%,而臨床實驗室主要是采用選擇性培養的方法進行鑒定,其結果判定受多種因素影響。因此,對于LipA檢測為陰性的菌株應考慮采用基因芯片和測序等其他技術進一步驗證。
總之,LipA檢測MTB耐藥性具有高度敏感性和特異性,可以直接檢測涂陽痰標本,適用于HIV/MTB雙重感染MTB耐藥性的快速篩查,且對藥敏試驗診斷具有良好的補充作用。
志謝感謝廣西疾病預防控制中心結核病防治所覃慧芳老師、廣西龍潭醫院中心實驗室曾蓉老師對本研究的幫助

