發酵羊乳及其抗氧化活性肽的研究
馬嵐,趙存朝,黃艾祥
(1.云南省瀘西縣農業環境監測保護站,云南瀘西 652499;2.云南農業大學食品科學技術學院,昆明 650201)
0 引 言
山羊乳營養豐富、易于吸收是乳品中的精品,主要營養成分含量均高于牛乳和人乳,其中酪蛋白、氨基酸和低聚糖組成模式接近母乳,具有獨特的生物活性性質,是一種理想的牛乳替代品[1-6]。山羊乳營養研究結果再次把山羊乳推薦為“替代牛乳治療營養不良兒童的有益選擇”,其中含有某些生長因子和生物活性物質,而這些物質在牛奶中可能并不存在[7]。近年來,乳及乳制品中的生物活性肽功能被大量研究。生理功能活性肽是從多種食物蛋白質經胃腸消化和食品原料經乳酸菌發酵而產生[8]。許多乳蛋白衍生肽具有抗菌、降血壓、抗血栓形成、抗氧化及免疫調節活性[9]。Korhonen等從酶消化的各種食物蛋白質中分離出降壓肽或ACE抑制肽[10],Nakamura等利用乳酸菌和酵母菌發酵脫脂乳純化出ACE抑制肽[11],Gobbetti等經嗜熱菌蛋白酶水解山羊β-乳球蛋白純化出4種新的ACE抑制肽[12];Suetsuna等證明αs-酪蛋白衍生肽具有清除自由基活性并能抑制酶促和非酶促脂質過氧化反應[13];IL Expósito等經胃蛋白酶水解綿羊乳發現4種抗菌肽。更多的研究表明源于山羊乳的抗血栓肽[14]、酪蛋白磷酸肽[15]、阿片類活性肽[16]等受到人們的極大關注。
酸奶一直被認為是一種功能性食品,除了含營養素外,還含有促進身體功能的成分[17]。酸奶在制作過程中加入活菌,增加酸乳制品的營養質量和風味。益生菌可以通過活菌在體內直接作用,另外,通過活菌細胞代謝產物間接作用,發酵乳中的多肽如酪新素[18]、酪激肽[19]、降血壓肽[20]、乳鐵蛋白肽[21]、凝血素抑制肽[22]等一些還沒被具體鑒定的肽。流行病學和動物實驗結果表明:酸奶及其細菌性成分對宿主免疫系統及其疾病控制起到了重要的作用,如免疫刺激特性[23]、腸道疾病[24]、癌癥[25]、心血管疾病[26]、乳糖不耐癥等[27]。本研究通過篩選高產抗氧化活性肽的乳酸菌,利用響應面法對產肽條件進行優化確定最優產肽參數,進而采用二次通用旋轉研制一種高產抗氧化肽的山羊發酵乳,并經體外胃腸道模擬測試山羊發酵乳抗氧化穩定性,同時促進山羊乳資源的開發利用,為抗氧化功能性乳制品的開發提供理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 試劑與菌株
L-谷光甘肽,北京北納創聯生物技術研究院;2,2-聯苯基-1-苦基肼基(DPPH)、30%過氧化氫(H2O2)、2,2'-聯氮-雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(ABTS),上海晶純生化科技股份有限公司;胃蛋白酶、胰蛋白酶,索萊寶生物科技有限公司。
CICC 6063嗜熱鏈球菌(Streptococcus thermophilus);CICC 6064瑞士乳桿菌(Lactobacillus helveticus);CICC 20264植物乳桿菌(Lactobacillus plantarum);CICC 20022植物乳桿菌亞種(Lactobacillus plantarum subsp.plantarum);CICC 20241副干酪乳桿菌(Lactobacillus paracasei);CICC 20262干酪乳桿菌(Lactobacillus paracasei);CICC 22150嗜酸乳桿菌(Lactobacillus acidophilus)。
1.1.2 儀器與設備
URA14M 0018分光光度計,上海翱藝儀器有限公司;TGL20M高速冷凍離心機,湖南湘立科學儀器有限公司;SVJ-358智能商用型酸奶機,北京世紀陽光;UL40BC乳成份分析儀,杭州浙大優創科技有限公司;SW-CJ-IF單人雙面超凈無菌操作臺,蘇州江東精密儀器有限公司;HPX-9272ME恒溫培養箱,上海博訊實業有限公司;GMSX-280壓力蒸汽滅菌器,北京市永光明醫療儀器有限公司。
1.2 方法
1.2.1 抗氧化活性肽的提取
取100 mL山羊乳85℃滅菌15 min,冷卻至45℃,接種乳酸菌,42℃發酵后4℃冷藏12 h,沸水浴滅酶10 min,4℃ 4 000×g離心10 min,取上清液,4℃冷藏備用。
1.2.2 發酵羊乳菌種篩選
(1)菌種活化分別取適量乳桿菌菌株凍干菌粉接種于10 mL滅苗MRS肉湯培養基中,旋渦混勻于37℃在恒溫培養箱中培養24 h得到一代菌懸液。按5%的接種量將一代菌懸液接種于MRS肉湯培養基中,37℃恒溫培養24 h得二代菌懸液。重復上述步驟37℃恒濕培養18 h,進行第三次活化得到三代活化菌懸液,4℃冰箱儲存備用。
(2)菌種馴化將活化后的乳酸菌接種到山羊乳中訓化增殖,依次調整菌種接種量為8%,4%,2%,40℃恒溫培養至凝乳,保證菌種活力能在4 h內凝乳。
(3)高產抗氧化肽菌種篩選按3%的接種量分別接種7株乳酸菌于滅菌山羊乳中,以水解度及ABTS自由基清除活性為指標,篩選高產抗氧化肽菌種。
1.2.3 發酵羊乳產抗氧化肽工藝優化
(1)發酵羊乳菌種配比
選取水解度及ABTS自由基清除能力最大的乳酸菌與嗜熱鏈球菌和瑞士乳桿菌以4%的接種量按(1∶1∶1;1∶2∶1;1∶1∶2;2∶1∶1;1∶1∶3))5種配比進行復配,接種發酵后取上清液測定水解度及ABTS自由基清除能力,確定山羊發酵菌種的最佳配比。
(2)發酵羊乳產抗氧化肽的單因素實驗
以水解度為評價指標,考察接種量(2%、3%、4%、5%、6%、7%)、發酵時間(6、7、8、9、10、11 h)、后熟時間(4、8、12、16、20、24 h)3個因素對其的影響,確定響應面最佳因素水平。
(3)響應面試驗因素水平表
在單因素試驗的基礎上,利用響應面Box-Behnken試驗設計,以水解度為響應值,選取水解度影響較為顯著的A接種量、B發酵時間、C后熟時間3個因素,進行3因素3水平的試驗設計,優化發酵山羊乳產抗氧化肽的工藝參數。響應面分析因素及水平見表1。

表1 響應面試驗分析因素與水平
1.2.4 水解度測定
水解度測定采用甲醛滴定法。
1.2.5 抗氧化活性測定
(1)DPPH·自由基清除能力測定參考等SLin的方法[28]。谷光甘肽作為標準品,繪制標準曲線回歸方程 為 :y=0.301x+0.203(0.301~1.81 mg/mL,R2=0.996);y為DPPH自由基清除率,x為谷光甘肽濃度。
(2)還原能力測定參考徐懷德等的方法[29]。谷光甘肽作為標準品,繪制標準曲線回歸方程為:y=0.0003x+0.0435(301~1806 mg/mL,R2=0.9986);y為吸光度,x為谷光甘肽濃度。
(3)總抗氧化能力測定(TEAC)參考T Valeriaa等的方法[30]。谷光甘肽作為標準品,繪制標準曲線回歸方程為:y=0.004x+0.027(30.1μg/mL~180.6μg/mL,R2=0.996);y為ABTS自由基清除率,x為谷光甘肽濃度。
1.2.6 發酵羊乳的研制
(1)工藝流程
山羊乳100 kg→65℃預熱→6~8 MPa均質→85℃殺菌15 min→冷卻至45℃→接種發酵劑→灌裝→發酵→冷藏→成品
(2)發酵羊乳單因素實驗
以感官評分為指標,考察糖添加量(7%、7.5%、8%、8.5%、9%)、淡奶油添加量(1%、1.5%、2%、2.5%、3%)、發酵溫度(38、40、42、44、46℃)3個因素對其影響,確定二次通用旋轉最佳因素水平。
(3)二次通用旋轉試驗因素水平表
在單因素試驗的基礎上,選擇糖添加量、淡奶油添加量和發酵時間3個因素,采用二次通用旋轉試驗設計,進行3因素5水平試驗,試驗因素水平見表2。

表2 二次通用旋轉因素水平表
(4)感官評價
組織15位具有一定專業知識的人員經培訓組成評價小組,分別從色澤1分、氣味2分、滋味4分及組織狀態3分4個方面對山羊發酵乳進行評定,最后得分為15位評分員評分的算術平均值。具體以上感官項目權重的分布見表3。

表3 山羊奶發酵乳的感官評價標準
1.2.7 模擬胃腸道消化
人工模擬腸液的配制:磷酸氫二鉀6.89 g,加500 mL蒸餾水溶解,再用0.4 mol/L NaOH溶液將其pH調至6.8,另取胰蛋白酶10 g加適量蒸餾水溶解,將兩液混合后,加水定容至1 000 mL。
人工模擬胃液的配制:將23.4 mL濃鹽酸加水稀釋至100 mL得到稀鹽酸,取16.4 mL稀鹽酸,加水約800 mL與10 g胃蛋白酶,混勻后加水稀釋至1 000 mL。
取山羊奶發酵乳5 mL,4℃4000×g離心10 min,取上清液測定抗氧化活性。山羊奶發酵羊乳p H值調至2.0,然后取1 mL接于含9 mL的人工胃酸試管中,充分混勻后37℃保溫2 h,沸水浴加熱10 min以終止反應。測定消化前后的抗氧化活性。再將其p H調至6.8,以1∶9的體積比加入至人工腸液中,于37℃恒溫水浴中模擬消化2 h,沸水浴加熱10 min以終止反應,再取樣測定其抗氧化。
2 結果與分析
2.1 發酵羊乳菌種篩選
乳酸菌沒有假單胞菌、枯草桿菌、地衣芽胞桿菌等的蛋白水解力,但其對乳制品蛋白水解具有改善制品風味和質地的作用,在干酪成熟中乳酸菌的蛋白水解及菌體破裂后釋放的酶發揮著重要作用。由圖1可以看出,7株乳酸菌在相同條件下ABTS自由基清除能力及水解度不同,且山羊乳蛋白水解度及ABTS自由基清除能力具有相關性;副干酪乳桿菌具有較強的蛋白水解能力及抗氧化活性,可用于山羊發酵乳的制作。

圖1 高產抗氧化肽的山羊發酵乳菌種篩選
2.2 發酵羊乳產抗氧化肽工藝優化
2.2.1 發酵羊乳菌種配比

圖2 乳酸菌配比對產抗氧化肽的影響
在酸奶、Mozzarella干酪的發酵過程中、混合菌株間的共生作用讓蛋白水解以促進菌株的生長;由圖2可知:試驗采用傳統發酵菌嗜熱鏈球菌、瑞士乳桿菌及篩選的高產抗氧化肽菌株副干酪按不同比例進行復配,發現1∶1∶2的比率能有效促進山羊乳蛋白水解且具有較強的抗氧化活力。
2.2.2 接種量對發酵羊乳產抗氧化肽的影響
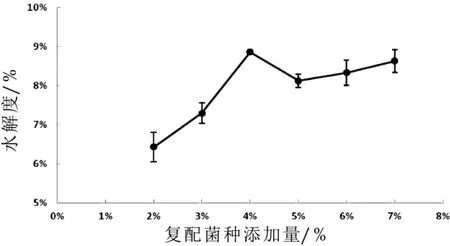
圖3 乳酸菌接種量對發酵山羊乳產抗氧化肽的影響
如圖3所示:隨著接種量的增加,水解度呈現先增大后減小的趨勢,在接種量為4%處達到最大值。隨著接種量的繼續增加,水解度反而降低,可能是由于山羊乳中的蛋白難以滿足過多菌體生長需求,產酸過多抑制了蛋白的水解;或菌體釋放的蛋白酶不利于在強酸條件下作用,活性被抑制。
2.2.3 發酵時間對羊乳產抗氧化肽的影響

圖4 發酵時間對山羊乳產抗氧化肽的影響
由圖4可以得出:隨著發酵時間的延長,山羊乳發酵在不過進行,水解度呈上升趨勢,但在發酵9h后,山羊發酵乳水解度趨于平緩;可能是由于隨著發酵乳發酵時間延長,羊乳中營養物質不足,抑制了乳酸菌的生長。
2.2.4 發酵羊乳后熟時間對產抗氧化肽的影響

圖5 后熟時間對山羊乳產抗氧化肽的影響
由圖5可知:隨著后熟時間的延長,水解度吳上升趨勢,山羊發酵乳的水解度緩慢增加;可能因為隨著發酵乳,發酵進行,羊乳中營養物質不足,為保證自身生產需要,乳酸菌菌體內的蛋白酶將多肽講一步水解,從而表現出水解度緩慢上升。
2.3 響應面優化
2.3.1 響應試驗設計及結果
根據單因素試驗結果,建立Box-Behnken Design中心組合設計試驗模型,通過擬合二次方程計算最優工藝組合以及發酵山羊乳最大理論水解度。選擇接種量(X1)、后熟時間(X2)、發酵時間(X3)進行三因素三水平響應面實驗,試驗結果見表3。
2.3.2 模型建立及顯著性檢驗
利用Design-Expert8.0.6軟件對表3進行多元回歸擬合,得到山羊發酵乳水解度與菌種添加量/%(X1)、后熟時間(X2)、發酵時間(X3)的二次方程模型為:Y=8.29+0.82X1-0.069X2+0.80X3-0.33X1X2+0.57X1X3+0.092X2X3-1.10X12-0.81X22-0.84X32回歸模型的方差分析結果見表4。

表3 響應面分析方案及結果
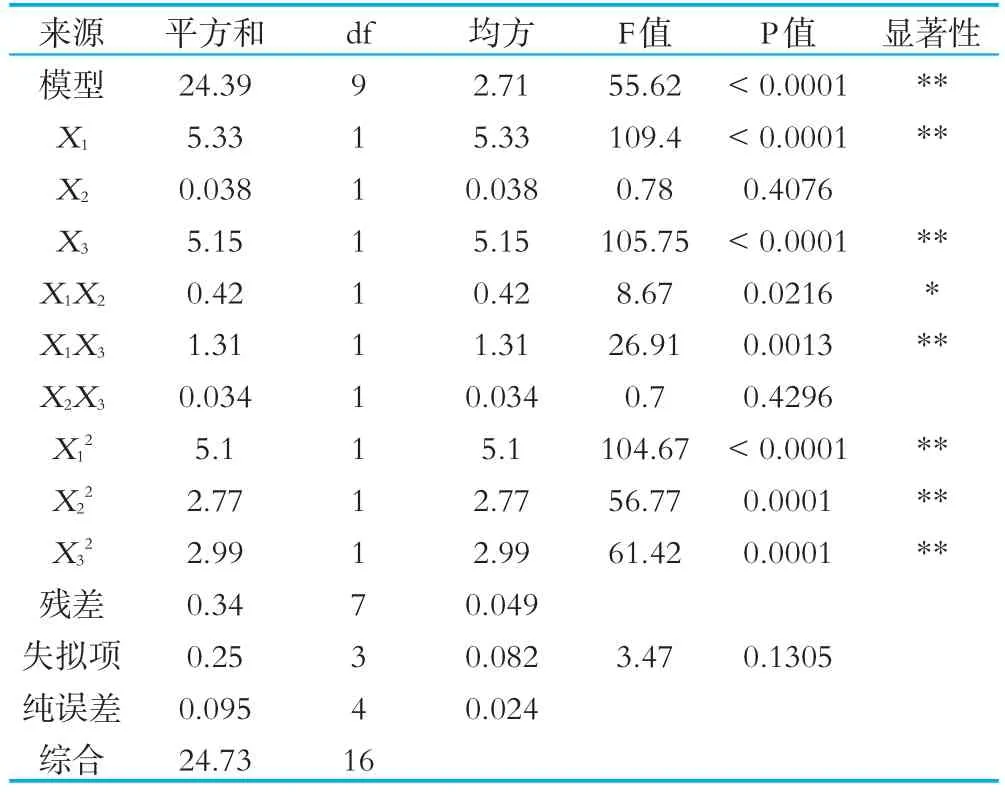
表4 水解度回歸模型方差分析表
由表3方差分析可知:水解度回歸模型顯著性檢驗P=0.0001<0.01,說明二次多元回歸模型極顯著;水解度回歸模型失擬性檢驗P=0.1305>0.05,可以認為所選山羊發酵乳水解度二次回歸模型與實際試驗擬合性充分模型失擬不顯著。山羊發酵乳水解度回歸診斷表明,決定系數R2=98.32%,信噪比Adeq precisior=3.16,這表明方程的擬合度和可信度均很高,可用于山羊發酵乳水解度評價。離散系數C.V(Y的變異系數)表示實驗本身的精確度,C.V值越小,實驗的可靠性越高,水解度擬合C.V值為3.16%。綜上所述,回歸模型擬合程度良好,試驗誤差小,能夠準確的分析和預測山羊發酵乳水解度,說明實驗操作可信度高,具有一定的實踐指導意義。由回歸系數顯著性表明,在所取因素水平范圍內,各因素對山羊乳水解度影響的順序為:接種量>發酵時間>后熟時間。
2.3.3 響應面優化
通過觀察圖6圖7中響應面的變化情況和等高線的稀疏程度可直觀地反映山羊發酵乳菌種添加量/%(X1)、后熟時間(X2)、發酵時間(X3)交互作用對水解度的影響,當等高線呈圓形時表示兩因素交互作用不顯著,而呈橢圓形或馬鞍形時則表示兩因素交互作用顯著。
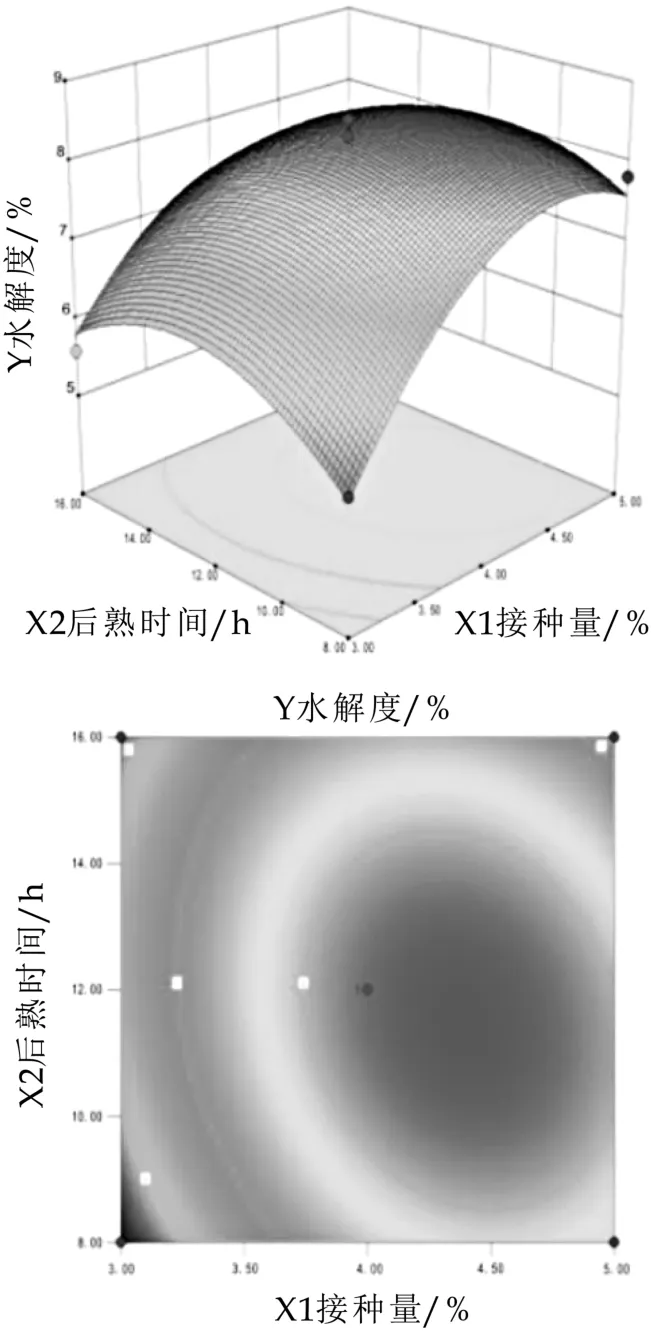
圖6 菌種添加量/%(X 1)、后熟時間(X 2)對水解度的影響

圖7 后熟時間(X2)、發酵時間(X3)時間對水解度的影響
圖6圖7為有二次回歸方程擬合得到的響應值Y的等高線及三維曲面圖,是回歸方程的形象描述。由圖可知,X1與X2,X1與X3之間交互作用顯著(P<0.05),對山羊乳水解度影響較大;由圖6可知,山羊發酵乳隨后熟時間和菌種添加量的增加而提高后趨近于平緩,后熟時間及添加量為12 h及4%時,山羊發酵乳趨于平緩,與單因素和方差分析結果相符。由圖7可知,發酵時間及添加量變化曲面比較陡峭,隨著發酵時間及添加量的增加水解度的呈先增長后下降的趨勢;交互作用顯著與方差分析結果一致。
2.3.4 最佳條件的確定和回歸模型的驗證
回歸模型通過響應面法得到最優山羊發酵乳產肽工藝條件為菌種添加量4.31%,后熟時間10.99 h,發酵時間9.54 h。考慮實際操作情況與設備參數狀況,確定山羊發酵乳產肽工藝條件為:菌種添加量4%,后熟時間11 h,發酵時間9.5 h,山羊發酵乳水解度預測值8.69%。在上述最佳條件下進行驗證實驗,得到山羊發酵乳水解度平均值9.43%,與理論值接近。
2.4 發酵羊乳單因素試驗
以感官評分為指標,考察糖添加量、淡奶油添加量、發酵溫度個因素對其影響,確定二次通用旋轉最佳因素水平,實驗結果見圖8-圖10。
圖8-圖10為發酵羊乳不同糖的添加量、淡奶油添加量、發酵溫度對感官評分影響的單因素試驗結果。由圖8可知:隨著糖的添加量增加,感官評分值呈現先增大后減小的趨勢,糖的添加量為8%時山羊發酵乳感官評分值最高為8%;由圖9可知:淡奶油添加量增加,感官評分只增加,但超過1.5時山羊發酵乳的獨特膻味被掩蓋,失去了山羊發酵乳原有風味,故選取最適添加量為1.5%;由圖10可知:隨著發酵山羊乳溫度的增加,感官評分值呈現先增大后減小的趨勢,在40℃時,山羊綜合感官評分值最優,但超過40℃時,山羊發酵乳不同程度的出現乳清析出,影響感官評分指標,故選取最適溫度為40℃。
2.5 發酵羊乳二次通用旋轉試驗
2.5.1 二次通用旋轉試驗方案及結果
在單因素試驗的基礎上,選擇糖的添加量、淡奶油添加量(%)和發酵溫度(%)3個因素,采用二次通用旋轉試驗設計,實驗結果見表5。
2.5.2 數學模型的建立與檢驗
二次通用旋轉試驗方案及結果見表3。利用DPS軟件對試驗結果進行分析,得到二次回歸模型為:Y=7.92216+0.00815X1+0.35746X2+0.01724X3-0.28935X12-0.12848X22+0.04122X32+0.02375X1X2-0.21375X1X3-0.12125X2X3
2.5.3 變量輪換直接尋優
根據已建立的數學模型,在-1.682≤X i≤1.682(i=1,2,3)范圍內,每個因素取5個水平(±1.682,±1,0),對53=125個方案進行統計尋優,在試驗范圍內感官評分最高值為8.59,此時各因素取值為:X1=-1,X2=1.682,X3=1.682,對應著糖的添加量7.5%,淡奶油添加量2.34%,發酵溫度43℃。
2.5.4 頻率分析及統計尋優

圖8 糖的添加量對感官評分的影響
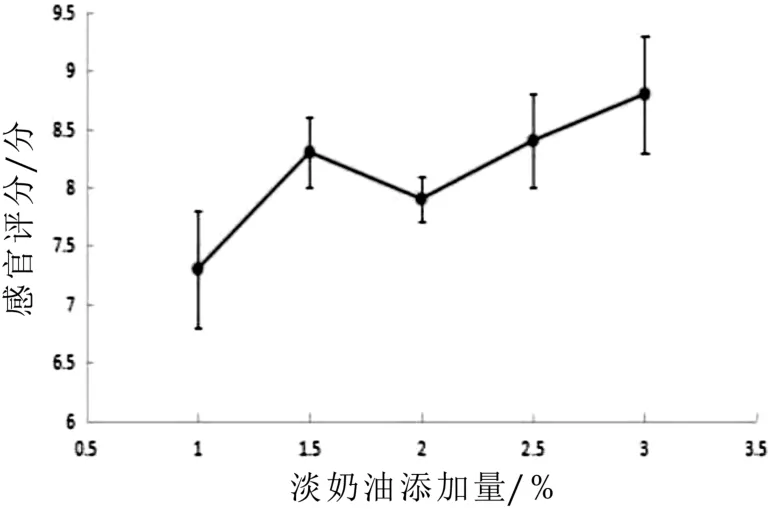
圖9 淡奶油添加量對感官評分的影響
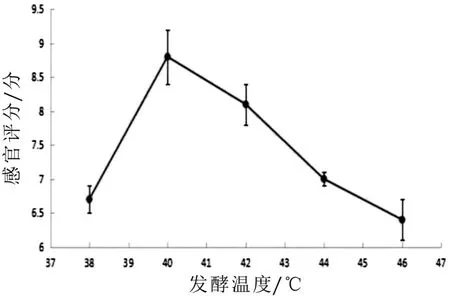
圖10 發酵油溫度對感官評分的影響
對不同設計水平下的組合進行模擬試驗,以均值7.66為臨界值,獲得大于臨界值的方案49個,各變量取值的頻率分布見表7。
由表7可以看出,在95%的置信區間感官評分值大于7.66的優化方案為:糖的添加量7.3505%~7.6495%,淡奶油添加量為1.057%~1.943%,發酵溫度為39.3℃~40.7℃。為了貼近實際的工業化生產,可將優化方案定為:糖的添加量7.5%,淡奶油添加量為1.5%,發酵溫度為40℃。
2.6 發酵羊乳在模擬胃腸液中抗氧化的變化
食物進入口腔、食管、胃、十二指腸、小腸、大腸時,胃是主要的消化場所,把大分子物質(主要是糖與蛋白質)分解為小分子;十二指腸也是消化的場所,主要是消化脂類;小腸是最主要的吸收場所,大部分營養都在小腸吸收;大腸是貯存食物殘渣的場所,同時吸收少量水分。經人工胃液、人工腸液消化后,發酵羊乳中抗氧化活性變化如表8所示。

表5 二次通用旋轉試驗方案及結果

表6 回歸方程方差分析表
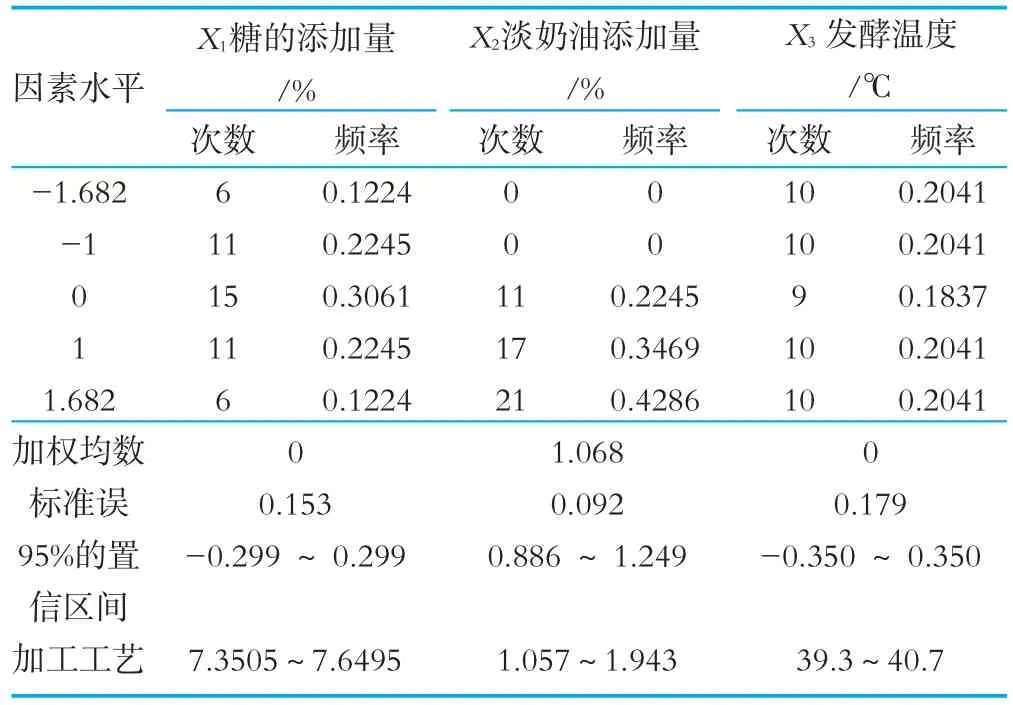
表7 優化提取方案中X i取值頻率分布表
由表8可見,山羊發酵乳中含有抗氧化活性肽,且具有較強的抗氧化能力;經模擬胃液和腸液消化試驗后,抗氧化活性較消化前有所下降,但下降幅度較小,消化后抗氧化活性依然存在,可見混合發酵菌株產生的活性肽經胃胰蛋白酶水解后,生成的產物仍具有一定的抗氧化活性。

表8 體外模擬胃腸道前后山羊乳多肽抗氧化活性變化
3 結 論
傳統發酵菌株保加利亞乳桿菌及與副干酪乳桿菌按1∶1∶2的菌株比例復配,山羊發酵乳水解度較高、ABTS自由基清除活性較強;通過響應面及二次通用旋轉旋轉試驗優化發酵羊乳的最適菌種添加量4%、蔗糖7.5%、淡奶油1.5%、40℃發酵9.5 h、后熟時間11 h。產品色香味俱佳、無明顯羊奶膻味,還原能力、總抗氧化、DPPH自由基清除等抗氧化活性較強。發酵羊乳的研究,為特色乳制品的開發提供參考,有利于促進羊乳產業的發展。

