兔脊柱結核模型中結核分支桿菌對人工骨與鈦金屬的黏附性比較
孫厚杰,鄢陵,蔡小軍,韓建華,范華華,李代君
(遵義市第一人民醫院,貴州遵義536000)
植骨融合內固定技術在脊柱結核病灶清除后能有效修復骨缺損、維持脊柱正常序列、重建脊柱穩定性[1,2]。但植骨材料的選擇一直困擾著業內專家、學者。自體骨取骨量大、患者痛苦。異體骨排異反應、可能導致疾病傳播。二者的廣泛應用受到一定限制。目前利用鈦金屬作為植骨支撐材料用于結核病灶內已被多數專家學者所接受[3,4],但缺點是由于接觸界面硬度不一致導致的鈦網下沉及X射線遮擋效應等不利于觀察融合效果。近年,n-HA/PA66復合材料在修復非感染性骨缺損方面得到良好的應用,是一種安全而有效植骨填充材料[5]。但其能否像鈦金屬一樣安全應用在結核性骨缺損中關鍵在于結核分支桿菌對該材料有無黏附性及黏附力強弱。2016年1月~2018年2月,我們通過建立動物結核模型觀察結核分支桿菌對兩種植骨材料的黏附情況,比較脊柱結核病灶清除后兩種不同材料人工骨植入的安全性問題。
1 材料與方法
1.1 材料 動物:健康新西蘭白兔35只(SPF級),雌雄不限,體質量2.0~3.0 (2.65±0.25)kg,由遵義醫學院動物實驗中心提供。動物經嚴格消毒,飼養條件:溫度(23±3)℃,相對濕度70%±10%,采用兔標準SPF級飼料飼養。實驗植骨材料:人型結核分枝桿菌標準菌株(H37Rv)由新疆畜牧科學院獸醫研究所提供;n-HA/PA66復合生物材料人工骨由四川國納科技有限公司提供;鈦金屬材料由山東威高醫療器械有限公司提供;氯胺酮(0.1 g/2 mL)由福建古田藥業有限公司生產;安定(10 mg/2 mL)由天津金耀藥業有限公司生產;阿托品(0.5 mg/mL)由天津藥業集團新鄭股份有限公司生產。
1.2 動物攻毒建模術 模型制備主要參照文獻[6]建模方法,并在此基礎上結合相關文獻[7~9]和實際情況有所改進建立模型。將實驗動物用氯胺酮、安定、阿托品聯合麻醉[氯胺酮、安定、阿托品按2∶2∶1(容積比)比例配制,生理鹽水稀釋1倍,用量約為2.5 ml/kg,耳緣靜脈緩慢靜注)],麻醉成功后,左側臥位固定在兔專用固定器上,右側腰背部脫毛、備皮,備皮直徑約6 cm,術區消毒、鋪巾,采用無菌器械沿右側第12肋末向下至髂嵴作約6 cm縱切口的側方入路,顯露腰5、6椎體。于腰5椎體下緣近下終板處,從右前上方向左后下方,與椎體近端呈60°進入,鉆孔(L: 0.5 cm、r: 0.25 cm),在注入結核分支桿菌前先加用硬化劑,然后填入醫用明膠海綿,用注射器緩慢向明膠海綿中注入結核菌懸液(菌量: 107CFU/mL)0.1 mL,用骨蠟封閉骨鉆孔,防止結核分支桿菌向周圍血液及組織擴散,采用1-0絲線間斷縫合切口,皮下涂灑注射用青霉素粉劑(80萬U/只),無菌紗布覆蓋切口,固定,動物術后單獨隔離飼養,自由活動。術后2個月內觀察動物一般狀態,如進食、活動、精神狀態、體溫、體質量等。密切注意切口情況(有無感染,如感染則立即淘汰)。術后當日及每周1次檢測血ESR、CRP,監測有無結核感染情況。術后當日、1個月、2個月進行X線片檢查,觀察造模區域有無膿腫和死骨形成,如有則記錄病灶數目、范圍、骨質破壞程度。X線檢查應統一曝光參數:正位片(44 kV、9.0 mAs、投照距離110 cm),側位片(45 kV、8.0 mAs、投照距離110 cm)。
1.3 分組及處理 將20只建模成功動物模型按成功時間序列號分成鈦金屬植入組和人工椎體植入組,每組10只。麻醉及顯露同攻毒建模術,適當清理周圍軟組織膿液與壞死組織(勿過度清理病灶以免影響結核分支桿菌正常黏附),制備內置物植入空間,將嚴格滅菌消毒的微型鈦板和n-HA/PA66人工骨材料,分別植入實驗動物結核病灶內,縫合處理同建模。術后當日及每周檢測1次體溫,血漿ESR、CRP,了解結核病灶進展情況。
1.4 材料表面黏附細菌數目觀察 植入內植物2個月后,采用過量的異戊巴比妥鈉麻醉處死,原切口進入術區,大體觀察結核病灶進展情況、周圍軟組織變化、有無膿腫及膿腫大小。通過掃描電鏡觀察鈦金屬、人工骨表面有無細菌黏附、聚集及產生類似生物保護膜。取出植入材料后,先用PBS緩沖液沖洗5遍,以除去表面未黏附的細菌。然后放置于4%戊二醛溶液中固定4 h以上,再用乙醇梯度脫水(依次為50%、70%、80%、90%濃度),自然干燥后噴金鍍膜備用。掃描電鏡下,每塊材料隨機抽取20個觀察區,每個觀察區面積為50 μm×50 μm,累計材料表面所黏附細菌數目。
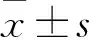
2 結果
2.1 造模后8周內動物體溫、ESR及CRP變化 椎體下終板鉆孔后填塞明膠海綿,注入結核菌株。建模2個月后模型兔出現黃白色腰大肌膿腫,膿腫內有砂礫樣感,X線顯示腰5椎體明顯骨破壞,累及腰6上終板及腰5~6椎間隙。造模后,動物血ESR在第1周明顯上升,以后逐漸降低,血CRP逐漸降低,體溫在第1周有短暫升高后逐漸回落,說明在造模過程中結核分支桿菌植入成功,無其他病原體感染。見表1。
2.2 兩組掃描電鏡觀察結果 結核分支桿菌對兩種植骨材料的黏附數量均很少,說明對兩種材料的黏附性較弱,細菌呈棒/桿狀、“Y”、“r”或“L”形,均未形成明顯保護膜及黏質樣物;人工材料其表面所黏附菌量較鈦網表面多。見圖1。
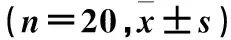
表1 建模成功模型8周內ESR、CRP、體溫變化

圖1 掃描電鏡檢查結果
注:a電鏡觀察鈦金屬表面結核分支桿菌黏附情況;b電鏡下人工骨材料表面結核分支桿菌黏附情況。
2.3 兩組結核分支桿菌黏附數量比較 鈦金屬植入組結核分支桿菌數量為(81.10±3.81)個,人工椎體植入組為(97.80±5.14)個。兩組比較,P=0.211。
3 討論
目前脊柱結核外科治療的經典術式為病灶清除植骨融合內固定術[10]。植骨材料主要有自體骨、異體骨和人工替代材料。前二者受到一定限制,自體骨易發生供骨區感染及取骨量的限制,而異體骨易發生宿主反應及疾病傳播,故人工替代材料的發現尤為重要。Oga等[11]從細菌黏附的角度研究表明,與金葡菌比較,結核分支桿菌不易黏附金屬異物表面,抗結核藥物仍能起作用。后來Ha等[12]的研究也為結核病灶中植入鈦合金材料的安全可行性提供了理論依據:鈦金屬組織相容性好,取材方便,支撐固定可靠,無自體骨及異體骨生物學方面限制;結核分支桿菌對鈦合金的親和力、黏附性小,不易形成生物膜。所以,作為植骨支撐材料,鈦網已被普遍用于脊柱結核病灶清除后植骨融合環節。研究[13,14]發現,鈦網也有其不足及應用限制,如接觸界面硬度不一致,鈦網下沉,使前柱高度有一定的減失,減失速率一般為4°~6°/2年;同時,鈦金屬對X射線的遮擋效應導致不利于觀察植骨融合效果,故尋求發現更優良的植骨材料成為國內外學者探求的目標。
植骨材料相關感染是導致植骨融合失敗的主要原因,而此類感染與細菌對材料的黏附密切相關,如細菌形成保護性生物膜則造成感染持續不愈,治療失敗。植物材料置入體內后,表面很快被覆蓋各種吸附蛋白,細菌首先可逆地附著于材料表面,隨后細菌依靠其菌毛、鞭毛、莢膜及分泌的細胞外黏質物(ESS)形成黏附并不斷繁殖,較多的ESS與細胞外基質蛋白如纖維蛋白原等共同形成生物膜,加速細菌的黏附,并保護細菌免受藥物及免疫攻擊,常規保守治療無效,導致植入失敗。n-HA/PA66作為新型植骨材料已被成功應用于創傷骨科植骨融合中,其具有良好生物相容性、骨傳導性、成骨活性及生物力學特性。但是脊柱結核屬感染性病灶,結核分支桿菌對n-HA/PA66的黏附性是決定其能否應用于結核病灶內的首要問題。
本研究通過掃描電鏡觀察,兩種植骨材料表面黏附的結核分支桿菌數量很少,僅少量細菌呈棒桿狀、“Y”、“r”或“L”形,細菌周邊亦未見明顯黏質樣物或明顯保護膜。因此可見,結核分支桿菌對兩種材料的黏附能力均較弱,原因可能與材料特性有關,也可能與結核分支桿菌無菌毛、鞭毛、莢膜等黏附“配體”,導致此菌活動力差有關。提示鈦金屬及n-HA/PA66人工材料均能安全應用于脊柱結核病灶中進行植骨融合。
周勁松等[15]研究發現,細菌的黏附與材料的性質關系不大,與材料表面的光滑度有一定關聯,呈負相關。本研究中掃描電鏡觀察發現,n-HA/PA66人工材料表面所黏附菌量明顯較鈦金屬表面多。其機理可能為:粗糙表面黏附表面積較大,其表面自由能、疏水性的會發生變化,表面的溝紋、凹陷部位為細菌黏附提供了“優勢”部位。由此同一材料其表面光滑度是細菌黏附力的重要影響因素。故出現此結果的原因可能與n-HA/PA66人工材料表面光滑度不及鈦金屬有關。
本研究還發現,盡管結核分支桿菌對兩類材料黏附性有差異,但統計學分析細菌黏附數量的差異無統計學意義。提示n-HA/PA66人工材料可能也可用于脊柱結核病灶中進行植骨融合。由于本研究樣本量小,可能存有誤差,結果不具有普遍性,加之n-HA/PA66人工材料表面硬度、光滑度不及鈦金屬,故應用于臨床治療結核性骨缺損還應慎重。

